oprócz przetwarzania białek, ER i Golgi zajmują się również niektórymi rodzajami transportu białek. Pęcherzyki (pęcherzyki związane z błoną, zasadniczo) odrywają się od ER, Golgiego i innych organelli błoniastych, niosąc ze sobą dowolne rozpuszczalne cząsteczki znajdujące się wewnątrz płynu, który został zamknięty, jak również wszelkie cząsteczki osadzone w tej części błony. Te pęcherzyki następnie złapać jazdę na silniku molekularnym, takim jak kinezyna lub miozyna, i podróżować wzdłuż cytoszkieletu aż do dokowania w odpowiednim miejscu docelowym i łączą się z błoną docelową lub organelle. Ogólnie rzecz biorąc, pęcherzyki przemieszczają się od ER do Golgi cis, od cis do Golgi przyśrodkowej, od przyśrodkowego do Golgi trans i od trans Golgi do błony plazmatycznej lub innych przedziałów. Chociaż większość ruchu odbywa się w tym kierunku, istnieją również pęcherzyki, które cofają się od Golgiego do ER, niosąc białka, które miały pozostać w ER (np. PDI)i zostały przypadkowo pobrane w pęcherzyku.
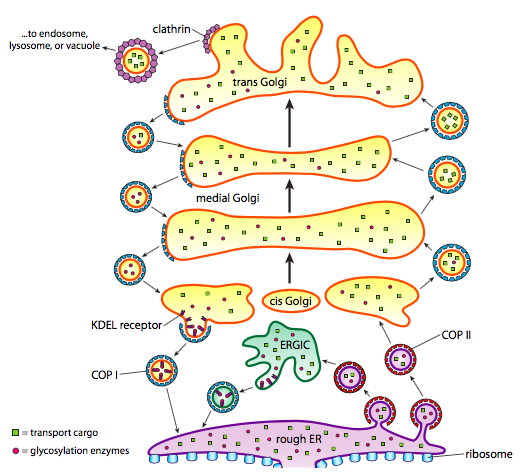
tworzenie pęcherzyków jest zależne od białek płaszcza, które w odpowiednich warunkach samoorganizują się w kuliste klatki. W połączeniu z białkami transbłonowymi mogą również pociągnąć dołączoną błonę wzdłuż w kulisty kształt. Głównymi rodzajami białek płaszczowych stosowanych w tworzeniu pęcherzyków są COPII, COPI i clathrin.
białka płaszcz COPII tworzą pęcherzyki, które przechodzą z ER do Golgi. Białka płaszcza Kopi są używane między częściami aparatu Golgiego, a także do tworzenia pęcherzyków przechodzących od Golgiego z powrotem do ER. W końcu klatrynę stosuje się do tworzenia pęcherzyków opuszczających Golgi do błony plazmatycznej, a także do pęcherzyków utworzonych z błony plazmatycznej do endocytozy.
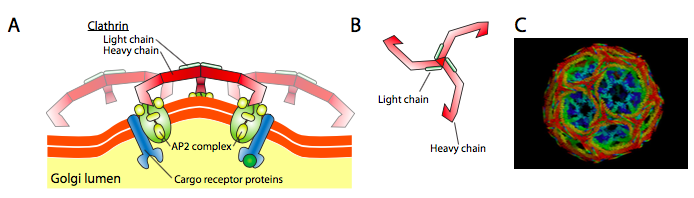
Clathrin (rysunek \(\PageIndex{17}\)) jest najlepiej opisany z trzech, a Płaszcze pęcherzykowe są wykonane z układów klathrin triskelions (z greckiego, co oznacza trójnożny). Każdy triskelion składa się z trzech ciężkich łańcuchów połączonych ze sobą na końcu C i trzech lekkich łańcuchów, po jednym związanym z każdym ciężkim łańcuchem. Ciężkie łańcuchy różnych triskelionów oddziałują na długość ich „nóg” ciężkich łańcuchów, tworząc bardzo solidną konstrukcję. Łańcuchy lekkie są niepotrzebne do tworzenia pęcherzyków i uważa się, że pomagają zapobiegać przypadkowym interakcjom cząsteczek klatryny w cytoplazmie.
istnieje znaczące podobieństwo między mechanizmami tworzenia pęcherzyków przy użyciu tych różnych białek płaszcza, począwszy od rekrutacji ARF1 (ARF oznacza czynnik rybozylacji ADP, który nie ma tutaj nic wspólnego z jego funkcją) do błony. Wymaga to ułatwionej przez ARNO wymiany GTP na GDP (ARNO to Otwieracz miejsca wiązania nukleotydów ARF). Po związaniu GTP przez ARF1, zmiana konformacyjna ujawnia N-końcową grupę miristoilową, która wkracza do błony. Zarówno Copi, jak i pęcherzyki pokryte klatryną używają ARF1 i ARNO, ale COPII używa podobnych białek zwanych Sar1p i Sec12p.
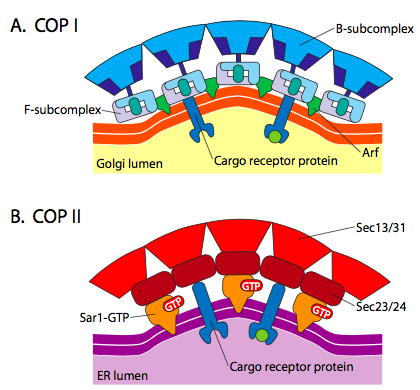
rysunek \(\PageIndex{18}\). Pęcherzyki pokryte COP
ARF1 (lub Sar1p) jest używany do rekrutacji białek adapterowych, które wiążą się z „ogonem” białek receptorowych związanych z błoną. Koniec biznesowy tych receptorów wiąże się z cząsteczkami car – go, które muszą być pakowane do pęcherzyka. Białka adaptera działają jako łącznik między błoną (poprzez receptory)a białkami płaszcza. W przypadku klatryny białkami adapterowymi są AP1 dla pęcherzyków pochodzących od Trans-Golgiego i AP2 dla pęcherzyków endocytarnych. W przypadku pęcherzyków COPI, przybliżone homologi to β-, γ-, δ – i ζ-COPs, podczas gdy system COPII używa Sec23p i Sec24p.
wreszcie, Adaptery łączą się z rzeczywistymi białkami płaszcza: klatryną, α – lub ε-COP, Sec13p i Sec31p. wszystkie te białka mają wspólną cechę: spontanicznie (tj. bez konieczności wydatkowania energii), samoorganizują się w kuliste struktury przypominające klatkę. Pod mikroskopem elektronowym pęcherzyki pokryte klatryną są ostro zdefiniowane, a sześciokątne i pięciokątne kształty ograniczone podjednostkami klatryny nadają pęcherzykowi wygląd „piłki nożnej”. COP coatamer-pokryte pęcherzyki są znacznie bardziej puszyste w wyglądzie pod EM.
wszystkie trzy rodzaje białek powłoki pęcherzyków mają zdolność do samoistnego łączenia się w kulistą konstrukcję, ale tylko pęcherzyki pokryte COPI i COPII również samoistnie „uszczypną” błonę, aby uwolnić pęcherzyk z jej błony wyjściowej. Pęcherzyki pokryte klatryną wymagają zewnętrznego mechanizmu uwalniania pęcherzyka (rysunek \(\PageIndex{19}\)).
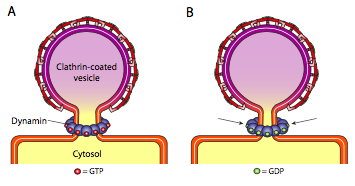
gdy pęcherzyk prawie się skończy, nadal istnieje niewielka łodyga lub szyjka błony, która łączy pęcherzyk z błoną. Wokół tej łodygi dynamiczne cząsteczki GTP łączą się w konstrukcję pierścieniową / spiralną. Cząsteczki dynaminy są globularnymi Gtpazami, które kurczą się po hydrolizie GTP. Kiedy łączą się wokół łodygi pęcherzyka, każde białko dynaminy kurczy się, z połączonym efektem zwężenia łodygi na tyle, że membrana ściska się razem, zamykając i uwalniając pęcherzyk z błony wyjściowej.
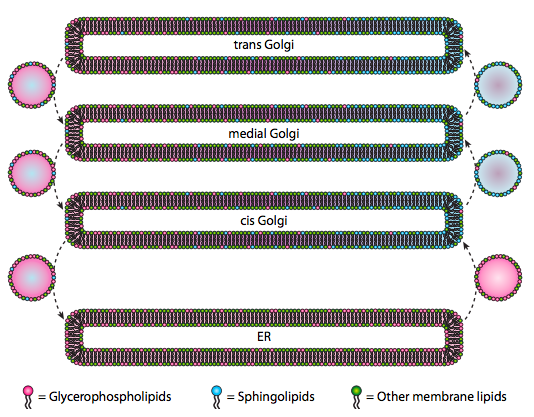
chociaż lipidy i błony zostały omówione w rozdziale 4, zaniedbaliśmy omówienie lokalizacji ich syntez u eukariotów. Jak pokazuje rysunek \(\PageIndex{20}\), synteza niektórych typów lipidów jest segregowana i wyłączna. Glicerofosfolipidy powstają głównie w retikulum endoplazmatycznym, chociaż powstają również w mitochondriach i peroksysomach. Natomiast sfingolipidy nie są wytwarzane w ER (choć ich prekursorami są ceramidy)u ssaków, niezbędne enzymy znajdują się w świetle cis i golgach przyśrodkowych. Istnieją dowody na ruch pęcherzyków przedtrzonowych i wstecznych między różnymi przedziałami Golgiego i ER, co teoretycznie wskazywałoby na redystrybucję typów lipidów. Jednak sfingolipidy mają tendencję do agregacji w tratwy lipidowe i wydają się być bardziej skoncentrowane w pęcherzykach poruszających się po przeszczepie.
białka płaszcza odpadają wkrótce po uwolnieniu pęcherzyków. W przypadku klatryny proces obejmuje Atpazę Hsc70. Jednakże w przypadku pęcherzyków powlekanych COPI lub COPII hydroliza GTP na ARF / Sar1p wydaje się osłabiać powinowactwo białka płaszcza do adapterów i inicjuje odklejanie. Aktywator GTPase jest szczeliną ARF (lub Sec23p) i jest integralną częścią powłoki COP I (lub II).
pęcherzyki przewożą dwie kategorie ładunków: białka rozpuszczalne i białka transbłonowe. Z rozpuszczalnych białek niektóre są pobierane w pęcherzyku z powodu wiązania się z receptorem. Inne białka po prostu się w pobliżu i są zbierane w miarę tworzenia pęcherzyków. Czasami pobiera się białko, które nie powinno być; na przykład PDI może być zamknięty w pęcherzyku tworzącym się z ER. Ma mało funkcji w Golgim i jest potrzebny na ostrym dyżurze, więc co się z nim dzieje? Na szczęście PDI i wiele innych białek ER ma C-końcową sekwencję sygnałową, KDEL (lizyna-kwas asparaginowy-kwas glutaminowy-leucyna), która krzyczy „należę do ER.”Sekwencja ta jest rozpoznawana przez receptory Kdel wewnątrz Golgiego, a wiązanie białek KDEL z receptorami wyzwala tworzenie pęcherzyków, aby wysłać je z powrotem do ER.
pęcherzyki wydzielnicze mają szczególny problem z rozpuszczalnym ładunkiem. Gdyby pęcherzyk polegał po prostu na zamykaniu w nim białek podczas procesu tworzenia, trudno byłoby uzyskać wysokie stężenia tych białek. Wiele wydzielanych białek jest potrzebnych organizmowi szybko i w znacznych ilościach, dlatego w transgatoriach istnieje mechanizm agregacji białek wydzielniczych. Mechanizm wykorzystuje agregujące białka, takie jak secretogranin II i chromogranin B, które łączą białka docelowe w dużych skoncentrowanych granulkach. Te graniny działają najlepiej w środowisku transgenicznym o niskim pH i wysokim Ca2+, więc gdy pęcherzyk uwalnia swoją zawartość poza komórkę, wyższe pH i niższy Ca2+ rozpadają Agregaty, uwalniając poszczególne białka.
podczas dojrzewania Golgiego następuje stała zmiana pH, tak że gdy przechodzimy z ER do Golgiego, każdy przedział ma stopniowo niższe (bardziej kwaśne) pH lumenalu.
wreszcie jest kwestia ukierunkowania pęcherzyków. Pęcherzyki są znacznie mniej użyteczne, jeśli są rzucane na pociąg towarowy i wyrzucane losowo. Dlatego istnieje mechanizm dokowania, który wymaga dopasowania białka V-SNARE na powierzchni cytoplazmatycznej pęcherzyka i T-SNARE na powierzchni cytoplazmatycznej błony docelowej. Fuzja pęcherzyka z błoną przebiega tylko wtedy, gdy jest dopasowanie. W przeciwnym razie pęcherzyk nie może się połączyć i przyczepić do innego silnika molekularnego, aby udać się do innego, miejmy nadzieję poprawnego, miejsca docelowego. Proces ten jest wspomagany przez wiązanie białek, które początkowo kontaktują się z przychodzącym pęcherzykiem i przyciągają go wystarczająco blisko celu, aby przetestować interakcję z białkiem werbla. Inne białka na pęcherzyku i błonie docelowej następnie oddziałują i jeśli sidła dopasować, może pomóc „wciągnąć” pęcherzyka do błony docelowej, po czym membrany bezpiecznik. Ważną zasadą zrozumienia fuzji pęcherzykowej, a także kierunkowości białek błonowych i lipidów, jest to, że cytoplazmatyczna strona błony zawsze będzie skierowana do cytoplazmy. W związku z tym białko, które ostatecznie znajduje się na zewnętrznej powierzchni błony komórkowej, zostanie wprowadzone do powierzchni lumenalnej błony ER, aby rozpocząć.
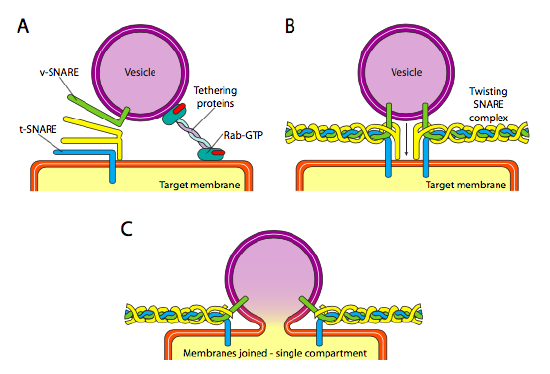
dokładniej, gdy pęcherzyk zbliża się do błony docelowej, wiązanie białka Rab-GTP, które jest połączone z błoną docelową za pomocą podwójnego ogona lipidowego geranylgeranylu, luźno łączy się z pęcherzykiem i utrzymuje go w pobliżu błony docelowej, aby dać siłom szansę na działanie. V-SNAREs i T-SNAREs mają teraz możliwość interakcji i przetestowania meczu. Ostatnio Werble zostały przemianowane odpowiednio na R-Werble i Q-Werble, w oparciu o zachowane pozostałości argininy i glutaminy. Oprócz tych dwóch pierwotnych werbli, co najmniej jeden inny werbel jest zaangażowany, razem tworząc wiązkę czterech α-Helis (cztery, Nie trzy, ponieważ przynajmniej w najlepiej zbadanym przykładzie, jeden z werbli jest wygięty wokół tak, że dwie z jego Alfa-helikalnych domen uczestniczą w interakcji. Cztery helisy owijają się wokół siebie i uważa się, że w ten sposób ciągną pęcherzyki i błonę docelową razem.
Toksyna tężca, tetanospasmina, która jest uwalniana przez bakterie Clostridium tetani, powoduje skurcze, działając na komórki nerwowe i zapobiegając uwalnianiu neuroprzekaźników. Mechanizm tego polega na tym, że rozszczepia synaptobrew, białko werbla, Tak że pęcherzyki synaptyczne nie mogą łączyć się z błoną komórkową. Toksyna botulinowa, z Clostridium botulinum, działa również na sidła, aby zapobiec fuzji pęcherzyków i uwalnianiu neuroprzekaźników, chociaż atakuje różne neurony, a więc ma odwrotny efekt: tężec jest spowodowany zapobieganiem uwalnianiu neuroprzekaźników hamujących, podczas gdy botulizm jest spowodowany zapobieganiem uwalnianiu pobudzających neuroprzekaźników.