cele uczenia się
- Zdefiniuj lub opisz:
- metabolizm
- reakcja kataboliczna
- reakcja anaboliczna
- enzym
- substrat
- Apoenzym
- Haloenzym
- kofaktor (koenzym)
- stan, w jaki sposób enzymy są w stanie przyspieszyć tempo reakcji chemicznych.
- krótko opisz uogólnioną reakcję enzymu z substratem, opisz funkcję miejsca aktywnego enzymu i opisz, w jaki sposób enzym jest w stanie przyspieszyć reakcje chemiczne.
- podaj cztery cechy enzymów.
- podaj, jak następujące czynniki wpływają na szybkość reakcji enzymatycznej.
- stężenie enzymu
- stężenie substratu
- temperatura
- pH
- stężenie soli
- stan, w jaki sposób chemikalia, takie jak chlor, jod, jodofory, rtęć i tlenek etylenu hamują lub zabijają bakterie.
- podaj, jak wysoka temperatura i niska temperatura wywierają wpływ na bakterie.
aby żyć, rosnąć i rozmnażać się, mikroorganizmy przechodzą różne zmiany chemiczne. Zmieniają składniki odżywcze, dzięki czemu mogą wejść do komórki i zmieniają je po wejściu, aby zsyntetyzować części komórek i uzyskać energię. Metabolizm odnosi się do wszystkich zorganizowanych reakcji chemicznych w komórce. Reakcje, w których związki chemiczne są rozkładane, nazywane są reakcjami katabolicznymi, podczas gdy reakcje, w których związki chemiczne są syntetyzowane, nazywane są reakcjami anabolicznymi. Wszystkie te reakcje są pod kontrolą enzymów.

enzymy są substancjami obecnymi w komórce w małych ilościach, które działają w celu przyspieszenia lub katalizowania reakcji chemicznych. Na powierzchni enzymu znajduje się zwykle mała szczelina, która działa jako miejsce aktywne lub miejsce katalityczne, do którego jeden lub dwa specyficzne substraty są w stanie się związać. (Wszystko, co enzym normalnie łączy się z, nazywa się substratem.) Wiązanie substratu z enzymem powoduje, że elastyczny enzym zmienia nieznacznie swój kształt w procesie zwanym indukowanym dopasowaniem, tworząc półprodukt tempore zwany kompleksem enzymatyczno-substratowym (rysunek \(\PageIndex{1}\)).
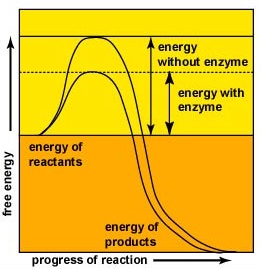
enzymy przyspieszają tempo reakcji chemicznych, ponieważ obniżają energię aktywacji, energię, która musi być dostarczona, aby cząsteczki mogły ze sobą reagować (rysunek \(\PageIndex{2}\)). Enzymy obniżają energię aktywacji, tworząc kompleks enzymatyczno-substratowy, umożliwiający tworzenie i uwalnianie produktów reakcji enzymatycznej (rysunek \(\PageIndex{3}\)).
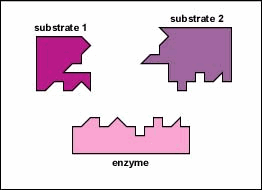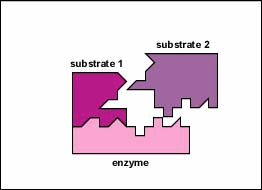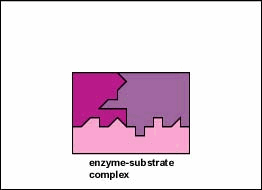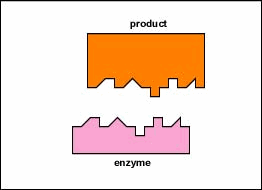
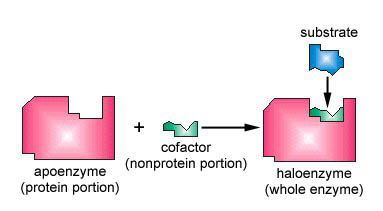
wiele enzymów wymaga kofaktora bez protein, aby pomóc im w reakcji. W tym przypadku część białkowa enzymu, zwana apoenzymem, łączy się z kofaktorem, tworząc cały enzym lub haloenzym (rysunek \(\PageIndex{3}\)). Niektóre kofaktory to jony, takie jak Ca++, Mg++ i K+; inne kofaktory to cząsteczki organiczne zwane koenzymami, które służą jako nośniki dla grup chemicznych lub elektronów. Nad+, NADP+, FAD i koenzym A (CoA) są przykładami koenzymów.
charakterystyka enzymów
chemicznie enzymy są na ogół białkami kulistymi. (Niektóre cząsteczki RNA zwane rybozymami mogą być również enzymami. Zwykle znajdują się one w regionie jądrowym komórek i katalizują rozszczepienie cząsteczek RNA). Enzymy są katalizatorami, które rozkładają lub syntetyzują bardziej złożone związki chemiczne. Umożliwiają one reakcje chemiczne zachodzące wystarczająco szybko, aby podtrzymać życie. Enzymy przyspieszają tempo reakcji chemicznych, ponieważ obniżają energię aktywacji, energię, która musi być dostarczona, aby cząsteczki mogły ze sobą reagować. Wszystko, co enzym normalnie łączy, nazywa się substratem. Enzymy są bardzo wydajne. Enzym zazwyczaj może katalizować od 1 do 10 000 cząsteczek substratu na sekundę. Enzymy są obecne tylko w małych ilościach w komórce, ponieważ nie są zmieniane podczas ich reakcji. i są bardzo specyficzne dla ich podłoża. Na ogół istnieje jeden specyficzny enzym dla każdej konkretnej reakcji chemicznej.
aktywność enzymu
na aktywność enzymu wpływa wiele czynników, w tym:
- stężenie enzymu: Zakładając, że dostępne jest wystarczające stężenie substratu, zwiększenie stężenia enzymu zwiększy szybkość reakcji enzymu.
- stężenie substratu: przy stałym stężeniu enzymu i przy niższych stężeniach substratów stężenie substratu jest czynnikiem ograniczającym. Wraz ze wzrostem stężenia substratu wzrasta szybkość reakcji enzymu. Jednak przy bardzo wysokich stężeniach substratów enzymy stają się nasycone substratem, a wyższe stężenie substratu nie zwiększa szybkości reakcji.
- temperatura: Każdy enzym ma optymalną temperaturę, w której działa najlepiej. Wyższa temperatura na ogół powoduje wzrost aktywności enzymów. Wraz ze wzrostem temperatury wzrasta ruch cząsteczkowy, co powoduje więcej zderzeń cząsteczkowych. Jeśli jednak temperatura wzrośnie powyżej pewnego punktu, ciepło będzie denaturować enzym, powodując utratę jego trójwymiarowego funkcjonalnego kształtu przez denaturowanie jego wiązań wodorowych. Z drugiej strony zimna temperatura spowalnia aktywność enzymu, zmniejszając ruch cząsteczkowy.
- pH: Każdy enzym ma optymalne pH, które pomaga utrzymać jego trójwymiarowy kształt. Zmiany w pH mogą denaturować enzymy poprzez zmianę ładunku enzymu. Zmienia to wiązania jonowe enzymu, które przyczyniają się do jego funkcjonalnego kształtu.
- stężenie soli: każdy enzym ma optymalne stężenie soli. Zmiany stężenia soli mogą również powodować denature enzymów.
niektóre związki między enzymami bakteryjnymi a stosowaniem środków dezynfekujących i ekstremalnymi temperaturami do zwalczania bakterii.
- wiele środków dezynfekujących, takich jak chlor, jod, jodofory, rtęć, azotan srebra, formaldehyd i tlenek etylenu, inaktywuje enzymy bakteryjne, a tym samym blokuje metabolizm.
- wysokie temperatury, takie jak autoklawowanie, gotowanie i pasteryzacja, denaturacje białek i enzymów.
- niskie temperatury, takie jak chłodzenie i zamrażanie, spowalniają lub zatrzymują reakcje enzymatyczne.
podsumowanie
- enzymy są substancjami obecnymi w komórce w małych ilościach, które działają w celu przyspieszenia lub katalizowania reakcji chemicznych, więc zachodzą wystarczająco szybko, aby utrzymać życie.
- na powierzchni enzymu znajduje się zazwyczaj mała szczelina, która działa jako miejsce aktywne lub miejsce katalityczne, do którego jeden lub dwa specyficzne substraty są w stanie się związać.
- wszystko, co enzym normalnie łączy się z, nazywa się substratem.
- Wiązanie substratu z enzymem powoduje, że elastyczny enzym zmienia nieznacznie swój kształt w procesie zwanym indukowanym dopasowaniem, tworząc tymczasowy związek pośredni zwany kompleksem enzymatyczno-substratowym.
- enzymy przyspieszają tempo reakcji chemicznych, ponieważ obniżają energię aktywacji, energię, która musi być dostarczona, aby cząsteczki mogły ze sobą reagować.
- wiele enzymów wymaga kofaktora bez protein, aby pomóc im w reakcji. W tym przypadku część białkowa enzymu, zwana apoenzymem, łączy się z kofaktorem, tworząc cały enzym lub haloenzym.
- niektóre kofaktory to jony, takie jak Ca++, Mg++ i K+; inne kofaktory to cząsteczki organiczne zwane koenzymami, które służą jako nośniki dla grup chemicznych lub elektronów. Nad+, NADP+, FAD i koenzym A (CoA) są przykładami koenzymów.
- chemicznie enzymy są na ogół białkami kulistymi. Niektóre cząsteczki RNA zwane rybozymami mogą być również enzymami, Zwykle działającymi do rozszczepiania cząsteczek RNA.
- enzymy występują tylko w niewielkich ilościach w komórce, ponieważ nie ulegają zmianie podczas reakcji i są wysoce specyficzne dla ich substratu.
- na aktywność enzymu wpływa wiele czynników, w tym stężenie enzymu, stężenie substratu, temperatura, pH i stężenie soli.
autorzy i atrybuty
-
Dr Gary Kaiser (COMMUNITY COLLEGE of BALTIMORE COUNTY, Catonsville CAMPUS)