reakcja: uwodnienie alkinów
podobnie jak w przypadku alkenów,uwodnienie (dodanie wody) do alkinów wymaga silnego kwasu, Zwykle kwasu siarkowego, i jest ułatwione przez siarczan rtęci. Jednak w przeciwieństwie do dodatków do wiązań podwójnych, które dają produkty alkoholowe, dodanie wody do alkinów daje produkty ketonowe (z wyjątkiem acetylenu, który daje aldehyd octowy ). Wyjaśnienie tego odchylenia leży w tautomeryzacji enol-keto, zilustrowanej następującym równaniem. Produktem początkowym z dodania wody do alkiny jest enol (związek posiadający podstawnik hydroksylowy przyłączony do wiązania podwójnego), który natychmiast przekształca się w bardziej stabilny tautomer ketonowy.
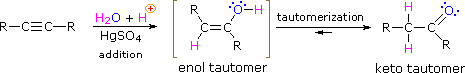
Tautomery są definiowane jako szybko interkonwertowane izomery konstytucyjne, zwykle wyróżnia się inną lokalizacją wiązania dla chwiejnego atomu wodoru (tutaj zabarwiony na czerwono) i inaczej zlokalizowanym wiązaniem podwójnym. Równowaga między tautomerami jest nie tylko szybka w normalnych warunkach, ale często silnie sprzyja jednemu z izomerów ( na przykład aceton to 99,999% keto tautomer ). Nawet w takich jednostronnych równowagach dowody na obecność mniejszego tautomeru pochodzą z zachowania chemicznego związku. Równowagi tautomeryczne są katalizowane przez śladowe ilości kwasów lub zasad, które są zwykle obecne w większości próbek chemicznych. Trzy przykłady przedstawione poniżej ilustrują te reakcje dla różnych podstawień wiązania potrójnego. Etap tautomeryzacji jest oznaczony czerwoną strzałką. W przypadku końcowych alkinów dodawanie wody odbywa się zgodnie z zasadą Markownikowa, jak w drugim przykładzie poniżej, a produkt końcowy to keton metylowy ( z wyjątkiem acetylenu, pokazanego w pierwszym przykładzie ). Dla alkinów wewnętrznych ( Wiązanie potrójne znajduje się w dłuższym łańcuchu ) dodawanie wody nie jest regioselektywne. Jeśli Wiązanie potrójne nie jest symetrycznie zlokalizowane (tj. jeśli R & R ’ w trzecim równaniu nie są takie same) powstaną dwa Ketony izomeryczne.
HC≡CH + H2O + HgSO4 & H2SO4 –> –> H3C-CH=O
RC≡CH + H2O + HgSO4 & H2SO4 –> –> RC(=O)CH3
RC≡CR’ + H2O + HgSO4 & H2SO4 –> –> RCH2-C(=O)R’ + RC(=o)-CH2R’
po dodaniu wody alkiny można uwodnić, tworząc enole, które samoistnie tautomeryzują się do ketonów. Reakcja jest katalizowana przez jony rtęci. Podąża za regułą Markownikowa: Końcowe alkiny dają Ketony metylowe
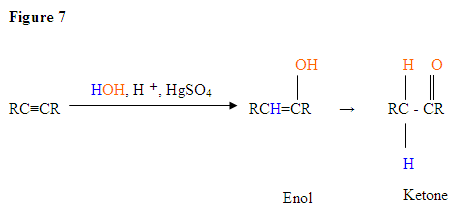
- pierwszym etapem jest reakcja kwasowo-zasadowa, w której elektrony π wiązania potrójnego działają jak zasada Lewisa i atakują proton, a tym samym protonizują węgiel z większością podstawników wodoru.
- drugim etapem jest atak nukleofilowej cząsteczki wody na karbokationę elektrofilową, która tworzy jon oksoniowy.
- następnie deprotonujesz zasadą, wytwarzając alkohol zwany enolem, który następnie tautomeryzuje się w keton.
- Tautomeryzm jest równoczesnym przesunięciem wiązania protonowego i podwójnego, które przechodzi z postaci enolu do postaci izomeru ketonowego, jak pokazano powyżej na fig.
spójrzmy teraz na reakcje uwodnienia.
uwodnienie końcowych alkinów wytwarza ketony metylowe
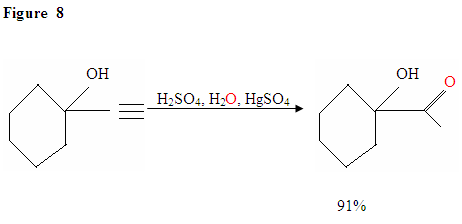
jak opisano na fig. 7, elektrony π zaatakują proton, tworząc karbokację, która następnie zostaje zaatakowana przez nukleofilowe cząsteczki wody. Po deprotinacji generujemy enol, który następnie tautomeryzuje do postaci ketonowej.
nawodnienie alkiny
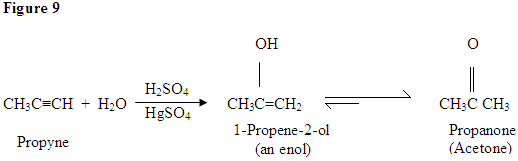
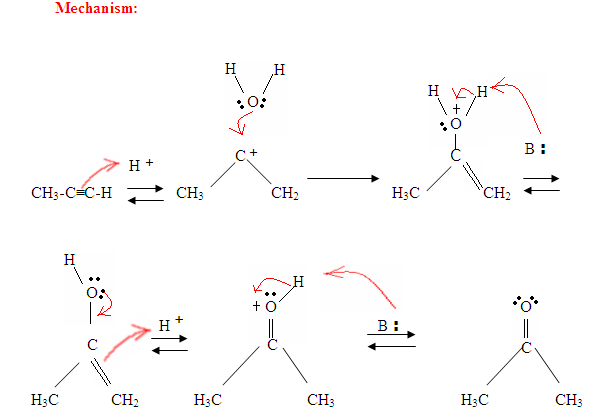
jak widać tutaj, elektrony π wiązania potrójnego atakują proton, który tworzy wiązanie kowalencyjne na węglu z większością podstawników wodoru. Po związaniu wodoru następuje karbokacja, która zostaje zaatakowana przez cząsteczkę wody. Teraz mamy dodatni ładunek na tlen, który powoduje, że baza wchodzi i deprotinuje cząsteczkę. Po deprotynacji otrzymujemy enol, który następnie ulega tautomeryzacji.
Tautomeryzm jest tutaj pokazany, gdy proton zostaje zaatakowany przez podwójne wiązanie elektronów π tworzących wiązanie kowalencyjne między węglem a Wodorem na mniej podstawionym węglu. Elektrony z tlenu przemieszczają się do węgla, tworząc podwójne wiązanie z węglem i dając sobie ładunek dodatni, który następnie zostaje zaatakowany przez zasadę. Zasada deprotynuje tlen, dając bardziej stabilny produkt końcowy w równowadze, którym jest keton.
ćwiczenia \(\PageIndex{1}\)
- narysuj strukturę produktu powstałą, gdy każda z poniższych substancji jest traktowana H2O/H2SO4 w obecności HgSO4.
- $ \ ce {\sf{CH3-CH2-C#C-H}}$
-
- narysuj strukturę formy ketonowej związku pokazanego poniżej. Jaka forma powinna być najbardziej stabilna?
Odpowiedz
odpowiedzi:
forma keto powinna być najbardziej stabilna.
pytania
Q9.4.1
od czego zacząć alkinę, aby uzyskać następujące produkty w reakcji utleniania? Pamiętajcie o rezonansie.

Q9.4.2
Zaproponuj schemat reakcji dla następującego związku, zaczynając od alkiny i wykazując wymagane odczynniki i półprodukty.

Rozwiązania
S9.4.1

S9.4.2
