dyskusja
określiliśmy tutaj rozmiary genomu 25 gatunków chironomidów; wartości te były zgodne z rozmiarami genomu trzech gatunków wcześniej opisywanymi w literaturze (Petitpierre, 1996; Schmidt-Ott et al., 2009), które zawierały od 0,13 do 0,21 pg DNA. Wyniki tego badania wykazały, że rozmiary genomu chironomidów były jednolicie bardzo małe (Fig. 3, Tabela 1). Uzyskana Średnia wartość C dla rodziny Chironomidae wynosi 0,13 + 0.03 PG DNA, który jest wyraźnie mniejszy niż rozmiar genomu D. melanogaster. Najmniejszy rozmiar genomu wśród owadów odnotowano w Strepsiptera Caenocholax fenyesi z około 0,11 PG DNA (co odpowiada mniej więcej 108 Mb), chociaż zasugerowano również, że mucha Heska Mayetiola destructor ma jeszcze mniejszy rozmiar genomu 0,09 pg (Johnston et al., 2004; Gregory, 2014). Przedstawiamy tu co najmniej trzy gatunki o mniejszych genomach niż jakikolwiek znany owad: C. tsushimensis, Diamesa japonica i Hydrobaenus tsukubalatus, o wartościach C odpowiednio 0,07 pg, 0,08 pg i 0,08 pg (Tabela 1). Według naszej wiedzy, C. tsushimensis (rys. 1B) może być obecnie uważany za najmniejszy rozmiar genomu dowolnego znanego owada, o wartości C 0,07 PG DNA, odpowiadającej w przybliżeniu 68 Mb. Wartość ta jest zgodna z wielkością genomu pokrewnego gatunku, Clunio marinus, który oszacowano kiedyś na 95 Mb, a ostatnio na 87,2 Mb (Kaiser and Heckel, 2012; Tobias S. Kaiser, personal communication).
Ostatnio zsekwencjonowano Genom antarktycznego midge, B. Antarktyda (Kelley et al., 2014). Autorzy twierdzili, że wielkość genomu tego gatunku szacowana jest na 89.5-105 Mb, był najmniejszy spośród wszystkich owadów. Jednak pokazujemy tutaj, że ten rozmiar genomu mieści się w normalnym zakresie wartości chironomidów. Autorzy zasugerowali również, że mały rozmiar genomu B. antarctica był adaptacją do ekstremalnie zimnego środowiska. Nasze dane mogą potwierdzić tę hipotezę, ponieważ D. japonica, gatunek alpejski z podrodziny Diamesinae również prezentuje niewielki rozmiar genomu. Inne pokrewne Diamesinae, Himalayan midge Diamesa sp. stwierdzono, że jest aktywny w temperaturach tak niskich, jak -16°C (Kohshima, 1984). Jednak Telmatogeton japonicus, który jest również zdolny do rozwoju w bardzo niskich temperaturach (Danks, 1971; Sunose i Fujisawa, 1982), wykazuje stosunkowo duży rozmiar genomu, w porównaniu do średniej rodziny chironomidów. Należy tu wziąć pod uwagę filogenetyczny wpływ na wielkość genomu, ponieważ B. antarctica należy do podrodziny Orthocladiinae, która średnio prezentuje niewielkie rozmiary genomu. Gatunki C. tsushimensis i Hydrobaenus tsukubalatus, wykazujące najmniejsze rozmiary genomu wśród chironomidów, również należą do podrodziny Orthocladiinae. Tak więc, mały rozmiar genomu B. Antarktyda może po prostu stanowić cechę przodków, a nie wynik ekstremalnie zimnej adaptacji.
P. vanderplanki jest jedynym znanym gatunkiem owada, który osiąga anhydrobiozę w stanie całkowicie odwodnionym (Fig. 1D) i odzyskać po nawodnieniu (Hinton, 1951, 1960a; Watanabe, 2006; Cornette i Kikawada, 2011). Nasza grupa badawcza opublikowała niedawno analizę porównawczą sekwencji genomu Tolerującego wysuszanie Polypedilum vanderplanki i wrażliwego na wysuszanie congeneric Polypedilum nubifer (Gusev et al., 2014). Porównanie wykazało, że oba gatunki miały podobne rozmiary genomu i że tylko ograniczony zestaw zduplikowanych klastrów genowych był związany z anhydrobiozą u p. vanderplanki(Gusev et al., 2014). Rozmiary genomu wnioskowane z montażu genomu wynosiły 104 Mb dla P. vanderplanki i 107 Mb dla P. nubifer i wartości te nie różniły się znacząco od rozmiarów genomu mierzonych dla tych gatunków w niniejszym badaniu, co odpowiadało około 98 Mb. P. vanderplanki i P. genomy nubifera wykazywały podobny niski odsetek powtórzeń DNA i znaleziono tylko niewielką liczbę elementów transponowalnych w porównaniu z innymi gatunkami dipteranów. To zmniejszenie proporcji elementów transponowalnych zaobserwowano również w Antarktyce midge, B. Antarktyda (Kelley et al., 2014). Średnia długość intronu została również znacznie zmniejszona w antarktycznej midge, a także w P. vanderplanki i P. nubifer (Gusev et al., 2014). Ponieważ osuszanie wrażliwe i zamrażać nietolerancyjne P. nubifer dzieli te cechy z Midge Antarktyczną i midge anhydrobiotyczną, niski udział elementów transponowalnych i krótka długość intronu mogą stanowić cechę wspólną dla wszystkich chironomidów i mogą nie być bezpośrednio związane z tolerancją na ekstremalne środowiska, nawet jeśli nie można wykluczyć efektu adaptacyjnego.
3.
Phylogeny of Diptera showing estimated C-values. Rodzina Chironomidów występuje w kolorze czarnym. Linia dash pokazuje wielkość genomu D. melanogaster. Kladogram filogenetyczny jest zgodny z różnymi drzewami Chironomidów i Dipteranów (Yeates and Wiegmann, 1999, 2005; Saether, 2000; Cranston et al., 2012). Paski błędów pokazują odchylenie standardowe. Rozmiary genomu bez pasków błędów uzyskano z wcześniejszych badań wymienionych w bazie danych rozmiarów genomu zwierząt (Gregory, 2014).
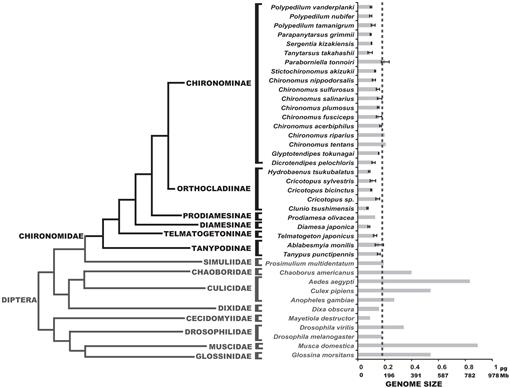
Fig. 4.
zależność między wielkością ciała a wielkością genomu wśród gatunków chironomidów badanych w niniejszym badaniu. A) dla każdego gatunku średnia całkowita długość ciała jest wyrażona w milimetrach, a średnia wartość C jest wyrażona w pg DNA. Pomiędzy tymi dwiema zmiennymi zaobserwowano jedynie słabą dodatnią korelację (r2 = 0,171, n = 25) zmaterializowaną przez linię stałą. B) na poziomie rodzaju, środki o tych samych wartościach zostały przekształcone metodą filogenetycznie niezależnych kontrastów, w oparciu o filogenezę Cranston et al. (2012). Korelacja pomiędzy tymi przekształconymi kontrastami, zmaterializowanymi przez ciągłą linię, nie była znacząca (r2 = 0,118, n = 13). Analizę danych przeprowadzono na Prism 4.0 oprogramowanie dla Macintosh (GraphPad Software, Inc.).

jakie mogą być cechy adaptacyjne potencjalnie związane z małymi rozmiarami genomu wśród rodziny Chironomidae? W rzeczywistości, kilka czynników rozwojowych i ekologicznych zostały zasugerowane korelować do rozmiarów genomu. Po pierwsze, pozytywna korelacja pomiędzy wielkością genomu i wielkością ciała została znaleziona w wielu taksonach i ta korelacja pojawia się jako stosunkowo ogólne zjawisko (Gregory, 2005). Korelacja ta została odnotowana również u komarów (Ferrari i Rai, 1989), ale nie zawsze jest ona jasna w innych taksonach owadów (Gregory i Hebert, 2003; Ardila-Garcia i Gregory, 2009). U chironomidów stwierdzono jedynie słabą dodatnią korelację między wielkością genomu a wielkością ciała (rys. 4a). Średnia wartość C Dla Rodzaju Chironomus (0,15 pg) była wyższa niż dla rodzaju Polypedilum (0,10 pg), a tę różnicę można przypisać większemu rozmiarowi ciała gatunku Chironomus. Jednak filogenetyczna odległość między obydwoma rodzajami może również tłumaczyć tę różnicę rozmiarów genomu. W konsekwencji poprawiliśmy nasze dane na poziomie rodzaju za pomocą filogenetycznie niezależnej analizy kontrastów (Garland and Adolph, 1994; Garland et al., 2005) i w rezultacie korelacja między wielkością genomu i wielkością ciała okazała się nieistotna (rys. 4B). Wąski zakres rozmiarów genomu Chironomida (tylko dwa-trzy) i przeciętna mała wielkość ciała tych gatunków (większość nie przekracza kilku milimetrów) prawdopodobnie utrudniają znalezienie jakiejkolwiek korelacji między obiema cechami w obrębie rodziny Chironomidae.
wśród owadów sugerowano inną korelację między wielkością genomu a złożonością rozwojową. Natomiast owady hemimetabolowe, ze stopniowymi tylko moltami nimfowymi, wykazują szeroki zakres rozmiarów genomu (wartości C od 0,18 do 16.93 pg), holometabolowe owady z ich złożoną metamorfozą mają wartości C ograniczone do domniemanego progu 2 pg, dla większości z nich (Gregory, 2002, 2005). Wpływ złożoności rozwojowej na wielkość genomu jest tutaj oczywisty, ponieważ holometabolowe owady przechodzą intensywną przebudowę morfologiczną w ograniczonym czasie metamorfozy, a mały rozmiar genomu zapewnia korzyści dla osiągnięcia podziałów komórkowych w wysokim tempie. Chironomidy są owadami holometabolowymi, a ich metamorfoza jest niezwykle szybka. Ich stadium poczwarki może trwać tylko jeden dzień, a nawet kilka godzin dla niektórych gatunków (Cranston, 1995c). Na przykład C. tsushimensis wykazuje złożoną metamorfozę z wyraźnym dymorfizmem płciowym (Fig. 1B).
zależność między wielkością genomu a szybkością podziału komórek wpływa również na szybkość rozwoju. Na przykład sugerowano, że szybki cykl życia mszyc jest związany z ich małymi rozmiarami genomu (Ma et al., 1992). Tak więc małe rozmiary genomu powinny stanowić korzyść dla chironomidów szybko rozwijających się w środowiskach tymczasowych. Chironomidy z rodzaju Clunio mogą rozwijać się w tymczasowe baseny pływowe, a także wykazywać zsynchronizowane pojawienie się dorosłych w związku z cyklem księżyca i podczas krótkiego okna odpływu (Kaiser and Heckel, 2012). Aby to osiągnąć, potrzebny jest wysoki wskaźnik rozwoju. Należy zauważyć, że małe annelidy polychaete rozwijające się szybko w podobnych środowiskach śródmiąższowych wykazują mniejsze rozmiary genomu niż gatunki makrobentowe(Gambi et al., 1997). Dla muszek antarktycznych, takich jak B. antarctica lub Eretmoptera murphyi (Lee et al., 2006; Worland, 2010), rozwój larw trwa dwa lata, głównie w stanie zamrożonym, ale metamorfoza i rozmnażanie muszą wystąpić w bardzo krótkim okresie letnim. W tym przypadku potrzebny jest wysoki wskaźnik rozwoju, co może być ułatwione przez mały Genom B. antarctica. Zjawisko to zostało zilustrowane badaniem roślin okrytonasiennych, pokazującym, że gatunki zdolne do ukończenia całego cyklu życiowego podczas krótkiego lata Antarktycznego prezentowały najmniejsze rozmiary genomu(Bennett et al., 1982). Inny skrajny, anhydrobiotyczny midge P. vanderplanki jest przystosowany do efemerycznych basenów skalnych. Tutaj ponownie, wysoki wskaźnik rozwoju w tymczasowym siedlisku może być związany z małą wielkością genomu tego gatunku. Jednak Australijski gatunek P. tonnoiri, który jest również narażony na osuszanie na podobnych basenach skalnych (Jones, 1975; Adams, 1985; Frouz et al., 2003), wykazuje stosunkowo duży rozmiar genomu dla chironomida (Fig. 3 I Tabela 1).
naprężenia abiotyczne mogą również wpływać na integralność DNA, a w konsekwencji na wielkość genomu. Na przykład larwy P. wanderpianki doświadczają masywnego uszkodzenia DNA po anhydrobiozie, a skuteczna naprawa DNA następuje w ciągu kilku dni po nawodnieniu (Gusev et al., 2010). U roślin stwierdzono ujemną korelację między wielkością genomu a tolerancją na promieniowanie (Bennett and Leitch, 2005), a szybkość mutacji była również niższa u gatunków o mniejszej wielkości genomu (Abrahamson et al., 1973). W konsekwencji, mały rozmiar genomu P. vanderpianki może stanowić zaletę w celu uniknięcia gromadzenia się szkodliwych mutacji podczas zdarzeń naprawy DNA związanych z cyklami osuszania i nawadniania. Jako gatunek morski, C. tsushimensis jest również narażony na wysoki stres zasolenia, który jest śmiertelny dla większości gatunków owadów. Wysokie zasolenie i inne stresy abiotyczne powodują wewnątrzkomórkowe reaktywne formy tlenu (ROS), które sugerowano jako główne źródło uszkodzenia DNA (Franca et al., 2007; Gill i Tuteja, 2010). Może to być również związane z małym rozmiarem genomu. Jednak inne gatunki morskie i wysoko tolerujące zasolenie, takie jak T. japonicus czy Chironomus salinarius, nie wykazują tak małych rozmiarów genomu jak C. tsushimensis. Gatunki kwasoodporne, takie jak Chironomus sulfurosus, Chironomus acerbiphilus lub Polypedilum tamanigrum (Fig. 1C) może przetrwać w gorących źródłach o pH tak niskim jak 1,4 (Doi et al., 2004; Takagi et al., 2005). Tutaj znowu, żadny jasny korelacja między tolerancja kwaśny stres i mały Genom rozmiar móc obserwować i filogenetyczny wpływ wydawać się ważniejszy, z Mniejszy Genom rozmiar dla rodzaj Polypedilum i większy Genom rozmiar w rodzaj Chironomus.
podsumowując, niewielkie rozmiary genomu obserwowane u chironomidów są prawdopodobnie wynikiem rodowego zmniejszenia liczby transponowalnych elementów i długości intronów w ich strukturze genomu. Wśród rodziny Chironomidae rozmiary genomów różniły się w zależności od filogenezy na poziomie podrodziny i na poziomie rodzaju. Jak wywnioskowano na podstawie korelacji w różnych taksonach, mały rozmiar genomu chironomidów teoretycznie mógł stanowić preadaptację do niestabilnych i ekstremalnych środowisk poprzez wysoki wskaźnik rozwoju i niski wskaźnik mutacji. Mamy nadzieję, że to badanie zachęci przyszłe projekty genomu Chironomidów i że genomika porównawcza w ramach tego taksonu pomoże zrozumieć, w jaki sposób genomy Chironomidów oddziałują ze swoim środowiskiem.