wprowadzenie
enzymatyczne działanie fosfodiesterazy typu 5 (PDE5) jest głównym mechanizmem inaktywacji cGMP, późniejszego mediatora środka rozszerzającego naczynia tlenku azotu (NO) (Lugnier, 2006).
w przebiegu zaburzeń erekcji (ED) zaburzenie wytwarzania NO z naczyń jamistych śródbłonka można farmakologicznie przezwyciężyć za pomocą inhibitorów PDE5 (PDE5i) w celu przedłużenia okresu półtrwania cGMP i wzmocnienia resztkowej funkcji rozszerzania naczyń krwionośnych (Hawksworth and Burnett, 2015). Kilka cząsteczek o działaniu hamującym na PDE5 zostało następnie zaprojektowanych i wypuszczonych na rynek, wykazując różny początek i czas trwania efektu. Obecnie PDE5i są lekami pierwszego wyboru stosowanymi w leczeniu zaburzeń erekcji (Mehrotra et al., 2007).
pomimo uznanej skuteczności u prawie 80% niezelekcjonowanych pacjentów z zaburzeniami erekcji (Eardley i wsp ., 2010; Hatzimoratidis et al., 2010; Porst et al., 2013), w ostatnim czasie donoszono o niezwykłym wycofaniu się z leczenia PDE5i. Pod względem ilościowym odnotowano średni wskaźnik przerwania leczenia wynoszący 4% na miesiąc, a całkowite zaprzestanie leczenia w 50% przypadków w ujęciu rocznym(Carvalheira i wsp ., 2012; Corona et al., 2016). Wśród głównych powodów podanych przez pacjentów, aby uzasadnić rezygnację z terapii, brak skuteczności i skutki uboczne są określane jako najbardziej rozpowszechnione(Corona et al., 2016). Można wyróżnić dwa rodzaje działań niepożądanych: te ściśle związane z hamowaniem PDE5, takie jak ból głowy, uderzenia gorąca i niestrawność, oraz te związane z resztkową aktywnością hamującą leków na inne PDE, takie jak rozszerzenie naczyń i tachykardia (PDE1), zaburzenia widzenia (PDE6) i ból pleców (PDE11) (Bischoff, 2004; Gupta i in., 2005). Ponieważ występowanie działań niepożądanych wzrasta wraz z poziomem w surowicy i czasem ekspozycji na lek(Gupta et al., 2005; Taylor et al., 2009), profil bezpieczeństwa / skuteczności leku można alternatywnie poprawić poprzez podejście farmakokinetyczne poprzez zaprojektowanie nowego preparatu leku (Mehrotra et al., 2007). Podejście to zostało z powodzeniem zastosowane do PDE5i w przypadku wardenafilu. Rzeczywiście, ta cząsteczka cierpi na stosunkowo niską biodostępność (∼15%, Center for Drug Evaluation and Research, 2003). W porównaniu z tabletkami powlekanymi (FCT), oryginalna postać do klasycznego podawania per os, postać tabletek do sporządzania zawiesiny doustnej (ODT) dla wardenafilu, znacząco zwiększała biodostępność leków, sprzyjając wchłanianiu podjęzykowemu, przy czym metabolizm pierwszego przejścia jest mniej zależny od drogi podania (Heinig et al., 2011).
syldenafil (Sild) był pierwszym selektywnym inhibitorem PDE5 zatwierdzonym do leczenia zaburzeń erekcji (Boolell i wsp., 1996). Jest to stosunkowo lipofilowa cząsteczka, a po podaniu doustnym maksymalne stężenie w osoczu osiąga się w czasie od 0,5 do 2 godzin. Sild wykazuje stosunkowo niską biodostępność po podaniu doustnym (38-41%), głównie ze względu na rozległy metabolizm jelit i pierwszego przejścia (Gupta i wsp., 2005). Pomimo długiej obecności na rynku, rozwój nowych preparatów leku jest słabo realizowane, aż do niedawnego wprowadzenia na rynek włoski nowego preparatu: Oro-dispersible film (ODF). Rzeczywiście, ODF został zatwierdzony jako biorównoważna forma FCT (Leoni et al., 2013). Jednak preparaty rozpadające się doustnie mogą stanowić odpowiednie systemy sprzyjające wchłanianiu przez błony śluzowe, a w szczególności pod-językowemu (Kathpalia and Gupte, 2013).
w tym badaniu oceniliśmy farmakokinetykę Sild związaną z podjęzykowym podawaniem ODF lub ODT, w porównaniu do FCT jako oryginalnego preparatu na os. W tym celu zbadaliśmy profil uwalniania / przenikania różnych preparatów Sild przez systemy in vitro opracowane specjalnie do oceny wchłaniania przez błony śluzowe leków. Ponadto określiliśmy ilościowo profile farmakokinetyki Sild w surowicy po podaniu per os FCT oraz podjęzykowego ODT i ODF u pacjentów z zaburzeniami erekcji.
materiały i metody
Chemikalia i preparaty leków
roztwór soli równowagi Hanka pH 7,4 (HBSS), roztwór HEPES, benzanilid i cytrynian Sild zostały zakupione w Sigma–Aldrich (Mediolan, Włochy). Aby uniknąć jakichkolwiek mylących wyników wynikających ze stosowania alternatywnych produktów biorównoważnych dostępnych na rynku, zastosowano następujące produkty: Viagra® FCT (Pfizer, Mediolan, Włochy), Viagra ORO® ODT (Pfizer) i Rabestrom® ODF (IBSA, Lodi, Włochy). Leki były przepisywane pacjentom podczas badania ambulatoryjnego do użytku prywatnego. W przypadku testów in vitro i oceny farmakokinetyki in vivo (patrz poniżej) leki zostały zakupione przez personel biorący udział w badaniu w lokalnych placówkach aptecznych, a następnie poddane obróbce/przechowywane w optymalnych warunkach.
Test dezagregacji
testy dezagregacji in vitro przeprowadzono zgodnie z Farmakopeą Europejską (2016) przy użyciu testera dezagregacji tabletek (Sotax DT 2, Rysunek uzupełniający S1A), używając wody jako płynu zanurzeniowego w temperaturze 37 ± 0,5°C. czas dezagregacji sprawdzano przy całkowitym dezagregacji postaci dawkowania. Całkowitą dezintegrację definiuje się jako stan, w którym wszelkie pozostałości jednostki pozostające na ekranie aparatu badawczego lub przylegające do dolnej powierzchni dysków stanowią miękką masę bez namacalnie twardego rdzenia. Testy przeprowadzono w trzech egzemplarzach, a wyniki podano jako wartość średnia ± odchylenie standardowe.
Test rozpuszczania
testy rozpuszczania in vitro przeprowadzono zgodnie z Farmakopeą Europejską . Testy rozpuszczania przeprowadzono przy użyciu urządzenia łopatkowego, prędkość łopatkowa 50 obr. / min, a hbss pH 7,4 zastosowano jako średnią objętość rozpuszczania (900 ml w temperaturze 37 ± 0,5°C).
podczas testów uwalniania, 2 ml próbki medium rozpuszczającego, w 0, 2, 4, 6, 10, 20, 30, i 40 minut, usunięto i przesączono przez filtr estrów celulozowych 0,45 µm, a zatem rozcieńczono. Następnie kwantyfikację Sild przeprowadzono metodą wysokosprawnej chromatografii cieczowej (HPLC) – UV. Usunięta objętość była za każdym razem zastępowana świeżym medium. Testy przeprowadzono w trzech egzemplarzach, a wyniki podano jako wartość średnia ± odchylenie standardowe. Znormalizowano dane dotyczące zawartości leku w preparacie.
Test przenikania przez błonę śluzową
profil przenikania przez błonę śluzową Sild oceniano in vitro przy użyciu specjalnego urządzenia zgodnie z Delvadia et al. (2012) Krótko mówiąc, urządzenie składało się z pionowego systemu dyfuzji, w którym znajdowały się Komory dawca–odbiornik oddzielone jednorazową membraną celulozowo–octanową (por 0,45 µm). Komórka dawcy zawierała 1,5 ml HBSS, natomiast komora odbiorcza była częścią zamkniętego obwodu recyrkulacji o pojemności 30 ml, w tym objętości rurki i zbiornika. Pobieranie próbek przeprowadzono ze zbiornika Komory odbiornika w odstępach czasu 0, 5, 10, 20, 30, i 40 min i zastąpiona równoważną objętością świeżego HBSS. Próbki analizowano za pomocą HPLC-UV pod kątem zawartości leku (Fejős i wsp., 2014). Dane znormalizowano na najwyższym przenikliwym stężeniu Sild obserwowanym dla czystego cytrynianu Sild. Testy przeprowadzono w trzech egzemplarzach, a wyniki podano jako wartość średnia ± odchylenie standardowe.
badanie farmakokinetyczne na Ochotniczych pacjentach z psychogennym zaburzeniem czynności nerek
badanie przeprowadzono w Zakładzie Andrologii i Medycyny Rozrodu (Szpital Uniwersytecki w Padwie, Włochy), W okresie od maja do września 2017 r., zgodnie z deklaracją Helsińską, za zgodą komitetu etyki Szpitala Uniwersyteckiego w Padwie (protokół nr 3982/AO/16 z kolejnymi zmianami). Aby uniknąć mylących wyników, włączono pacjentów z psychogennym ED, ponieważ mniejsze występowanie zaburzeń organicznych wiąże się z ED (Ludwig and Phillips, 2014).
wielkość próby obliczono w celu osiągnięcia wielkości efektu co najmniej 0,5 przy mocy statystycznej 0,8 i poziomie istotności 0,05 dla porównania trzech grup (patrz Kalkulator mocy – jednokierunkowa niezależna ANOVA).
dwudziestu pacjentów (średnia wieku 31, 4 ± 5, 7 lat) zostało włączonych kolejno do badania po wydaniu podpisanej świadomej zgody. Pacjenci uczestniczyli w ocenie ambulatoryjnej zgłaszając stałą niezdolność do uzyskania i utrzymania erekcji dla satysfakcjonującego stosunku płciowego w ciągu ostatnich 6 miesięcy lub dłużej. Następnie przeprowadzono ocenę kliniczną u wszystkich pacjentów w celu stwierdzenia braku chorób związanych z zaburzeniami erekcji, takich jak cukrzyca, nadciśnienie tętnicze, zaburzenia neurologiczne i stosowanie leków przeciwdepresyjnych. Diagnoza zaburzeń erekcji została potwierdzona przez wypełnienie indeksu < 26 podczas podawania kwestionariusza International Index of Erectile Function – 15 (IIEF-15) (Lotti i wsp., 2016) i utrzymanie nocnych spontanicznych erekcji, ocenianych przez nocne monitorowanie Tumescencji prącia i sztywności za pomocą systemu oceny sztywności RigiScan Plus (Dacomed, Stany Zjednoczone) przez dwie kolejne noce, jak wcześniej opisano (Munoz et al., 1993; Caretta et al., 2005). Kryteria wykluczenia obejmowały rozpoznanie nowotworów złośliwych, nieprawidłowe stężenia hormonów w osoczu (odpowiednio: hormon luteinizujący > 8 UI / l, całkowity testosteron <10, 4 nmol/l, tyreotropina >4, 5 mUI/l, prolaktyna >20 ng/ml) i zwiększenie grubości błony wewnętrznej w pniach nadaortalnych (> 0.9 mm) i (lub) tętnice jamiste (>0,3 mm), oceniane za pomocą Color Doppler-USG, jak opisano wcześniej (Caretta i wsp., 2005, 2009).
pacjenci zgodzili się na zastosowanie pojedynczej dawki, trójdrożnego, otwartego badania. Schemat dawkowania leku przedstawiono na rysunku 1. Dawka Sild została wybrana jako 50 mg, zgodnie z wcześniejszymi doniesieniami na temat leczenia psychogennego ED (Banner I Anderson, 2007). Pacjenci zostali poproszeni o nie przyjmowanie narkotyków lub alkoholu przez 1 tydzień przed i w trakcie badania. Ponadto, w ciągu dnia podawania leku, pacjenci zostali również poproszeni o śniadanie beztłuszczowe (bez mleka lub innego tłustego pokarmu) co najmniej 2 godziny przed badaniem. FCT, uważany za postać odniesienia, podawano klasycznie na os Przez połknięcie tabletki doustnej popijając szklanką wody. W przypadku ODT i ODF pacjentom poinstruowano, aby trzymali preparat pod językiem przez 15 minut bez zakładania wody, a następnie połykali. Próbki krwi żylnej pobrano w standardowych probówkach (Vacutainer, BD Biosciences, Mediolan, Włochy) W 0, 5, 10, 15, 30, 60, 90, 120, i 240 min po podaniu leku. Przeprowadzono kompensację poprzez ciągłą infuzję jałowego roztworu soli fizjologicznej. Po podaniu, testerzy byli trzymani aż do zakończenia pobierania próbek krwi. Dodatkowe pobranie krwi przeprowadzono w ciągu 24 godzin od podania leku w celu ustalenia całkowitego klirensu leku. Jako okresy wymywania, pomiędzy jedną dawką a kolejną dawką dozwolone było 7 dni. Po pobraniu krwi osocze natychmiast izolowano i przechowywano w temperaturze -80°C do czasu użycia.
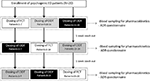
RYSUNEK 1. Schemat dawkowania i oceny w celu oceny parametrów farmakokinetycznych u 20 pacjentów z psychogennymi zaburzeniami erekcji (ED), podzielonych na trzy grupy (odpowiednio pacjenci 1-7; pacjenci 8-14; pacjenci 15-20). Każda grupa pacjentów alternatywnie otrzymywała tabletki powlekane os (FCT), tabletki do sporządzania zawiesiny doustnej podjęzykowej (ODT) lub tabletki do sporządzania zawiesiny doustnej podjęzykowej (ODF) z co najmniej tygodniowym wypłukiwaniem z każdej dawki. Wszystkie preparaty zawierały 50 mg syldenafilu (Sild).
podczas pobytu pacjentów poproszono również o rejestrowanie działań niepożądanych leku (ADR) w specjalnie opracowanej formie, dostosowanej do formularza zgłaszania ADR agencji Italiana del Farmaco (AIFA1). Przetłumaczona wersja kwestionariusza jest dostępna jako materiał uzupełniający (patrz uzupełniający Arkusz danych S1). Pacjenci zostali poproszeni o określenie rodzaju działania niepożądanego/s, ogólnej intensywności (w subiektywnej skali oceny od 1, Bardzo słaba, do 5, bardzo intensywna), czasu wystąpienia i ogólnego czasu trwania.
oznaczanie ilościowe syldenafilu w surowicy ludzkiej
w celu określenia ilościowego stężenia Sild w surowicy dodano 400 µl próbki surowicy z 500 µl metanolu uzupełnionego wewnętrznym wzorcem (IS) benzanilidu (5 µg/ml). Następnie do mieszaniny dodano 5 ml octanu etylu, próbki wirowano w celu przeprowadzenia ekstrakcji ciecz-ciecz, obie fazy oddzielono przez odwirowanie. Część organiczną odparowano następnie w próżniowej wirówce w temperaturze 40°C. Otrzymaną pozostałość ponownie rozpuszczono 200 µl metanolu i ostatecznie wykorzystano do wysoko wydajnej chromatografii cieczowej-tandemowej spektrometrii masowej (HPLC-MS/MS).
wysokosprawna chromatografia cieczowa-analiza MS/MS wykorzystała system Agilent-Varian 1260 i detektor potrójny-poczwórny Agilent-Varian 320 ms.separację chromatograficzną przeprowadzono na kolumnie Phenomenex C-18 Evo 3 × 100 i fazie ruchomej złożonej z acetonitrylu z 0,1% kwasem mrówkowym w wodzie z gradientem opisanym na rysunku uzupełniającym S2A. Dodatni tryb wykrywania został zastosowany dla przejścia 198 > 105 Da IS, uzyskanego przy napięciu kapilarnym 40 V i energii zderzenia 16 V, podczas gdy 475 > 100 Da dla Sild o napięciu kapilarnym 40 V i energii zderzenia 22,5 V, odpowiednio. Reprezentatywne chromatogramy IS I Sild w rzeczywistych próbkach przedstawiono na rysunku uzupełniającym S2B.
Analiza statystyczna
parametry farmakokinetyczne (PK), takie jak maksymalne stężenie w surowicy (Cmax), czas do maksymalnego stężenia w surowicy (tmax) i pole pod krzywą (AUC) w różnych punktach czasowych, obliczono za pomocą specyficznych procedur aplikacji za pomocą oprogramowania GraphPad (La Jolla, CA, Stany Zjednoczone). Analiza statystyczna danych została przeprowadzona za pomocą SPSS 21.0 Dla Windows (SPSS, Chicago, IL, Stany Zjednoczone). Test Kołmogorowa-Smirnowa został użyty do sprawdzenia normalności dystrybucji. Zmienne Nie pokazujące rozkładu normalnego zostały przekształcone w log. Porównano wyjściową charakterystykę pacjentów, PKs i dane z eksperymentów in vitro z niesparowanymi testami T ucznia z korekcją Bonferroni-Holma dla wielokrotnych porównań. Powtarzane pomiary ANOVA przeprowadzono w celu zbadania różnic w uwalnianiu leku i stężeniu Sild w surowicy. Test Levene ’ a wykorzystano do badania jednorodności wariancji między grupami. Jeśli naruszono jednorodność założenia wariancji, przeprowadzono test Welcha i zgłoszono odpowiednią wartość P. Proporcję ADR porównano z dokładnym testem χ2. Wartości P < 0.05 uznano za istotne statystycznie.
wyniki
Analiza in Vitro uwalniania/przenikania syldenafilu z różnych preparatów leku
dynamika uwalniania i przenikania Sildu z trzech preparatów leku była wcześniej badana in vitro (ryc. 2). Czas zakończenia dezagregacji dla FCT, ODT i ODF oceniono za pomocą standardowego testu opisanego w Farmakopei Europejskiej (2016; Fig. ODF wykazywał najwyższy czas do dezagregacji w porównaniu do FCT i ODT (odpowiednio, P = 0,017 i P = 0,008).
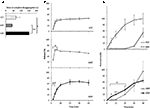
RYSUNEK 2. Ocena in vitro właściwości biotechnologicznych FCTs, ODT, andODFs zawierających 50 mg Sildu. Wyniki są reprezentatywne dla trzech niezależnych eksperymentów i zgłaszane jako średnie wartości ± odchylenie standardowe. A) wyniki testu dezagregacji, podając czas (w sekundach) całkowitego dezagregacji preparatu. Znaczenie: ∗p < 0,05 i ∗ ∗ p < 0,01 pomiędzy wskazanymi preparatami. B) wyniki testu rozpuszczania, podając ilość Sildu uwalnianego przez każdy preparat jako procent dawki leku. Znaczenie: aP < 0,01 vs. FCT; bP < 0,001 vs. ODT. C) wyniki testu przenikania (szczegółowe w sekcji „Materiały i metody”) przedstawiające ilość Sildu przenikniętego przez membranę octanu celulozy, jako procent najwyższej wartości osiągniętej przez 50 mg czystego proszku Sildu (linia nieciągła w górnym panelu). Znaczenie: ∗P < 0,05 vs. ODT; ∗ ∗ P < 0,01 vs.ODT; ap < 0,01 vs. FCT.
w celu oceny wpływu tych dowodów na uwalnianie leku z preparatu wykonano standardowy test rozpuszczania (Farmakopea Europejska, 2016; Fig.2b). W porównaniu z referencyjną formułą FCT, ODT wykazywał szybsze uwalnianie leku, którego maksymalny zasięg został osiągnięty nawet po zaledwie 2 minutach od początku testu (P = 0,006 vs.FCT). Z drugiej strony, odsetek leku uwalnianego z ODF w ciągu pierwszych 4 minut testu był niższy w porównaniu zarówno do FCT, jak i ODT (odpowiednio P = 0,004 i p < 0,001). W szczególności ODF wykazał bardziej progresywne uwalnianie leku w porównaniu z FCT, osiągając maksymalny stopień po 20 minutach od początku testu.
na tej podstawie oceniono przenikanie przez błonę śluzową Sild z każdego preparatu za pomocą specjalnie opracowanego urządzenia (Fig.2C). Dla celów referencyjnych, czysty cytrynian Sildu, użyty w masie odpowiadającej 50 mg Sildu, oceniono pod kątem przenikania przez błonę śluzową i wykazano swobodną i szybką dyfuzję między dwiema komorami. Prawie przeciwny profil zaobserwowano dla FCT, wykazując znikome przenikanie do 30 minut od początku testu. Profile przenikania ODT i ODF wykazały zachowanie pośrednie w porównaniu do dwóch poprzednich warunków. W ciągu pierwszych 20 minut testu ODF wykazywał znamiennie większy stopień przenikania w porównaniu do ODT (odpowiednio P = 0,033 po 5 minutach, P = 0,003 po 10 minutach I P = 0,041 po 20 minutach). W odróżnieniu od FCT i ODT, które zostały całkowicie zdezagregowane w komorze dawcy, pozostałość miękkiej galaretowatej masy ODF utrzymywała się na membranie octanu celulozy nawet pod koniec badania (rysunek uzupełniający S2C).
różnica farmakokinetyki syldenafilu
dwudziestu mężczyzn dotkniętych psychogennym DE zaakceptowało alternatywnie FCT, ODT lub ODF, oddzielone tygodniem wypłukania. Jak opisano szczegółowo w sekcji „Materiały i metody”, FCT został klasycznie połknięty, aby umożliwić Klasyczne podawanie per os, podczas gdy ODT i ODF były utrzymywane pod językiem przez 15 minut, aby promować drogę podjęzykową. Charakterystykę kliniczną pacjentów przedstawiono w tabeli 1. Stężenie Sild w surowicy odpowiadające trzem Warunkom dawkowania przedstawiono na fig. 3. Znaczna zmienność cechowała profil surowicy leków trzech preparatów. W porównaniu z FCT, ODT wykazywał wyraźne wczesne zwiększenie stężenia Sild w surowicy; tendencja ta nie była jednak statystycznie istotna. Z drugiej strony, zaobserwowano szybszy rozkład poziomów Sild po 120 i 240 minutach od podania preparatu ODT (odpowiednio P = 0,044 i P = 0,024 w porównaniu do FCT).
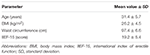
TABELA 1. Charakterystyka kliniczna uczestników badania (N = 20).
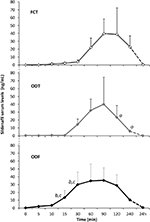
RYSUNEK 3. Ocena in vivo stężenia Sild w surowicy u 20 pacjentów dotkniętych zaburzeniami psychogennymi, otrzymujących alternatywnie FCT na os, podjęzykową ODT lub podjęzykową ODF, jak opisano w punkcie ” materiały i metody.”Dane są podawane jako wartości średnie ± znaczenie odchylenia standardowego: aP < 0,05 vs. FCT; bP < 0,01 vs. FCT; cP < 0,05 vs.ODT.
profil surowicy leku w postaci ODF wykazywał szybszy wzrost stężenia Sild w porównaniu do FCT (P = 0,001 i P = 0,003) i ODT (P = 0,048 i P = 0,041), odpowiednio, po 15 i 30 minutach od podania. Zgodnie z powolnym czasem dezagregacji in vitro (Fig. 2b), średnia krzywa stężenia w czasie ODF in vivo była gładsza niż krzywa FCT i ODT (Fig.3).
parametry farmakokinetyczne tych trzech preparatów, uzyskane z analizy stężenia Sild w surowicy, podsumowano w tabeli 2. Pomimo braku istotnej różnicy pomiędzy trzema postaciami pod względem Cmax, Tmax i AUC0-240 min, ODF wykazał najniższą wartość Cmax (38, 2 ± 23, 7 ng/ml) i najkrótszy Tmax (70, 0 ± 24, 5 min). W szczególności ODF wykazywał znacznie wyższą wartość AUC0-60 min w porównaniu zarówno do FCT, jak i ODT (odpowiednio, P = 0,005 i P = 0.043), co powodowało zwiększenie względnej biodostępności Sild w ciągu pierwszej godziny od podania ODF drogą podjęzykową.

TABELA 2. Parametry farmakokinetyczne postaci syldenafilu.
działania niepożądane leku
w tabeli 3 podsumowano wyniki uzyskane na podstawie samodzielnie podawanego kwestionariusza dotyczącego rodzaju i cech działań niepożądanych występujących u uczestników badania. Wśród znanych ADR zgłoszonych dla Sild (Taylor et al., 2009), najczęściej notowane były bóle głowy, uderzenia gorąca i przekrwienie błony śluzowej nosa. Po podaniu FCT jeden pacjent zgłaszał mały ból mięśni (Stopień 1 w subiektywnej skali oceny). Żaden z pacjentów nie zgłaszał zaburzeń widzenia, tachykardii, osłabienia lub zaburzeń słuchu.

TABELA 3. Działania niepożądane leku odnotowane przez uczestników badania (N = 20).
w porównaniu z FCT jako postacią referencyjną, ODT wykazywała niezmienną częstość występowania ADR. Jednak indywidualne postrzeganie intensywności uderzeń gorąca z zaczerwienieniem było znacznie mniejsze (P = 0,031). Z drugiej strony, ODF wykazało zmniejszoną częstość występowania bólu głowy w porównaniu z FCT (P = 0,043). Ponadto czas trwania i intensywność uderzeń gorąca z zaczerwienieniem i przekrwienie błony śluzowej nosa były odczuwane na niższych poziomach w porównaniu z FCT (odpowiednio, P = 0, 011 i P = 0, 015) i ODT (odpowiednio, P = 0, 026 i P = 0, 037).
dyskusja
w tym badaniu przedstawiamy dowody na to, że podjęzykowa DROGA PODANIA Sild wiąże się ze zwiększoną wczesną biodostępnością leku i poprawionym profilem tolerancji. Dowody te są poparte zarówno badaniami in vitro, pokazującymi, że preparat Sild jest wykazywany przez dłuższy czas do dezagregacji, ale znacznie sprzyja wchłanianiu przez błony śluzowe, jak i dowodami in vivo.
inhibitory fosfodiesterazy są pierwszą opcją terapeutyczną w leczeniu zaburzeń erekcji; jednak działania niepożądane obserwowane przez pacjentów są uznawane za najczęstszą przyczynę przerwania leczenia (Corona i wsp ., 2016). Modyfikacja farmakokinetyki poprzez projektowanie nowego preparatu leku może stanowić atrakcyjną strategię poprawy profilu bezpieczeństwa / skuteczności samego leku (Mehrotra et al., 2007). W związku z tym wygaśnięcie patentu na cytrynian Sild w 2013 r.w kilku krajach europejskich pozwoliło na wydanie szeregu nowych preparatów Sild. Należy zauważyć, że większość preparatów Sild dostępnych obecnie na rynku jest faktycznie zatwierdzona jako biorównoważne formy oryginalnego FCT (Leoni et al., 2013). Co ciekawe, opracowano preparaty rozpadające się doustnie, charakteryzujące się szybką dezagregacją w jamie ustnej pacjenta bez konieczności połykania z wodą(Goel et al., 2008). Te nowe preparaty znajdują lepszą zgodność w tych populacjach pacjentów z trudnościami w połykaniu konwencjonalnych stałych dawek, takich jak dzieci, pacjenci geriatryczni i pacjenci dysfagiczni. Ponadto, zapewniając wyższą dostępność leku doustnego, preparaty rozpadające się po podaniu doustnym mogą reprezentować cenione systemy sprzyjające wchłanianiu przez błony śluzowe, a w szczególności pod-językowemu (Kathpalia and Gupte, 2013). W szczególności we Włoszech oficjalnie w aptece dostępne są dwie preparaty rozpadające się doustnie Sild: ODTs i ODFs.
w tym badaniu zmierzaliśmy do oceny możliwych zmian farmakokinetycznych i odpowiedniego schematu ADR, wynikających z sprzyjania wchłanianiu przez błonę śluzową Sild poprzez pod-językowe podawanie dwóch dostępnych doustnych preparatów leku. Wyniki porównano z oryginalną formułą Sild, a mianowicie FCTs. Co ciekawe, znaleźliśmy ścisłą korelację, zarówno in vitro, jak i in vitro, między właściwościami biotechnologicznymi a PKs różnych preparatów. W szczególności, pomimo równej dawki leku (50 mg) i nieznacznie zmniejszonej szybkości uwalniania leku w teście rozpuszczania, ODF charakteryzował się z jednej strony większym czasem dezagregacji i wyższym wskaźnikiem przenikania w modelu trans-śluzówkowym, a z drugiej strony zwiększoną biodostępnością leku w ciągu pierwszej godziny od podania. Możemy wtedy postawić hipotezę, że sub-lingual wchłanianie Sild jest preferowane przez długotrwały kontakt lek-błona śluzowa. Rzeczywiście, zjawisko to jest ogólnie realizowane w przypadku doustnych leków przez błony śluzowe, w których zaleca się stosowanie polimerów mukoadhezyjnych w celu zapewnienia dłuższego okresu kontaktu preparatu z błoną śluzową jamy ustnej (Lam et al., 2014), w szczególności z tych leków, takich jak Sild, dotkniętych niską rozpuszczalnością w wodzie (Zayed et al., 2012; Sun et al., 2014). Te wstępne wyniki sugerują również możliwą poprawę skuteczności klinicznej dla tej klasy leków w porównaniu z oryginalnymi preparatami. Konieczne są dalsze badania w celu wyjaśnienia tych aspektów.
najbardziej uderzającym dowodem niniejszego badania jest znaczące zmniejszenie działań niepożądanych związanych z podawaniem pod-językowego ODF w porównaniu z ODT i FCT podawanymi w tej samej dawce, co z kolei może prowadzić do zwiększenia zgodności pacjentów. Dowody te można interpretować w świetle zasady, że częstość występowania efektu ubocznego leku wzrasta poprzez zwiększenie stężenia w surowicy i czasu ekspozycji na sam lek(Gupta et al., 2005; Taylor et al., 2009). Pomimo niezmiennej globalnej biodostępności w porównaniu z innymi analizowanymi preparatami, pod-językowe podawanie ODF wykazało niższą wartość Cmax i krótszy tmax, co skutkowało znacznie wyższym odsetkiem bio-dostępności Sild w ciągu pierwszej godziny od podania. Tak więc, możemy spekulować, że pod-językowe podawanie ODF łączy skuteczną absorpcję leku z osiągnięciem średniego niższego stężenia Sild w surowicy i w konsekwencji mniejsze ryzyko działań niepożądanych. Jednak uznajemy niską wielkość próby jako główną wadą badania. Aby potwierdzić ten problem, konieczne jest dalsze badanie na większych kohortach i przy różnych dawkach.
podsumowując, w tym badaniu informujemy, że podjęzykowe podawanie Sild ODF poprawia profil tolerancji leku poprzez prawdopodobny udział zmodyfikowanej farmakokinetyki w porównaniu z generatorem FCTs. Chociaż ODF nie został pierwotnie pomyślany w tym celu, stanowi to atrakcyjną strategię poprawy zgodności pacjenta z terapią. Opracowujemy dalsze badania porównawcze w celu oceny skuteczności klinicznej u psychogennych i organicznych pacjentów z zaburzeniami erekcji.
wkład autora
LDT i CF koordynowały badania i opracowały rękopis. MDRP oceniło i włączyło pacjentów do badania. EF przeprowadzono analizę in vitro. SDA przeprowadziło analizę surowicy. RP przeprowadził porównanie farmakokinetyki. RP, NR I AG krytycznie zrewidowane i sfinalizowane rękopis.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
dziękujemy Dr Alberto Barosso, Dr Giuseppe Maggioni i dr Dimitri Portale za doradztwo dla pacjentów, dr Flavia Rosano i dr Alice Passadore za Zarządzanie pacjentami oraz wszystkim pracownikom jednostki Andrologii i Medycyny Reprodukcyjnej.
materiał uzupełniający
materiał uzupełniający do tego artykułu można znaleźć w Internecie pod adresem: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
rysunek S1 / reprezentatywne obrazy testera rozpadu tabletki (a) i urządzenia do rozpuszczania (B) stosowane odpowiednio do testu dezagregacji i testu rozpuszczania.
rysunek S2 / (A) szczegóły dotyczące gradientu fazy ruchomej stosowanego do wysokosprawnej chromatografii cieczowej-tandemowej spektrometrii masowej (HPLC-MS/MS) analizy stężenia syldenafilu w surowicy (Sild). Przedstawiono reprezentatywne chromatogramy i widma masowe obu Sild w wewnętrznym wzorcu benzanilidu w próbkach rzeczywistych (B). C) reprezentatywny obraz resztkowego filmu Oro-dyspergowalnego (podkreślony linią nieciągłą), utrzymujący się po badaniu przenikania w urządzeniu używanym do oceny in vitro absorpcji przez błonę z octanu celulozy.
Karta charakterystyki S1 / kwestionariusz działań niepożądanych leku.
Przypisy
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L., and Anderson, R. U. (2007). Zintegrowana terapia seksualna syldenafilu i kognitywno-behawioralna w psychogennych zaburzeniach erekcji: badanie pilotażowe. J. Sex. Med. 4, 1117–1125. doi: 10.1111 / j.1743-6109.2007.00535.x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Bischoff, E. (2004). Działanie, selektywność i konsekwencje braku selektywności hamowania PDE. Int. J. Impot. Res.Suppl. 1, S11-S14. doi: 10.1038 / sj.ijir.3901208
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Boolell, M., Allen,M. J., Ballard, S. A., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Syldenafil: aktywny doustnie inhibitor fosfodiesterazy typu 5 specyficzny dla GMP do leczenia zaburzeń erekcji prącia. Int. J. Impot. Rez. 8, 47-52
PubMed Abstrakt / Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). Wznowienie spontanicznych erekcji u wybranych pacjentów dotkniętych zaburzeniami erekcji i różnymi stopniami zmiany ściany szyjnej: rola tadalafilu. Eur. Urol. 48, 326–331. doi: 10.1016 / j.eururo.2005.01.013
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A., and Foresta, C. (2009). Grubość tętnicy jamistej intima-media: nowy parametr w diagnostyce naczyniowych zaburzeń erekcji. J. Sex. Med. 6, 1117–1126. doi: 10.1111 / j. 1743-6109. 2008. 01112.x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J., and Forjaz, V. (2012). Rezygnacja z leczenia zaburzeń erekcji za pomocą PDE5: badanie predyktorów i analiza jakościowa przyczyn przerwania leczenia. J. Sex. Med. 9, 2361–2369. doi: 10.1111 / j.1743-6109.2012.02787.x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Center for Drug Evaluation and Research (2003). Nda 021400 Levitra (chlorowodorek wardenafilu) tabletki: Przegląd Farmakologii Klinicznej / Biofarmaceutyki. Rockville, Md: Department of Health and Human Services. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Pierwsza generacja inhibitorów fosfodiesterazy typu 5: kompleksowy przegląd i metaanaliza. Andrology 4, 1002-1009. doi: 10.1111 / andr.12255
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Delvadia, P. R., Barr, W. H., and Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). European Directorate for the Quality of Medicines & HealthCare (EDQM), 9th Edn. Strasburg: Rada Europy.
Google Scholar
Fejős, I., Neumajer, G., Béni, S., and Jankovics, P. (2014). Analiza jakościowa i ilościowa inhibitorów PDE-5 w podrabianych lekach i suplementach diety metodą HPLC-UV z zastosowaniem syldenafilu jako jedynego odniesienia. J. Pharm. Biomed. Anal. 98, 327–333. doi: 10.1016 / j.jpba.2014.06.010
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Goel, H., Rai, P., Rana, V., and Tiwary, A. K. (2008). Systemy dezintegracji doustnej: innowacje w formulacji i technologii. Ostatni Pat. Lek Deliv. Formul. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Pełny tekst / Google Scholar
Gupta, M., Kovar, A., and Meibohm, B. (2005). Farmakokinetyka kliniczna inhibitorów fosfodiesterazy-5 w zaburzeniach erekcji. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Hatzimoratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Europejskie Stowarzyszenie Urologii. Wytyczne dotyczące zaburzeń seksualnych u mężczyzn: zaburzenia erekcji i przedwczesny wytrysk. Eur. Urol. 57, 804–814. doi: 10.1016 / j.eururo.2010.02.020
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
(2015). Farmakoterapeutyczne leczenie zaburzeń erekcji. Clin. Pharmacol. Ther. 98, 602–610. doi: 10.1002 / cpt.261
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
Heinig R., Weimann B., Dietrich, H., and Böttcher, M. F. (2011). Farmakokinetyka wardenafilu w postaci tabletek ulegających rozpadowi w jamie ustnej: wyniki trzech badań klinicznych. Clin. Drug Investig. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed Abstract / CrossRef Pełny tekst / Google Scholar
Kathpalia, H., and Gupte, A. (2013). Wprowadzenie do systemów szybkiego rozpuszczania doustnych cienkowarstwowych leków: przegląd. Curr. Lek Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Lam, J. K., Xu, Y., Worsley, A., and Wong ,I. C. (2014). Doustne podawanie leku przez śluzówkę do stosowania u dzieci. ADV.Lek Deliv. Rev. 73, 50-62. doi: 10.1016 / j.addr.2013.08.011
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B., and Rodrigues, B. (2013). Syldenafil: dwie dekady korzyści lub ryzyka? Starzejący Się Mężczyzna 16, 85-91. 10.3109/13685538.2013801952
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). Zaburzenia jakości nasienia związane są z zaburzeniami czynności seksualnych w zależności od ich ciężkości. Hum. Reprod. 31, 2668–2680. doi: 10.1093/humrep / dew246
PubMed Abstract / CrossRef Full Text / Google Scholar
PubMed Streszczenie / CrossRef Pełny Tekst / Google Scholar
Lugnier, C. (2006). Nadrodzina cyklicznej fosfodiesterazy nukleotydowej (PDE): nowy cel rozwoju specyficznych środków terapeutycznych. Pharmacol. Ther. 109, 366–398. doi: 10.1016 / j.pharmthera.2005.07.003
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Mehrotra, N., Gupta, M., Kovar, A., and Meibohm, B. (2007). Rola farmakokinetyki i farmakodynamiki w terapii inhibitorem fosfodiesterazy-5. Int. J. Impot. Res. 19, 253-264. doi: 10.1038 / sj.ijir.3901522
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Munoz, M., Bancroft, J., and Marshall, I. (1993). Wydajność Rigiscan w pomiarze tumescencji i sztywności prącia. Int. J. Impot. Res. 5, 69-76.
Google Scholar
Porst, H., Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S., et al. (2013). Komitet Normalizacyjny ISSM dla Medycyny Seksualnej. SOP konserwatywne (medyczne i mechaniczne) leczenie zaburzeń erekcji. J. Sex. Med. 10, 130–171. doi: 10.1111 / jsm.12023
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Zwiększona absorpcja doustna i działanie terapeutyczne acetylpueraryny na bazie Nanoemulsji bursztynianu D-α-tokoferolu polietylenowego glikolu 1000. Int. J. Nanomedicine 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
(2009) Różnice w czasie trwania działań niepożądanych i związanych z tym poziomach niepokoju pomiędzy inhibitorami fosfodiesterazy typu 5. BJU Int. 103, 1392–1395. doi: 10.1111 / j. 1464-410X. 2008. 08328.x
PubMed Streszczenie / CrossRef Pełny tekst / Google Scholar
Zayed, R., Kamel, A. O., Shukr, M., and El-Shamy, A. H. (2012). Badanie porównawcze in vitro i In vivo bezpośrednio skompresowanych dyspersji stałych i liofilizowanych tabletek podjęzykowych cytrynianu sildenafilu do leczenia tętniczego nadciśnienia płucnego. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar