dodanie ugrupowania węglowodanowego do cząsteczki białka jest określane jako glikozylacja białka. Jest to częsta modyfikacja posttranslacyjna dla cząsteczek białka biorących udział w tworzeniu błony komórkowej. Podczas tego procesu łączenie jednostek monosacharydowych z łańcuchami aminokwasowymi tworzy etap dla serii reakcji enzymatycznych, które prowadzą do tworzenia glikoprotein (n i oligosacharydów połączonych z białkiem). We wszystkich 16 znanych enzymach ma pośredniczyć w tej reakcji. Typowa glikoproteina ma co najmniej 41 wiązań, które obejmują 8 aminokwasów i 13 różnych jednostek monosacharydowych i obejmuje wiązania glikofosfatydyloinozytolu (GPI) i fosfoglikozylu. Glikozylacja białek pomaga w prawidłowym fałdowaniu białek, stabilności i adhezji komórek do komórek, powszechnie potrzebnej komórkom układu odpornościowego. Głównymi miejscami glikozylacji białek w organizmie są ER, ciało Golgiego, jądro i płyn komórkowy.
glikozylację białek można podzielić na dwa główne typy:
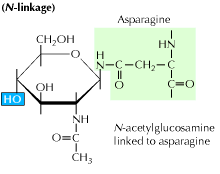 a) n-związana glikozylacja: rozpoczyna się od dodania prekursora 14-cukru do aminokwasu asparaginy. Zawiera glukozę, mannozę i cząsteczki N-acetyloglukozaminy. Podmiot ten jest następnie przenoszony do ER lumen. Enzym transferazy oligosacharylowej przyłącza łańcuch oligosacharydowy do asparaginy, która występuje w sekwencji tripeptydowej, Asn-X-Ser lub Asn-X-Thr. X może być dowolnym aminokwasem innym niż prolina. Sekwencja białka przyłączonego do oligosacharydu jest teraz prawidłowo składana i przenoszona do ciała Golgiego, gdzie usuwa się pozostałość mannozy.
a) n-związana glikozylacja: rozpoczyna się od dodania prekursora 14-cukru do aminokwasu asparaginy. Zawiera glukozę, mannozę i cząsteczki N-acetyloglukozaminy. Podmiot ten jest następnie przenoszony do ER lumen. Enzym transferazy oligosacharylowej przyłącza łańcuch oligosacharydowy do asparaginy, która występuje w sekwencji tripeptydowej, Asn-X-Ser lub Asn-X-Thr. X może być dowolnym aminokwasem innym niż prolina. Sekwencja białka przyłączonego do oligosacharydu jest teraz prawidłowo składana i przenoszona do ciała Golgiego, gdzie usuwa się pozostałość mannozy.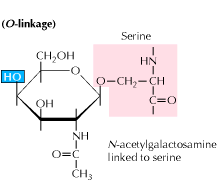
B) glikozylacja związana z o: Glikozylacja rozpoczyna się od enzymatycznego dodania N-acetylo-galaktozaminy, a następnie innych węglowodanów do reszt seryny lub treoniny. Badania ujawniają, że glikozylacja związana z O występuje na późniejszym etapie przetwarzania białek.