adhezja komórkowa
adhezja komórkowa to proces, w którym komórki wchodzą w interakcje z określonymi cząsteczkami na powierzchni komórki i przyłączają się do sąsiednich komórek. Proces ten może zachodzić poprzez bezpośrednie lub pośrednie interakcje między powierzchniami komórek, gdzie komórki przyłączają się do otaczającej macierzy zewnątrzkomórkowej, która zawiera cząsteczki uwalniane przez komórki do przestrzeni między komórkami. Adhezja komórkowa występuje, gdy cząsteczka adhezji komórkowej (CAM) wchodzi w interakcję z białkiem przezbłonowym znajdującym się na powierzchni komórki. Adhezja komórek łączy komórki na różne sposoby i może uczestniczyć w transdukcji sygnału, aby umożliwić komórkom wykrywanie i reagowanie na zmiany w otaczającym środowisku. Inne procesy komórkowe regulowane przez adhezję komórek obejmują migrację komórek i rozwój tkanek w organizmach wielokomórkowych. Zmiany w adhezji komórek mogą zakłócać ważne procesy komórkowe i prowadzić do różnych chorób, w tym raka i zapalenia stawów. Adhezja komórek jest również niezbędna w przypadku chorób wywoływanych przez organizmy zakaźne, takie jak bakterie lub wirusy.
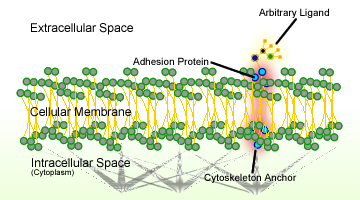 Rysunek 1. Schemat adhezji komórek
Rysunek 1. Schemat adhezji komórek
klasyfikacje
krzywki są podzielone na cztery główne rodziny: integryny, nadrodzinę immunoglobulin (Ig), cadherin i selektyny. Każda z tych cząsteczek adhezyjnych ma inną funkcję i rozpoznaje inny ligand. Cadheriny i immunoglobuliny są krzywkami homotypowymi, ponieważ wiążą się bezpośrednio z tym samym typem krzywki w innej komórce, podczas gdy integryny i selektyny są krzywkami heterologicznymi, które wiążą się z różnymi typami krzywek. Wady adhezji komórek są często przypisywane wadom ekspresji krzywek. W organizmach wielokomórkowych wiązanie między kamykami powoduje, że komórki przylegają do siebie i tworzą strukturę zwaną połączeniem komórkowym.
zgodnie z ich funkcjami połączenia komórkowe można sklasyfikować jako:
połączenia Zakotwiczające (przylegające połączenia, desmosomy i hemidesmosomy), które utrzymują komórki wzdłuż i wzmacniają kontakt między komórkami.
zatkanie połączeń (szczelnych połączeń), które uszczelniają szczeliny między komórkami poprzez kontakt komórka–komórka, tworząc wodoodporną barierę dla dyfuzji.
połączenia kanałowe (połączenia szczelinowe), które łączą protoplazmę sąsiednich komórek, umożliwiając transport cząsteczek między komórkami.
łączniki sygnałowe, które mogą być synapsami w systemie.
alternatywnie, połączenia komórkowe można podzielić na 2 główne odmiany zgodnie z tym, co oddziałuje z komórką: połączenia komórka–komórka, w głównym pośredniku przez cadheriny, i połączenia komórka–matryca, w głównym pośredniku przez integryny.
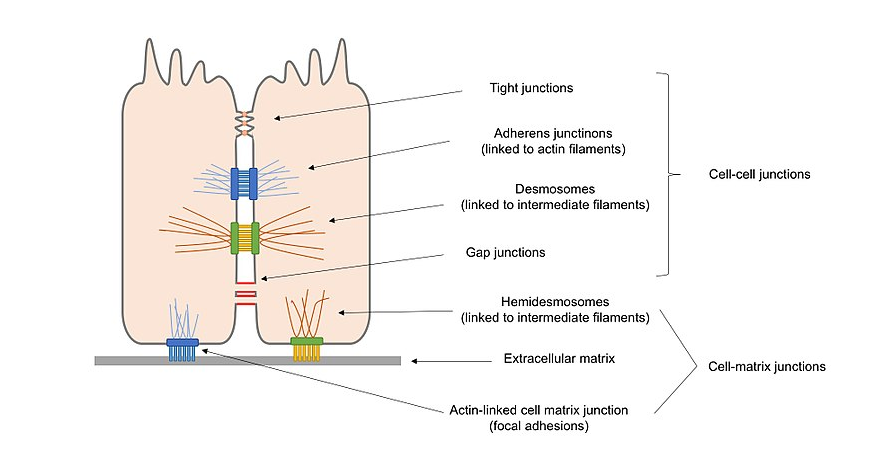 Rysunek 2. Schemat ogólny różnych typów połączeń komórkowych obecnych w komórkach nabłonkowych, w tym połączeń komórka–komórka i połączeń komórka–matryca.
Rysunek 2. Schemat ogólny różnych typów połączeń komórkowych obecnych w komórkach nabłonkowych, w tym połączeń komórka–komórka i połączeń komórka–matryca.
charakterystyka strukturalna białek adhezyjnych komórek
białka adhezyjne komórek są zwykle glikoproteinami, które pośredniczą w rozpoznawaniu komórek i macierzy zewnątrzkomórkowej na powierzchni zewnątrzkomórkowej. Większość cząsteczek adhezyjnych komórek ma podobne konformacje w swoich domenach adhezyjnych. Na przykład: domeny adhezyjne kadheryny, immunoglobuliny podobne, fibronektyny typu III i EGF są głównie strukturami β-arkuszowymi. Częstym motywem związanym z adhezją komórek jest grecka struktura beczki kluczowej zawierająca jedną lub dwie anty-równoległe β.
domeny podobne do Ig są główną klasą greckich domen z kluczowymi beczkami. Mają sekwencję podobieństwa do zmiennej lub stałej domeny przeciwciał zawierających od siedmiu do dziewięciu anty-równoległych nici β. Anty-równoległe arkusze P tworzą 3-D β-beczkę. Domeny podobne do Ig są stabilizowane przez hydrofobowe wiązania rdzeniowe i dwusiarczkowe. Są one podzielone na dwa główne zestawy: domeny Ig C-like i Ig V-like.
funkcjonalnie związane cechy strukturalne białek adhezyjnych komórek
białka adhezyjne komórek mają różnorodność funkcjonalną. Interakcje cząsteczek adhezyjnych komórek mogą być homofilne lub heterofilne interakcje białko-białko lub interakcje białko-węglowodan. Zmiany strukturalne cząsteczek adhezji komórkowej są często związane z ich właściwościami funkcjonalnymi.
Homofilne Interakcje Białko-Białko.
na przykład, cadheriny są przezbłonowymi zależnymi od Ca2+homofilnymi cząsteczkami adhezji. Cadheriny są odpowiedzialne za utrzymanie połączeń między podobnymi komórkami w tkankach. Adhezja komórka-komórka jest pośredniczona przez N-końcową domenę cadheryn. Zawiera pięć podobnych domen pozakomórkowych EC1 do EC5. Badania krystalograficzne rentgenowskie nad N-kadheryną wykazały, że domena EC1 tworzy dimer, w którym monomery są zorientowane równolegle z powierzchnią wiążącą klej skierowaną na zewnątrz od błony plazmatycznej. Jednostki monomerów domen EC1 oddziałują ze sobą w sposób antyrównoległy, wykorzystując ich przylegające powierzchnie wiążące i tworząc strukturę β-beczkową. Przypuszczalny interfejs interakcji sugerowano mieć zarówno hydrofobowy i polar / charged charakter, który naśladuje interfejs interakcji domen immunoglobulin ze sobą w nadrodzinie Ig.
Heterofilne Interakcje Białko-Białko.
na przykład Wiązanie integryn z różnymi receptorami powierzchniowymi komórek i ligandami macierzy pozakomórkowej jest główną klasą heterofilnych interakcji białko-białko w systemach adhezji komórkowej. Po związaniu z rozpuszczalnym fibrynogenem integryna aIIbß3 jest przekształcana w stan wiązania o wysokim powinowactwie. Zmiany konformacyjne integryny wywołane wiązaniem ligandu w tym przypadku mają kluczowe znaczenie dla jej aktywności adhezyjnej. Wiązanie receptora komórek T może również modulować powinowactwo integryny, antygenu – 1 związanego z funkcją leukocytów (LFA-1), do jego receptorów, takich jak ICAM-l lub ICAM-2 (cząsteczka adhezji międzykomórkowej). Wiązanie ICAM-l może dodatkowo indukować zmiany konformacyjne LFA-1. Miejsce wiązania kleju białka znajduje się w C-terminalu LFA-l na podstawie badań krystalograficznych rentgenowskich.Tripeptyd, kwas arginina-glicyna-asparaginowy (RGD), jest wspólnym motywem wiążącym ligand integryny. Na przykład moduł ligandu wiążącego integrynę typu III fibronektyny ma grecką strukturę beczki kluczowej, której motyw RGD, znajdujący się na wierzchołku pętli łączącej nici F I G β, pośredniczy w adhezji. Prostowanie pętli RGD w bardziej liniową, fluktuacyjną konformację przez rozłożenie zmniejsza dostępność pętli do powierzchniowo związanych integryn, a zatem zmniejsza powinowactwo i selektywność wiązania.
Interakcje Białko-Węglowodany.
selektyny są ważne w interakcji limfocytów i neutrofili z śródbłonkiem naczyń. Selektyny są cząsteczkami adhezyjnymi, które wiążą się z węglowodanami. Nie ma jeszcze żadnych bezpośrednich danych strukturalnych dotyczących wiązania selektyn z węglowodanami. Selektyny wiążą węglowodany z niskim powinowactwem i mają bardzo szybkie włączanie i wyłączanie.