wprowadzenie
tkanki, komórki i mniejsze struktury wewnątrz komórek (organelli) są głównie wodą i dlatego są przezroczyste. Obrazowanie małych przezroczystych worków z wodą daje obrazy, które nie zawierają zbyt wielu informacji, a w mikroskopii ważne jest, aby uzyskać jakiś kontrast lub plamę, która nada obszary koloru próbki i sprawi, że będą one znacznie łatwiejsze do zobaczenia. A co, jeśli chcemy zobrazować tylko niektóre z mniejszych struktur wewnątrz komórki, jak jądro lub błona komórkowa? Kolorowanie całej komórki uniemożliwiłoby zlokalizowanie obszarów, które Cię interesują.
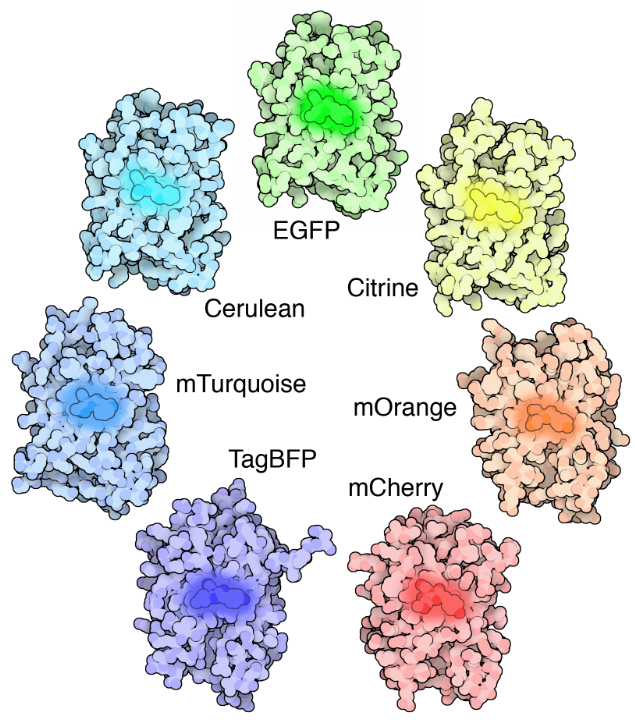
Fluorescencja rozwiązuje oba te problemy kontrastu i lokalizacji. Fluorescencja to miejsce, w którym obiekt emituje światło po wchłonięciu światła. Wiele różnych obiektów wykazuje fluorescencję, takich jak minerały (słowo fluorescencja pochodzi od mineralnego fluorytu), ryby głębinowe (najbardziej znana Meduza Aequorea victoria, z której odkryto zielone białko fluorescencyjne (GFP)), rośliny, chemikalia i wiele innych.
cząsteczki fluorescencyjne (znane jako fluorofory) są używane do znakowania próbek, a fluorofory są dostępne, które emitują światło w praktycznie dowolnym kolorze. W mikroskopie fluorescencyjnym próbka jest oznaczona fluoroforem, a następnie do oświetlenia próbki stosuje się jasne światło (światło wzbudzenia), które wydziela fluorescencję (światło emisyjne). W ten sposób próbki są silnie kontrastowane z czarnym tłem, ponieważ fluorofor emituje jasne światło. Poprzez lokalizację tych fluorophores do obszaru zainteresowania jasny obraz dowolnej części komórki mogą być brane, co fluorescencja mikroskopia potężnym narzędziem dla nauk przyrodniczych.
Brightfield vs Fluorescence Imaging
w mikroskopii brightfield próbka jest oświetlona przepuszczanym światłem białym. Tworzy to równomierne oświetlenie próbki pod mikroskopem, aby obserwować próbki o wysokim kontraście, zabarwieniu lub naturalnie pigmentowane. Jednak brightfield nie jest wystarczający do rozróżnienia między przezroczystymi / półprzezroczystymi, nieutwardzonymi komórkami lub strukturami komórkowymi do badania interesujących procesów.
mikroskopia Fluorescencyjna opiera się na użyciu fluoroforów, cząsteczek, które emitują światło o określonej widzialnej długości fali, gdy są wystawione na działanie światła o innej długości fali. Kiedy te fluorofory są związane z ukierunkowaną strukturą zainteresowania, fotony emitowane z fluoroforu mogą być użyte do wizualizacji tej struktury zainteresowania. Zaletą mikroskopii fluorescencyjnej jest to, że docelowe struktury są oświetlone, podczas gdy niepożądane obszary próbki mają niewielką lub zerową fluorescencję, co pozwala na łatwe kierowanie i obrazowanie.
dlaczego cząsteczki fluoryzują
źródłem fluorescencji są elektrony poruszające się swobodnie wokół aktywnego fluoroforu i uwalniające pochłoniętą energię, jak pokazano na Fig.2.
przed wzbudzeniem elektrony znajdują się w najniższym dostępnym dla nich stanie energetycznym – stanie podstawowym (S0). Gdy elektron uderza w Foton o określonym zakresie energii, elektron pochłania energię fotonu i przeskakuje do wyższego stanu energetycznego (S1, S2 lub S3). Aby powrócić do stanu podstawowego (S0), elektron uwalnia dodatkową energię w postaci emisji fotonu. Energia tego fotonu jest mniejsza niż energia wzbudzenia, więc ma dłuższą długość fali. To dlatego światło emisyjne ma dłuższą długość fali niż światło wzbudzenia i może pojawić się jako inny kolor.
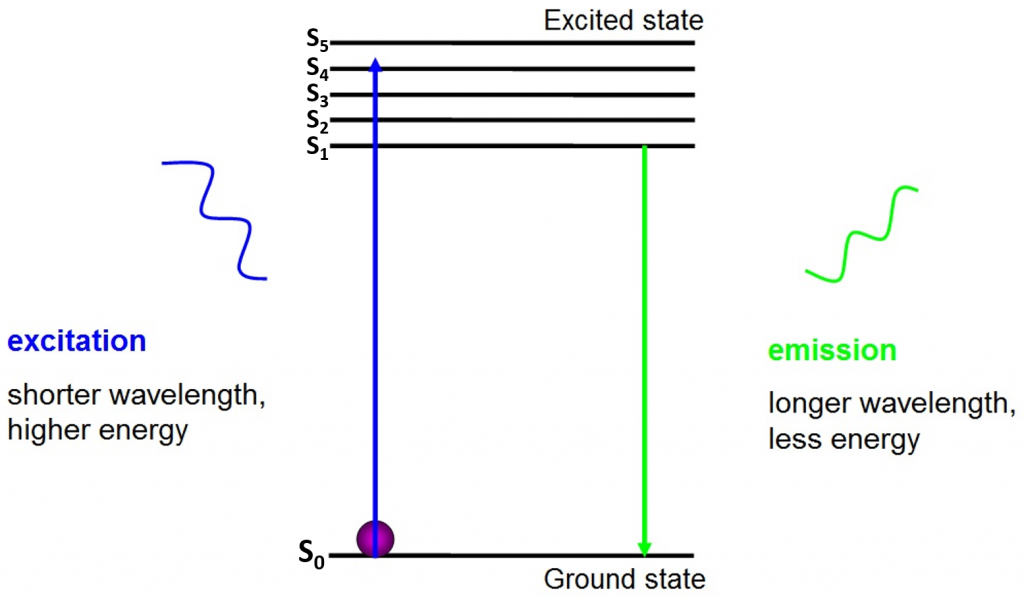
emitowany foton jest zwykle w widmie widzialnym i może być oglądany pod mikroskopem, jeśli istnieje wystarczająco dużo wzbudzonych fluoroforów. Długość fali uwalnianego fotonu jest specyficzna dla każdego fluoroforu i ta przewidywalność pozwala na łatwe zobrazowanie fluorescencji.
współczynniki intensywności fluorescencji
podczas gdy fluorofory mogą emitować fluorescencję o przewidywalnej długości fali, ważne jest również, aby wiedzieć, jakie czynniki kontrolują intensywność fluorescencji. Bez wystarczająco intensywnej emisji światła fluorescencja nie będzie wykrywalna za pomocą mikroskopu.
wydajność kwantowa
wydajność kwantowa (ϕ) fluoroforu jest stosunkiem liczby uwolnionych fotonów do liczby pochłoniętych fotonów. Wydajność kwantowa jest często wyrażana jako wartość od 0-1, z czego 1 jest 100% skutecznością konwersji fotonów. Ważne jest również, aby pamiętać, że każdy fluorofor ma unikalne pH, wytrzymałość jonową i temperaturę dla optymalnej skuteczności fluorescencji.
Współczynnik ekstynkcji
każdy fluorofor ma inną zdolność pochłaniania fotonów, nawet jeśli znajdują się w odpowiednim zakresie długości fali, aby je wzbudzić. Jeśli fluorofor jest wystawiony na działanie fotonu odpowiednio dopasowanego do jego długości fali wzbudzenia, prawdopodobieństwo, że Foton zostanie wchłonięty, jest mierzalną cechą i jest znane jako współczynnik ekstynkcji (ε).
wydajność kwantowa fluoroforu i współczynnik ekstynkcji są często wyświetlane razem, aby opisać, jak jasny fluorofor jest pokazany w warunkach eksperymentalnych.
żywotność fluorescencji
kiedy elektron fluoroforowy pochłania Foton, nie od razu uwalnia Foton o dłuższej długości fali. Wiadomo, że uwolnienie pewnej energii między wzbudzonymi Stanami energii zajmuje różne długości czasu. Ilość czasu, który elektron spędza w stanie wzbudzonym przed uwolnieniem fotonu i powrotem do stanu podstawowego, jest miarą jego żywotności fluorescencji. Żywotność każdego fluoroforu jest unikalna i może być mierzona eksperymentalnie. Przy użyciu barwników fluorescencyjnych eksperymentalnie, jest to pomocne dla ich życia, zwłaszcza w zastosowaniach, które wymagają dużej prędkości, takich jak neurony obrazowania wapnia.
intensywność długości fali wzbudzenia
większość ustawień mikroskopii fluorescencyjnej Zawiera źródło światła, które można dostroić, aby uzyskać żądany zakres długości fali. Wiele źródeł światła fluorescencyjnego można również dostosować do intensywności wzbudzenia, aby zwiększyć liczbę fotonów poruszających się po ścieżce światła. W fluorescencyjnie znakowanej próbce, która jest wystawiona na jej długość fali wzbudzenia, każdy fluorofor nie zostanie aktywowany w tym samym czasie. Zwiększając intensywność wzbudzenia i zwiększając liczbę fotonów docierających do próbki, istnieje większe prawdopodobieństwo, że więcej fluoroforów będzie wzbudzonych.
Fotostabilność
Fotostabilność to zdolność cząsteczki lub organizmu do odporności na uszkodzenia. W mikroskopii fluorescencyjnej fluorophores ostatecznie zatrzymują absorbujący nadjeżdżających fotonów i iść w permanentnym ciemnym stanie. Jak organizm gromadzi więcej fluorophores w ciemnym stanie, wygląd znakowany cel zmniejsza, i próbka mówi się photobleaching. W mikroskopii fluorescencyjnej, kroki są często podejmowane w celu zmniejszenia ilości photobleaching doświadczonych podczas eksperymentów. Niektóre środki obejmują zmniejszenie intensywności światła interakcji z próbki i stosowanie specjalistycznych barwników fluorescencyjnych, które nie pozostają aktywne tak długo, jak inne barwniki.
mikroskopia Fluorescencyjna
dla naukowców główną zaletą fluorescencji jest możliwość zastosowania mikroskopii fluorescencyjnej, w której próbki są znakowane / barwione substancją fluorescencyjną, taką jak barwnik, przeciwciało lub białko, co pozwala na kontrast obrazów. Kierując te fluorescencyjne etykiety, naukowcy mogą wybrać to, co chcą zobaczyć. Jest to pokazane na Fig.3, gdzie neuron może być wyraźnie widoczne wśród astrocytów, ponieważ są one oznaczone różnymi kolorami markera fluorescencyjnego.
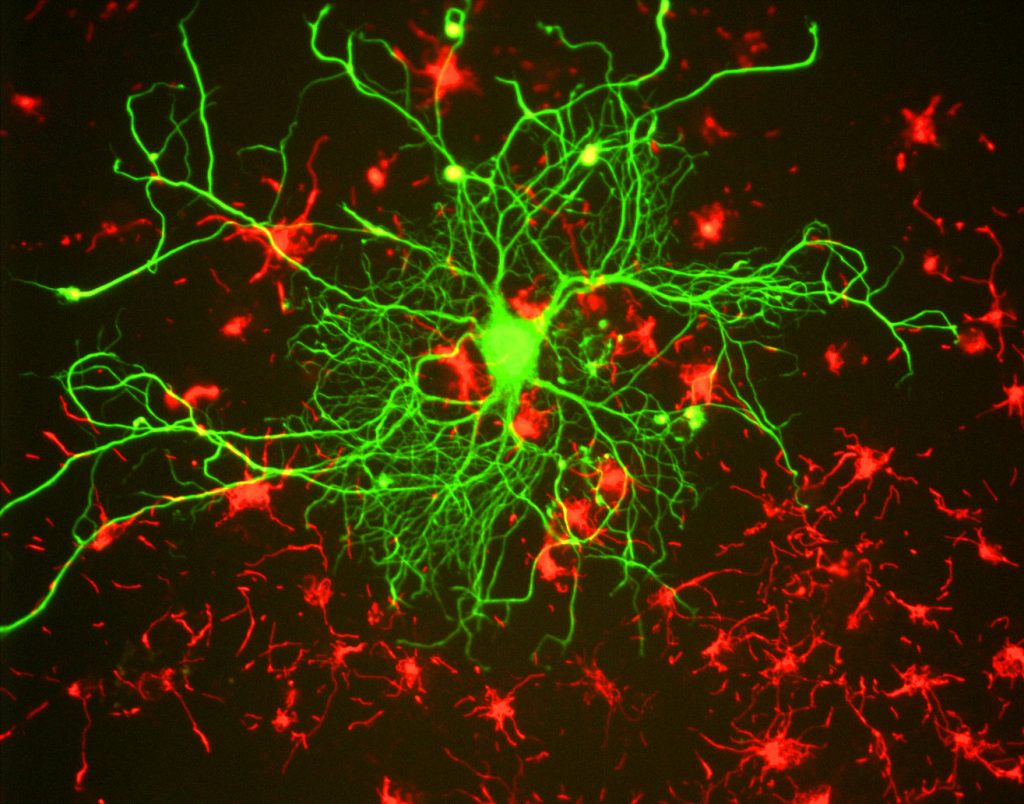
ogólnie rzecz biorąc, w mikroskopii fluorescencyjnej, próbka jest oznaczona markerami fluorescencyjnymi (typowo specyficznymi dla niektórych części próbki). Próbka jest następnie oświetlana określoną długością wzbudzenia dla fluoroforu, a otrzymana fluorescencja emisyjna jest odbierana przez detektor, Zwykle wrażliwy aparat naukowy.
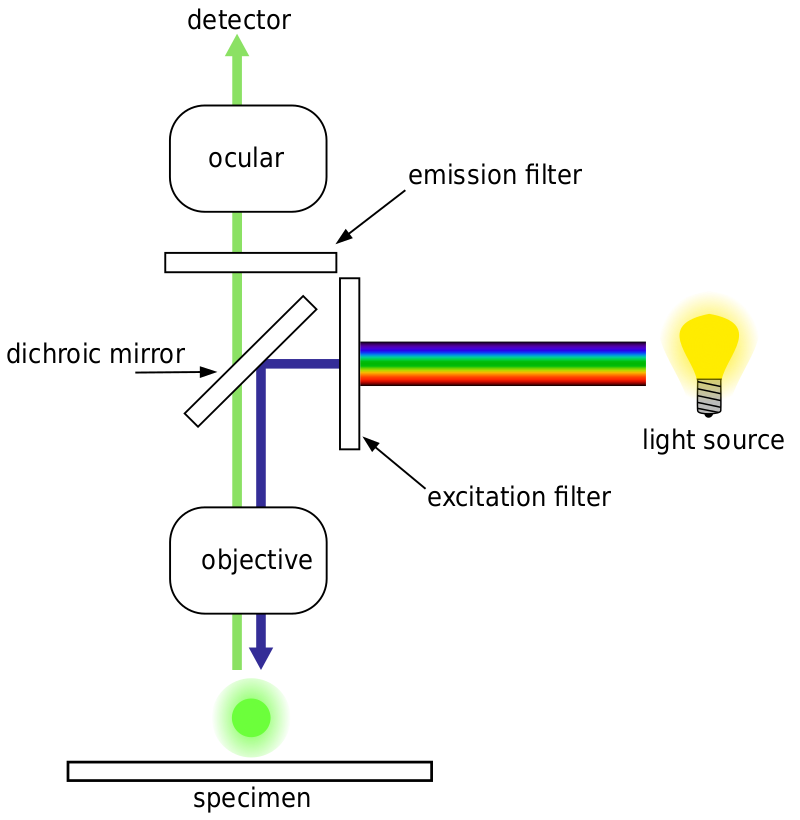
Większość mikroskopów fluorescencyjnych to mikroskopy epifluorescencyjne, w których wzbudzenie i emisja są wykonywane przez tę samą ścieżkę światła. Zarówno oświetlenie wzbudzenia, jak i emitowana fluorescencja przechodzą przez cel mikroskopu i zwykle są filtrowane w celu wykrycia fluorescencji. Ta konfiguracja jest pokazana na Fig.4.
Autofluorescencja
niektóre struktury, organizmy biologiczne i ogólne próbki mikroskopii mogą naturalnie wykazywać fluorescencję, znaną jako autofluorescencja. Różni się to od fluorescencji z oznaczonych próbek, ale często dzieli podobne długości fal, co oznacza, że próbki mikroskopii autofluorescencyjnej mogą przesłaniać sztucznie dodaną fluorescencję i zakłócać wykrywanie, zmniejszając sygnał. Ważne jest, aby wiedzieć, czy twoje próbki wykazują autofluorescencję, ponieważ wpłynie to na jakiekolwiek obrazowanie fluorescencyjne, chyba że używane są określone długości fal, aby tego uniknąć.
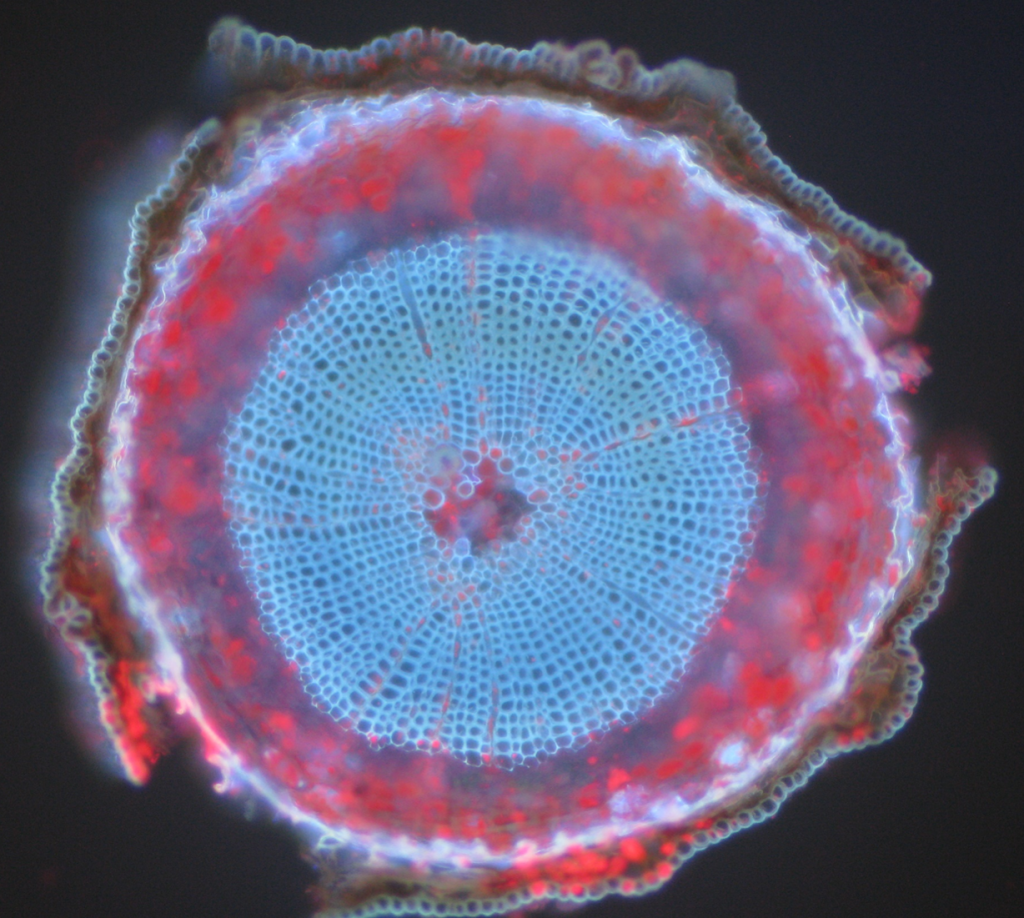
typowymi przykładami obiektów autofluorescencyjnych są mitochondria, lizosomy, kolagen i niektóre aminokwasy, takie jak tryptofan, tyrozyna i fenyloalanina. Przede wszystkim autofluorescencja jest powszechna w roślinach ze względu na ich zastosowanie chlorofilu i innych cząsteczek fluorescencyjnych, takich jak ligniny i karoteny. Fig.5 pokazuje różne kolory autofluorescencji z nieoznakowanej próbki sosny szkockiej.
podsumowanie
od wprowadzenia pierwszego fluorescencyjnego barwnika, mikroskopia fluorescencyjna była szeroko wykorzystywanym narzędziem do wizualizacji komórek i struktur komórkowych z wyższą specyfiką niż tradycyjne techniki mikroskopii brightfield. Badacze mogą przedstawić strukturę, właściwości optyczne i eksperymenty z napływem zainteresowania w celu uzyskania odpowiednich danych. Taka elastyczność pozwoliła na włączenie mikroskopii fluorescencyjnej do wielu eksperymentów z naukami przyrodniczymi.
w zależności od rodzaju próbki i fluoroforu, aparat naukowy powinien być starannie wybierany, aby uzyskać najlepsze wyniki obrazowania.
- Mikroskopia Świetlna. (2009) Nature Milestones. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Jasne pomysły na biologię chemiczną. ACS Chemical Biology, 3(3): 142-155.
- Liu, Y., Lilly, D. (2017) struktury krystaliczne, jeśli cyjan Fluorofory układają się na końcu dwuniciowego RNA. Biophysical Journal, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Pomiary żywotności fluorescencji i obrazowanie biologiczne. Chemical Reviews, 110(5): 2641-2684.
- Stockert, J., Blazquez-Castro, A. (2017) mikroskopia fluorescencyjna w naukach przyrodniczych. Sharjah, ZEA. Bentham Science Publishers.
- Berezin, M. Y., & Achilefu, S. (2010). Pomiary żywotności fluorescencji i obrazowanie biologiczne. Chemical Reviews, 110(5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). Dwufotonowa Laserowa Skaningowa Mikroskopia Fluorescencyjna. Nauka. 248, (1951): 73-76.
- So, P. (2002). Dwufotonowa Fluorescencyjna mikroskopia świetlna. Macmillan Publishing Group.
- Schermelleh, L., Heinztmann, R., and Leonardt, H. (2010). A Guide to Super-Resolution Fluorescence Microscopy. The Journal of Cell Biology 190 (2): 165-175.
- Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., Davidson, M. W., LippincottSchwartz, J., Hess, H. F. (2006) Imaging intracellular fluorescent proteins at nanometer resolution. Nauka. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) sub-diffraction-limit imaging by Stochastic optical reconstruction microscopy (STORM). Metody Nat. 2, (10):793-5.
- Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M., and Gustasson, M. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avendaño, M. S., Woehrstein, J. B., Dai, M., Shih, W. M. & Yin, P. (2014) multipleksowane obrazowanie superrozdzielczości komórkowej 3D za pomocą farby DNA i farby wymiany. Metody Nat. 11(3): 313-318
- Jiang, X., Wang, L., Carroll, S., Chen, J., Wang, M., and Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.