além do processamento de proteínas, o ER e o Golgi também cuidam de alguns tipos de transporte de proteínas. Vesículas (bolhas ligadas à membrana, essencialmente) se retiram das ER, Golgi e outras organelas membranosas, Carregando com elas quaisquer moléculas solúveis que estivessem dentro do fluido que estava fechado, bem como quaisquer moléculas incorporadas nessa seção da membrana. Estas vesículas, em seguida, pegar uma carona em um motor molecular, como cinesina ou miosina, e viajar ao longo do citosqueleto até que eles acoplar no destino apropriado e fundir-se com a membrana alvo ou organela. Em geral, as vesículas movem-se do ER para o cis Golgi, do cis para o Golgi medial, do medial para o trans Golgi, e do trans Golgi para a membrana plasmática ou outros compartimentos. Embora a maioria dos movimentos seja nesta direção, há também vesículas que se movem de volta do Golgi para as urgências, Carregando proteínas que deveriam permanecer nas urgências (ex. E foram acidentalmente apanhados dentro de uma vesícula.
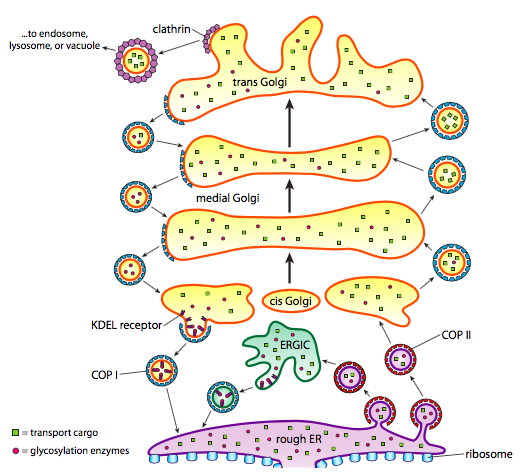
a formação de vesículas depende de proteínas de revestimento que, em condições adequadas, se auto-montam em gaiolas esféricas. Quando associados com proteínas transmembranares, eles podem puxar a membrana ligada ao longo de uma forma esférica também. Os principais tipos de proteínas utilizadas na formação de vesículas são COPII, COPI e clatrina.COPII coat proteins form the vesicles that move from ER to Golgi. COPI coat proteins are used between parts of the Golgi apparatus as well as to form vesicles going from the Golgi back to the ER. Por último, a clatrina é utilizada para formar vesículas que deixam o Golgi para a membrana plasmática, bem como para vesículas formadas a partir da membrana plasmática para endocitose.
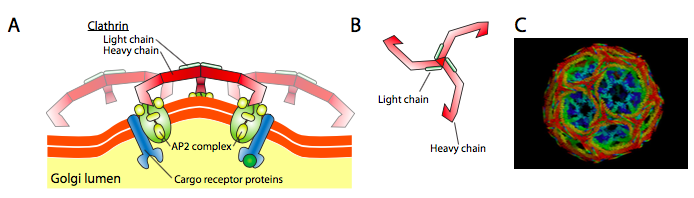
clatrina( a figura \(\PageIndex{17}\)) é a melhor descrita das três, e as camadas vesiculares são feitas a partir de arranjos de triskelions clatrina (do grego, que significa três pernas). Cada triskelion é composto por três cadeias pesadas Unidas no C-terminus, e três cadeias leves, uma associada com cada cadeia pesada. As cadeias pesadas de diferentes triskelions interagem ao longo do comprimento de suas “pernas” pesadas para criar uma construção muito resistente. As cadeias de luz são desnecessárias para a formação de vesículas, e acredita-se que ajudam a prevenir interações acidentais de moléculas de clatrina no citoplasma.
existe uma semelhança significativa entre os mecanismos de formação das vesículas usando estas diferentes proteínas da camada, começando com o recrutamento de ARF1 (ARF significa fator de ribossilação ADP, que não tem nada a ver com a sua função aqui) para a membrana. Isto requer o intercâmbio facilitado de um GTP para o PIB (ARNO é o abridor do site de ligação nucleotídeo ARF). Uma vez que ARF1 tenha ligado GTP, a mudança conformacional revela um grupo miristoílo N-terminal que se insere na membrana. Tanto as vesículas revestidas de COPI como de clatrina utilizam ARF1 e ARNO, mas o COPII utiliza proteínas semelhantes denominadas Sar1p e Sec12p..
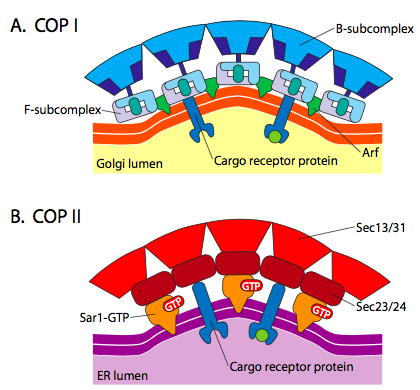
figura \(\PageIndex{18}\). Vesículas revestidas com COP
a ARF1 (ou Sar1p) é utilizada para recrutar proteínas adaptadoras que se ligam à extremidade “cauda” das proteínas receptoras ligadas à membrana. O fim de Negócio destes receptores liga-se às moléculas car-go que precisam ser embaladas na vesícula. As proteínas adaptadoras agem como a ligação entre a membrana (através dos receptores) e as proteínas do revestimento. Para clatrina, as proteínas adaptadoras são AP1 para vesículas derivadas de trans-Golgi e AP2 para vesículas endocíticas. Para COPI vesículas, os cerca de homólogos são o β-, γ-, δ-e ζ – Policiais enquanto o KIDS usa o sistema de Sec23p e Sec24p.
Finalmente, as placas de ligação para real brasão de proteínas: clathrin, α – ou ε – COP, Sec13p e Sec31p. O que essas proteínas têm em comum é que, espontaneamente (isto é, sem qualquer necessidade de despesa energética), eles se auto-montar em estruturas esféricas tipo gaiola. Sob o microscópio eletrônico, as vesículas revestidas de clatrina são mais acentuadamente definidas e as formas hexagonais e pentagonais delimitadas pelas subunidades de clatrina dão à vesícula um olhar de “bola de futebol”. As vesículas revestidas com coatâmero de polícias têm um aspecto muito mais Peludo sob a forma de EM.
todos os três tipos de proteínas da camada vesicular têm a capacidade de se associarem espontaneamente a uma construção esférica, mas apenas a vesícula revestida de COPI e COPII também espontaneamente “beliscam” a membrana para libertar a vesícula da sua membrana originária. As vesículas revestidas de clatrina necessitam de um mecanismo externo para libertar a vesícula [figura \(\PageIndex{19}\)].
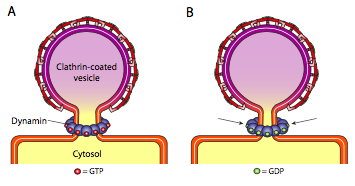
uma vez que a vesícula esteja quase completa, ainda existe um pequeno pedúnculo ou pescoço de membrana que liga a vesícula à membrana. Em torno deste pedúnculo, moléculas GTP dinâmicas agregam-se numa construção anel/espiral. Moléculas de Dynamin são GTPases globulares que se contrai sobre a hidrólise de GTP. Quando se associam em torno do pedúnculo vesicular, cada proteína dinâmica contrai-se, com o efeito combinado de apertar o pedúnculo o suficiente para que a membrana se agarre, selando e libertando a vesícula da membrana originária.
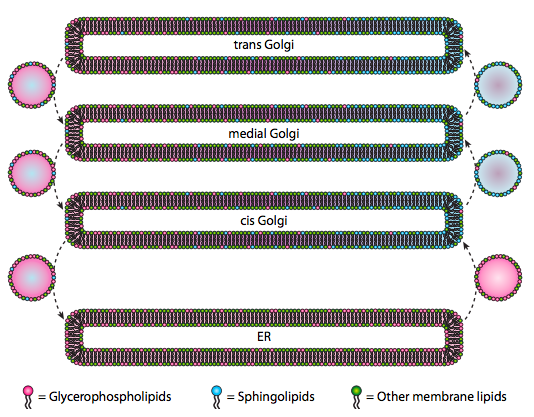
embora lípidos e membranas foram discutidos no Capítulo 4, negligenciamos discutir a localização de suas sínteses em eucariotas. Como a figura \(\PageIndex{20}\) indica, a síntese de certos tipos de lípidos é segregada e exclusiva. Os glicerofosfolípidos são formados principalmente no retículo endoplasmático, embora também sejam feitos em mitocôndrias e peroxissomas. Em contraste, esfingolípidos não são feitos nas urgências (embora os seus precursores ceramide sejam) em mamíferos, as enzimas necessárias são encontradas no lúmen do cis e do Golgi medial. Há evidências de tráfego vesicular anterógrado e retrógrado entre os vários compartimentos Golgi e ER, o que teoricamente indicaria uma redistribuição dos tipos lipídicos. No entanto, os esfingolípidos tendem a se agregar em jangadas lipídicas e parecem estar mais concentrados em vesículas anterógradas.
as proteínas do revestimento saem logo após a libertação vesicular. Para clatrina, o processo envolve Hsc70, um ATPase. No entanto, no caso das vesículas revestidas de COPI ou COPII, a hidrólise do GTP em ARF/Sar1p parece enfraquecer a afinidade da proteína de revestimento para os adaptadores e inicia a descoagulação. O ativador GTPase é o GAP ARF (ou Sec23p) e é parte integrante do COP I (ou II) coat.
as vesículas transportam duas categorias de carga: proteínas solúveis e proteínas transmembranares. Das proteínas solúveis, algumas são captadas na vesícula em virtude de estarem ligadas a um receptor. Outras proteínas estão nas proximidades e são recolhidas à medida que a vesícula se forma. Ocasionalmente, uma proteína é tomada que não era suposto ser; por exemplo, PDI pode ser fechado em uma vesícula formando a partir do ER. Ele tem pouca função no Golgi, e é necessário nas urgências, então o que acontece com ele? Felizmente, PDI e muitas outras proteínas ER têm uma sequência de sinal C-terminal, KDEL (ácido lisina-aspártico-ácido glutâmico-leucina), que grita “Eu pertenço às urgências.”Esta sequência é reconhecida pelos receptores KDEL dentro do Golgi, e a ligação das proteínas KDEL aos receptores desencadeia a formação da vesícula para enviá-los de volta para as urgências.As vesículas secretoras têm um problema especial com a carga solúvel. Se a vesícula dependesse simplesmente de envolver proteínas dentro dela durante o processo de formação, seria difícil obter concentrações elevadas dessas proteínas. Muitas proteínas secretadas são necessárias pelo organismo rapidamente e em quantidades significativas, então há um mecanismo no Trans Golgi para agregar proteínas secretoras. O mecanismo utiliza a agregação de proteínas, tais como a secretogranina II e a cromogranina B, que reúnem as proteínas-alvo em grandes grânulos concentrados. Estas graninas funcionam melhor no meio Trans Golgi de baixo pH e alto Ca2+, de modo que quando a vesícula liberta o seu conteúdo fora da célula, o pH mais elevado e o Ca2+ mais baixo quebram os agregados para libertar as proteínas individuais.
há uma mudança de pH consistente durante a maturação do Golgi, de modo que à medida que vamos de ER para Golgi, cada compartimento tem um pH lumenal progressivamente mais baixo (mais ácido).Finalmente, há a questão de visar as vesículas. As vesículas são muito menos úteis se forem atiradas num comboio de carga molecular e largadas aleatoriamente. Portanto, há um mecanismo de acoplagem que requer uma correspondência da proteína V-SNARE na superfície citoplasmática da vesícula e o T-SNARE na superfície citoplasmática da membrana alvo. A fusão da vesícula à membrana só prossegue se houver uma combinação. Caso contrário, a vesícula não pode fundir-se, e vai ligar-se a outro motor molecular para ir para outro destino, Esperemos que correcto. Este processo é auxiliado por proteínas de amarração que inicialmente fazem contato com uma vesícula de entrada e atraem-na suficientemente perto do alvo para testar a interação com proteína de laço. Outras proteínas na vesícula e membranas alvo, em seguida, interagem e se as armadilhas coincidem, pode ajudar a” guinar ” a vesícula na membrana alvo, então as membranas se fundem. Uma regra importante para entender a fusão vesiculosa e também a direcionalidade das proteínas de membrana e lípidos, é que o lado citoplásmico-voltado para uma membrana vai estar sempre enfrentando o citoplasma. Portanto, uma proteína que é eventualmente encontrada na superfície exterior da membrana celular terá sido inserida na superfície lumenal da membrana ER para começar.
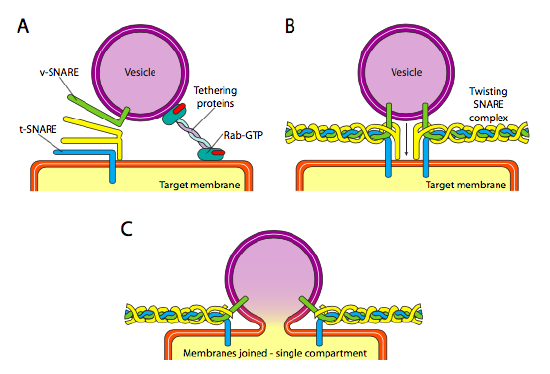
mais especificamente, à medida que uma vesícula se aproxima da membrana alvo, a proteína de amarração Rab-GTP, que está ligada à membrana alvo através de uma cauda lipídica dupla geranilgeranil, liga-se vagamente à vesícula e mantém-na na vizinhança da membrana alvo para dar às armadilhas uma oportunidade de trabalhar. Os V-SNAREs e t-SNAREs agora têm a oportunidade de interagir e testar para um jogo. Recentemente, as armadilhas foram renomeadas R-SNAREs e Q-SNAREs, respectivamente, com base em resíduos conservados de arginina e glutamina. Além destas duas armadilhas primárias, pelo menos uma outra é envolvida, formando um conjunto de quatro α-hélices (quatro, Não três, porque pelo menos no melhor exemplo estudado, uma das Armadilhas é dobrada em torno de modo que dois de seus domínios Alfa-helicoidais participam da interação. As quatro hélices enrolam-se umas às outras e pensa-se que, ao fazê-lo, elas puxam a vesícula e a membrana alvo juntas.
a toxina do tétano, a tetanospasmina, que é libertada pela bactéria Clostridium tetani, causa espasmos por acção nas células nervosas e impede a libertação de neurotransmissores. O mecanismo para isso é que ele clama sinaptobrevin, uma proteína de laço, de modo que as vesículas sinápticas não podem se fundir com a membrana celular. A toxina botulínica, de Clostridium botulinum, também atua em armadilhas para prevenir a fusão vesicular e a liberação de neurotransmissores, embora tenha como alvo diferentes neurônios e assim tem o efeito oposto: o tétano é causado pela prevenção da libertação de neurotransmissores inibitórios, enquanto o botulismo é causado pela prevenção da libertação de neurotransmissores excitatórios.