Reação: Hidratação de Alkynes
Como com os alcenos,hidratação (adição de água) para alkynes requer um ácido forte, normalmente ácido sulfúrico, e é facilitada pela mercuric sulfato. No entanto, ao contrário das adições a duplas ligações que dão produtos alcoólicos, a adição de água a alcynes dá Produtos de cetona ( exceto para o acetileno que produz acetaldeído ). A explicação para este desvio está na tautomerização enol-keto, ilustrada pela seguinte equação. O produto inicial da adição de água a um alquino é um enol (um composto que tem um substituinte hidroxilo ligado a uma ligação dupla), e isso imediatamente se reorganiza para o ceto tautômero mais estável.
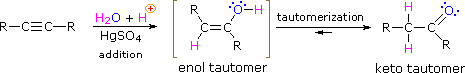
os Tautómeros são definidos como rapidamente interconverted constitucional de isómeros, que normalmente são distinguidos por uma ligação local para um átomo de hidrogênio lábil (de cor vermelha) e uma forma diferente localizado ligação dupla. O equilíbrio entre tautômeros não é apenas rápido em condições normais, mas muitas vezes favorece fortemente um dos isômeros ( acetona, por exemplo, é 99.999% de keto tautomer ). Mesmo em tais equilíbrios unilaterais, a evidência para a presença do tautômero menor vem do comportamento químico do composto. Os equilíbrios tautoméricos são catalisados por vestígios de ácidos ou bases que estão geralmente presentes na maioria das amostras químicas. Os três exemplos mostrados abaixo ilustram essas reações para diferentes substituições da tripla ligação. O passo de tautomerização é indicado por uma seta vermelha. Para alcynes terminais a adição de água segue a regra Markovnikov, como no segundo exemplo abaixo, e o produto final ia a metilcetona ( exceto para acetileno, mostrado no primeiro exemplo ). Para alkynes internos (a tripla ligação está dentro de uma cadeia mais longa ) a adição de água não é regiosseletiva. Se a tripla ligação não estiver simetricamente localizada ( ou seja, se R & r’ na terceira equação não for a mesma ) duas cetonas isoméricas serão formadas.
HC≡CH + H2O + HgSO4 & H2SO4 –> –> H3C-CH=O
RC≡CH + H2O + HgSO4 & H2SO4 –> –> RC(=O)CH3
RC≡CR + H2O + HgSO4 & H2SO4 –> –> RCH2-C(=O)R’ + RC(=O)-CH2R’
Com a adição de água, alkynes pode ser hidratado para formar enols que, espontaneamente, tautomerize para cetonas. A reacção é catalisada por iões de mercúrio. Segue a regra de Markovnikov: Terminal alkynes dar-metil cetonas
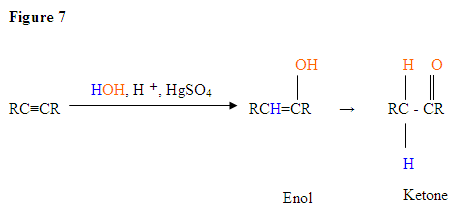
- O primeiro passo é um ácido/base de reação, onde os elétrons π da ligação tripla atua como uma base de Lewis e ataques de prótons, portanto, protinating carbono com mais de hidrogénio substituintes.
- the second step is the attack of the nucleophilic water molecule on the electrophilic carbocation, which creates an oxonium ion.
- em seguida você desprotona por uma base, gerando um álcool chamado enol, que então tautomeriza em uma cetona.
- tautomerismo é um deslocamento simultâneo de prótons e duplas ligações, que vai da forma enol para a forma de isômero de ceto, como mostrado acima na Figura 7.
agora vamos olhar para algumas reações de hidratação.
a Hidratação do Terminal Alkyne produz metil cetonas
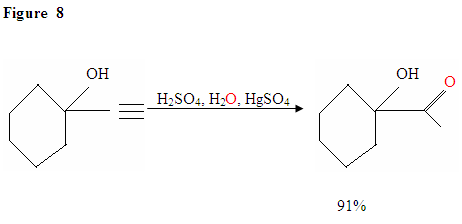
assim como descrito na Figura 7 os elétrons π vai atacar um próton, formando um carbocation, que é atacado pelo nucleophilic moléculas de água. Após a desprotinação, nós geramos um enol, que então tautomeriza na forma de cetona mostrada.
Hidratação de Alkyne
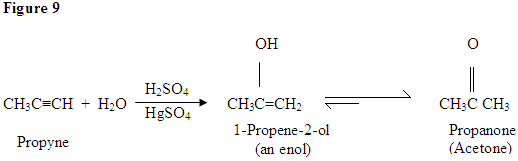
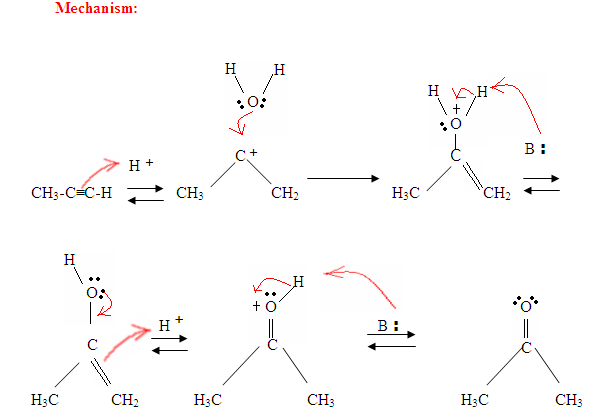
Como você pode ver aqui, os elétrons π da ligação tripla estão atacando o próton, que forma uma ligação covalente bond no carbono com mais de hidrogénio substituintes. Uma vez que o hidrogênio Está ligado você tem um carbocation, que é atacado pela molécula de água. Agora você tem uma carga positiva no oxigênio que resulta em uma base chegando e desprotegindo a molécula. Uma vez desprotegido, você tem um enol, que depois é tautomerizado.
tautomerismo é mostrado aqui quando o próton é atacado pela ligação dupla elétrons π formando uma ligação covalente entre o carbono e o hidrogênio no carbono menos substituído. Elétrons do oxigênio acabam se movendo para o carbono, formando uma dupla ligação com o carbono e dando a si mesmo uma carga positiva, que então é atacada pela base. A base desprotina o oxigênio resultando no produto final mais estável em equilíbrio, que é uma cetona.
Exercício de \(\PageIndex{1}\)
- Desenhar a estrutura de produto formado quando cada uma das substâncias abaixo é tratada com H2O/H2SO4 na presença de HgSO4.
- $\ce{\sf{CH3-CH2-C#C-H}}$
-
- Desenhar a estrutura do ceto do composto mostrado abaixo. Qual seria a forma mais estável?
Resposta
Respostas:
O ceto deve ser o mais estável.
questões prejudiciais.4.1
com que alkyne você começaria para ganhar os seguintes produtos, em uma reação de oxidação? Tenha em mente a ressonância.

Q9. 4.2
propor um esquema de reação para o seguinte composto a partir do alquino e mostrando reagentes e intermediários necessários.

Soluções
S9.4.1

S9.4.2
