Cell adhesion
Cell adhesion é o processo pelo qual as células interagem com moléculas específicas na superfície celular e se ligam a células adjacentes. Este processo pode ocorrer através de interações diretas ou indiretas entre superfícies celulares, onde as células se ligam à matriz extracelular circundante, que contém as moléculas liberadas pelas células no espaço entre as células. A adesão celular ocorre quando a molécula de adesão celular (CAM) interage com uma proteína transmembranar localizada na superfície celular. A adesão celular liga as células de diferentes formas e pode participar na transdução de sinal para permitir que as células detectem e respondam a mudanças no ambiente circundante. Outros processos celulares regulados pela adesão celular incluem migração celular e desenvolvimento de tecidos em organismos multicelulares. Mudanças na adesão celular podem perturbar importantes processos celulares e levar a uma variedade de doenças, incluindo câncer e artrite. A adesão celular também é essencial para doenças causadas por organismos infecciosos como bactérias ou vírus.
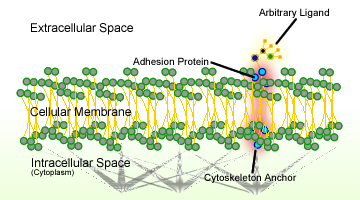 Figura 1. Os esquemas de adesão celular
Figura 1. Os esquemas de adesão celular
as classificações
CAMs estão divididos em quatro famílias principais: integrinas, imunoglobulina (Ig) superfamília, cadherina e selectinas. Cada uma destas moléculas de adesão tem uma função diferente e reconhece um ligante diferente. Cadherins e imunoglobulinas são homotypic CAMs, porque eles se ligam diretamente para o mesmo tipo de CAM em outra célula, enquanto integrinas e selectins são heterologous CAMs que se ligam a diferentes tipos de CAM. Defeitos na aderência celular são muitas vezes atribuídos a defeitos na expressão da cam. Em organismos multicelulares, a ligação entre CAMs faz com que as células adiram umas às outras e formem uma estrutura chamada junção celular.
de acordo com as suas funções, as junções celulares podem ser classificadas como:
junções de ancoragem (junções de aderência, desmossomas e hemidesmosomas), que mantêm as células ao longo e fortalecem o contacto entre as células.
entroncamentos (entroncamentos apertados), que selam aberturas entre as células através do contato célula–célula, criando uma barreira resistente à água para difusão.
junções de formação de canais (junções de abertura), que ligam protoplasma de células adjacentes permitindo o transporte de moléculas para ocorrer entre as células.
junções de transmissão de Sinais, que podem ser sinapses dentro do sistema.
Alternativamente, as junções celulares podem ser classificadas em duas variedades principais, de acordo com o que interage com a célula: junções célula–célula, no principal mediado por cadherinas, e junções de matriz celular, no principal mediado por integrinas.
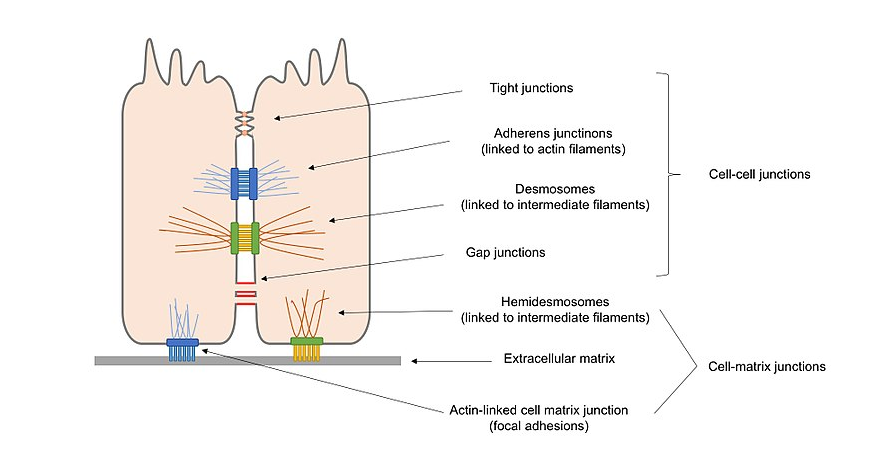 Figura 2. Diagrama geral dos diferentes tipos de junções celulares presentes nas células epiteliais, incluindo junções célula–célula e junções de matriz celular.
Figura 2. Diagrama geral dos diferentes tipos de junções celulares presentes nas células epiteliais, incluindo junções célula–célula e junções de matriz celular.
características estruturais das proteínas de adesão celular
as proteínas de adesão celular são geralmente glicoproteínas que mediam o reconhecimento da matriz celular e extracelular na superfície extracelular. A maioria das moléculas de adesão celular tem conformações semelhantes em seus domínios adesivos. Por exemplo: os domínios adesivos da cadherina, imunoglobulina tipo, fibronectina tipo III e EGF são predominantemente estruturas de chapas β. O motivo comum envolvido na aderência celular é a estrutura do barril de chave grego contendo uma ou duas sanduíches β anti-paralelas.
domínios semelhantes a GI são uma grande classe de domínios do barril-chave grego. Têm semelhanças sequenciais com o domínio variável ou constante de anticorpos contendo sete a nove cadeias β anti-paralelas. As folhas P Anti-paralelas formam um barril β 3-D. Domínios semelhantes a Ig são estabilizados por núcleo hidrofóbico e ligações de dissulfeto. Eles são divididos em dois conjuntos principais: IG C-like e IG V-like domínios.
características estruturais funcionalmente relacionadas das proteínas de adesão celular
as proteínas de adesão celular têm diversidade funcional. As interacções das moléculas de adesão celular podem ser interacções proteína-proteína homofílicas ou heterofílicas ou interacções proteína-hidratos de carbono. Mudanças estruturais das moléculas de adesão celular são muitas vezes relacionadas com suas propriedades funcionais.
Interacções Proteína-Proteína Homofílica.
por exemplo, as cadherinas são moléculas de adesão homofílica transmembranar dependentes de Ca2+. As cadherinas são responsáveis pela manutenção das junções entre células semelhantes nos tecidos. A adesão celular é mediada através do domínio N-terminal dos caderinos. Contém cinco domínios extracelulares similares EC1 a EC5. Estudos cristalográficos de raios X em N-cadherin mostraram que o domínio EC1 forma um dímero, no qual os monômeros são orientados em paralelo com a sua superfície de ligação adesiva apontando para fora da membrana plasmática. As unidades monoméricas dos domínios EC1 interagem entre si de uma forma antiparalél, utilizando as suas superfícies de ligação adesiva e formando uma estrutura de barril β. Uma interface putativa da interação foi sugerida para ter tanto o caráter hidrofóbico quanto polar/carregado que imita a interface da interação dos domínios de imunoglobulina uns com os outros na superfamília Ig.
Interacções Heterofílicas Proteicas.
por exemplo, a ligação das integrinas a vários receptores da superfície celular e ligantes da matriz extracelular é uma classe importante de interacção proteína-proteína heterofílica nos sistemas de adesão celular. Após a ligação ao fibrinogénio solúvel, a integrina aIIbß3 é convertida num estado de ligação de elevada afinidade. As alterações conformacionais da integrina induzidas pela ligação de ligando neste caso são críticas para a sua actividade adesiva. A ligação de um receptor das células T pode também modular a afinidade de ligação da integrina, o antigénio – 1 associado à função leucocitária (LFA-1), aos seus receptores como o ICAM-l ou o ICAM-2 (molécula de adesão celular intercelular). A ligação do ICAM-l pode ainda induzir alterações conformacionais do LFA-1. O local de ligação adesiva da proteína encontra-se no terminal C do LFA-l, com base num estudo cristalográfico de raios-X.Um tripéptido, o ácido arginina-glicina-aspártico (RGD), é um motivo comum de ligação do ligando integrina. Por exemplo, o módulo de ligando integrina tipo III da fibronectina tem uma estrutura em barril de chave grega, cujo motivo RGD, localizado no ápice do laço que liga as cadeias F E G β, media a aderência. A alisamento do laço RGD-loop em uma conformação flutuante mais linear por desdobramento reduz a acessibilidade do laço para as integrinas de ligação à superfície, e portanto diminui a afinidade e seletividade da ligação.Interacções Proteínas-Hidratos De Carbono.
as selectinas são importantes na interacção linfocitária e neutrofílica com o endotélio vascular. As selectinas são moléculas de adesão que se ligam aos hidratos de carbono. Não existem ainda quaisquer dados estruturais directos sobre a ligação das selectinas aos hidratos de carbono. As selectinas ligam-se aos hidratos de carbono com baixa afinidade e têm taxas de entrada e saída muito rápidas.