Introdução
acção enzimática da fosfodiesterase tipo 5 (PDE5) é o principal mecanismo para a inativação de cGMP, a jusante mediador de um agente vasodilatador do óxido nítrico (no) (Lugnier, 2006).
no decurso da disfunção eréctil (ED), a diminuição da produção de NO dos vasos cavernosos endoteliais pode ser farmacologicamente superada pelo uso de inibidores PDE5 (PDE5i), a fim de prolongar a semi-vida do GMPC e melhorar a função vasodilatadora residual (Hawksworth e Burnett, 2015). Várias moléculas com actividade inibitória na PDE5 foram então projectadas e libertadas no mercado, mostrando início e duração de efeito diferentes. Atualmente, PDE5i são os medicamentos de primeira escolha usados para o tratamento de ED (Mehrotra et al., 2007).
apesar de uma eficácia reconhecida em quase 80% dos doentes não seleccionados (Eardley et al., 2010; Hatzimouratidis et al., 2010; Porst et al., 2013), uma notável desistência do tratamento com PDE5i foi recentemente relatada. Em termos quantitativos, foi notificada uma taxa média de descontinuação de 4% por mês, com abandono total da terapêutica em 50% dos casos numa base anual (Carvalheira et al., 2012; Corona et al., 2016). Entre as principais razões dadas pelos pacientes para justificar o abandono da terapia, a falta de eficácia e efeitos colaterais são referidos como os mais prevalentes (Corona et al., 2016). Podem ser distinguidos dois tipos de efeitos secundários: aqueles estritamente relacionados com a inibição da PDE5, tais como dor de cabeça, rubor facial e dispepsia, e aqueles associados residuais de atividade inibitória de drogas em outros PDE, tais como vasodilatação e taquicardia (PDE1), distúrbios visuais (PDE6) e dor nas costas (PDE11) (Bischoff, 2004; Gupta et al., 2005). Uma vez que a ocorrência de efeitos secundários aumenta tanto com os níveis séricos como com a exposição Temporal ao fármaco (Gupta et al., 2005; Taylor et al., 2009), o perfil de segurança / eficácia de um medicamento pode ser alternativamente melhorado através de uma abordagem farmacocinética através da concepção de uma nova formulação de medicamento (Mehrotra et al., 2007). Esta abordagem foi aplicada com sucesso à PDE5i no caso do Vardenafil. Na verdade, esta molécula sofre de uma biodisponibilidade relativamente baixa (∼15%, Center for Drug Evaluation and Research, 2003). Comparado com o comprimido revestido por película (FCT), a formulação original para o clássico por so administração, a formulação de oro-comprimidos dispersíveis (ODT) para Vardenafil aumentou significativamente a biodisponibilidade de drogas, favorecendo a absorção sublingual, um percurso reconhecido a ser menos afetada pelo metabolismo de primeira passagem (Heinig et al., 2011).O Sildenafil (Sild) foi o primeiro inibidor selectivo da PDE5 aprovado para o tratamento de ED (Boolell et al., 1996). É uma molécula relativamente lipofílica e, após administração oral, a concentração plasmática máxima é atingida num período que varia entre 0, 5 e 2 h. O Sild apresenta uma biodisponibilidade oral relativamente baixa (38-41%), principalmente devido ao extenso metabolismo intestinal e de primeira passagem (Gupta et al. , 2005). Apesar da longa presença no mercado, o desenvolvimento de novas formulações de drogas tem sido mal prosseguido, até à recente libertação no mercado italiano de uma nova formulação: o filme orodispersível (ODF). Com efeito, o ODF foi aprovado como uma forma bioequivalente de FCT (Leoni et al., 2013). No entanto, as formulações de desintegração oral podem representar sistemas adequados para favorecer a trans-mucosa e, em particular, a absorção sub-lingual (Kathpalia e Gupte, 2013).
neste estudo, avaliámos a farmacocinética da Sild associada à administração sublingual de ODF ou ODT, em comparação com a FCT como formulação original por os. Para este fim, investigamos o perfil de libertação / permeação das diferentes formulações de Sild por sistemas in vitro desenvolvidos especificamente para avaliar a absorção trans-mucosa de medicamentos. Além disso, quantificámos os perfis séricos da farmacocinética do Sild após a administração de per os FCT, e ODT sublingual e ODF em doentes com ED.
materiais e métodos
Produtos Químicos e formulações medicamentosas
solução de sais de equilíbrio de Hank pH 7.4 (HBSS), solução de HEPES, benzanilida e citrato de Silda foram todos comprados a Sigma–Aldrich (Milão, Itália). A fim de evitar quaisquer resultados confusos resultantes da utilização de produtos bioequivalentes alternativos disponíveis no mercado, foram utilizados os seguintes produtos:: Viagra® FCT (Pfizer, Milão, Itália), Viagra ORO® ODT (Pfizer) e Rabestrom® ODF (IBSA, Lodi, Itália). Medicamentos foram prescritos aos pacientes durante a avaliação ambulatorial para seu uso privado. Para os testes in vitro e a avaliação in vivo da farmacocinética (ver abaixo), os medicamentos foram adquiridos especificamente pelo pessoal envolvido no estudo nas instalações da farmácia local e depois manuseados/armazenados em condições óptimas.
Desagregação de Teste
in vitro de desagregação testes foram realizados de acordo com a Farmacopeia Europeia (2016) usando o Tablet Desintegração Testador (Sotax DT 2, Complementar a Figura S1A), utilizando água como fluido de imersão a 37 ± 0,5°C. O tempo de desagregação, foi verificada a completa desintegração da forma de dosagem. A desintegração completa é definida como o estado em que qualquer resíduo da unidade que permaneça no ecrã do aparelho de ensaio ou aderente à superfície inferior dos discos é uma massa macia sem núcleo palpavelmente firme. Os testes foram realizados em triplicado e os resultados foram comunicados como valor médio ± desvio-padrão.Os testes de dissolução In vitro foram realizados de acordo com a Farmacopeia Europeia . Os testes de dissolução foram realizados usando um aparelho de remo, velocidade de remo 50 rpm, e HBSS pH 7.4 foi usado como volume médio de dissolução (900 ml a 37 ± 0.5°C).
durante os ensaios de libertação, 2 ml de amostra média de dissolução, a 0, 2, 4, 6, 10, 20, 30, e 40 min, foi removido e filtrado através de um filtro de ésteres de celulose de 0,45 µm e, portanto, diluído. Subsequentemente, a quantificação da Sild foi realizada por cromatografia líquida de alta resolução (HPLC)-UV. O volume removido foi substituído cada vez por meio fresco. Os testes foram realizados em triplicado e os resultados foram comunicados como valor médio ± desvio-padrão. Os dados foram normalizados sobre o conteúdo de drogas da formulação.
teste de permeação trans-mucosa
perfil de permeação Trans-mucosa do Sild foi avaliado in vitro utilizando um dispositivo específico de acordo com Delvadia et al. (2012) apropriadamente modificado. Brevemente, o dispositivo consistiu em um sistema de difusão vertical caracterizado por Câmaras doador–receptor separadas por uma membrana descartável de acetato de celulose (poro 0,45 µm). A célula dadora continha 1, 5 ml de HBSS, enquanto a câmara receptora fazia parte de um circuito fechado de recirculação de 30 ml, incluindo os volumes de tubagem e reservatório. A amostragem foi realizada a partir do reservatório da Câmara receptora nos intervalos de tempo de 0, 5, 10, 20, 30, e 40 min e substituído por um volume equivalente de HBSS fresco. As amostras foram analisadas por HPLC-UV para o conteúdo de drogas (Fejős et al., 2014). Os dados foram normalizados sobre a maior concentração permeada de Sild observada para o citrato de Sild puro. Os testes foram realizados em triplicado e os resultados foram comunicados como valor médio ± desvio-padrão.
Estudo de Farmacocinética em Voluntários Psicogênica ED Pacientes
O estudo foi realizado na Unidade de Andrologia e Medicina Reprodutiva (Hospital da Universidade de Padova, Itália), entre Maio e setembro de 2017, de acordo com a Declaração de Helsínquia sob a aprovação do Comitê de Ética da Universidade de Padova Hospital (protocolo nº 3982/AO/16 e sucessivas alterações). A fim de evitar resultados confusos, indivíduos com ED psicogênica foram matriculados porque a menor ocorrência de derangements orgânicos associados a ED (Ludwig e Phillips, 2014).
o tamanho da amostra foi calculado a fim de atingir um tamanho de efeito de pelo menos 0,5 com uma potência estatística de 0,8 e um nível de significância de 0,05 para uma comparação de três grupos (ver calculadora de potência – uma ANOVA independente).
vinte doentes (idade média de 31, 4 ± 5, 7 anos) foram inscritos consecutivamente pela libertação do consentimento informado e assinado. Os doentes participaram na avaliação ambulatorial relatando a incapacidade consistente de obter e manter uma erecção para relações sexuais satisfatórias durante os 6 meses anteriores ou mais. Foi realizada uma avaliação clínica Subsequente em todos os doentes, a fim de determinar a ausência de doenças relacionadas com a ED, tais como diabetes mellitus, hipertensão, distúrbio neurológico e o uso de antidepressivos. O diagnóstico de ED psicogénico foi confirmado pelo cumprimento de uma pontuação de índice <26 na administração do questionário do Índice Internacional da função eréctil-15 (IIEF-15) (Lotti et al., 2016) e a manutenção de ereções espontâneas noturnas, avaliadas por tumescência peniana noturna e monitoramento da rigidez através do sistema de avaliação RigiScan Plus Rigidity Assessment System (Dacomed, Estados Unidos) por duas noites consecutivas, como descrito anteriormente (Munoz et al., 1993; Caretta et al., 2005). Os critérios de exclusão foram o diagnóstico de neoplasias, hormonais anormais níveis de plasma (respectivamente, hormônio luteinizante >8 UI/l, a testosterona total <10.4 nmol/l, tirotropina >4.5 mUI/l, a prolactina >20 ng/ml), e o aumento intima-media espessura supra-aórtica troncos (>0.9 mm) e / ou artérias cavernosas (>0, 3 mm), avaliadas por Doppler colorido-ultrassom como descrito anteriormente (Caretta et al., 2005, 2009).
os doentes concordaram em aderir a um estudo aberto de três vias, com uma dose única. O esquema de dosagem do fármaco é descrito na Figura 1. A dosagem de Sild foi escolhida como 50 mg, de acordo com relatórios anteriores sobre o tratamento da ED psicogênica (Banner e Anderson, 2007). Foi solicitado aos doentes que não tomassem drogas ou álcool durante 1 semana antes e durante o curso do estudo. Além disso, durante o dia da administração do fármaco, foi também solicitado aos doentes que tomassem um pequeno-almoço sem gordura (sem leite ou outros alimentos gordos) pelo menos 2 horas antes do teste. A FCT, considerada como formulação de referência, foi administrada classicamente por So engolindo o comprimido oral com um copo de água. Para ODT e ODF, os doentes foram instruídos a manter a formulação sob a língua durante 15 minutos sem a assunção de água, seguida deglutição. Foram colhidas amostras de sangue venoso em tubos normalizados (Vacutainer, BD Biosciences, Milão, Itália) em 0, 5, 10, 15, 30, 60, 90, 120, e 240 min após administração de drogas. Foi efectuada uma compensação por perfusão contínua de solução salina estéril. Após a administração, os indivíduos foram alojados até completar a colheita de sangue. Foi realizada uma retirada de sangue adicional às 24 horas após a administração por razões de controlo para determinar a depuração completa do fármaco. Como períodos de washout, foram permitidos 7 dias entre uma dose e a seguinte. Após colheita de sangue, o plasma foi imediatamente isolado e conservado a -80°C até à sua utilização.
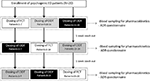
FIGURA 1. Esquema posológico e avaliações para a avaliação dos parâmetros farmacocinéticos em 20 doentes com disfunção eréctil psicogénica (ED), subdivididos em três grupos (respectivamente, doentes 1-7; doentes 8-14; e doentes 15-20). Cada grupo de doentes recebeu alternativamente por comprimido revestido por película os (FCT), comprimido sublingual orodispersível (ODT), ou película sublingual orodispersível (ODF) com pelo menos 1 semana de lavagem a partir de cada dose. Todas as formulações continham 50 mg de sildenafil (Sild).
durante a habitação, os doentes foram também convidados a registar reacções adversas medicamentosas (ADR) de uma forma especificamente concebida, adaptada da forma de notificação ADR da Agenzia Italiana del Farmaco (AIA1). Uma versão traduzida do questionário está disponível como Material complementar (Ver ficha S1). Os doentes foram convidados a especificar o tipo de reacção adversa/s, a intensidade global (numa escala de avaliação subjectiva de 1, Muito fraca, para 5, muito intensa), o tempo de início e a duração global.
Quantificação de Sildenafil em Soro Humano
Para a quantificação dos níveis séricos de Sild, 400 µl de amostra de soro foi adicionado 500 µl de metanol complementadas do padrão interno (É) benzanilide (5 µg/ml). Subsequentemente, adicionaram–se à mistura 5 ml de acetato de etilo, as amostras foram indexadas para efectuar a extracção líquido-líquido, as duas fases foram separadas por centrifugação. A porção orgânica foi então evaporada sob centrifugação A Vácuo a 40 ° C. O resíduo obtido foi re-dissolvido com 200 µl de metanol e finalmente utilizado na análise cromatografia líquida de alta resolução-espectrometria de massa tandem (HPLC-MS/MS).
cromatografia líquida de Alta eficiência-MS/MS de análise foi utilizado um sistema Agilent-Varian 1260 e o triplo quádruplo detector Agilent-Varian 320 MS. separação Cromatográfica foi realizada em uma coluna Phenomenex C-18 Evo 3 × 100 e uma fase móvel constituída de acetonitrilo com 0,1% de ácido fórmico em água com um gradiente detalhadas Complementar Figura S2A. Um modo de detecção positivo foi aplicado para a transição 198 > 105 da IS, obtida com uma tensão capilar de 40 V e uma energia de colisão de 16 V, enquanto 475 > 100 da para Sild com tensão capilar de 40 V e uma energia de colisão de 22,5 V, respectivamente. Os cromatogramas representativos do IS e do Sild em amostras reais são indicados na figura suplementar S2B.
Análise Estatística
parâmetros Farmacocinéticos (PK), tais como a máxima concentração sérica (Cmax), tempo máximo de concentração sérica (tmax), e a área sob a curva (AUC) em diferentes pontos de tempo, foram calculados com rotinas específicas de aplicativos com o GraphPad software (La Jolla, CA, Estados Unidos). A análise estatística dos dados foi realizada com SPSS 21.0 para Windows (SPSS, Chicago, IL, Estados Unidos). O teste de Kolmogorov-Smirnov foi usado para verificar a normalidade da distribuição. Variáveis que não mostram distribuição normal foram transformadas de log. As características basais dos doentes, PKs e dados de experiências in vitro foram comparados com os testes T do estudante não emparelhados com correcção Bonferroni-Holm para comparações múltiplas. Foram realizadas medições repetidas de ANOVA para testar diferenças na libertação do fármaco e na concentração sérica de Sild. O teste de Levene foi usado para testar a homogeneidade da variância entre os grupos. Se a homogeneidade do pressuposto de variância foi violada, foi realizado o teste Welch e o respectivo valor-P foi reportado. A proporção de ADR foi comparada com o ensaio EXACTO χ2. Valores de P < 0.5 foram considerados estatisticamente significativos.
Resultados
Análise In Vitro da Liberação/Permeação de Sildenafil, a partir das Diferentes Formulações de medicamentos
A dinâmica de liberação e permeação de Sild das três formulações de medicamentos foi anteriormente investigados in vitro (Figura 2). O tempo necessário para completar a desagregação das FCT, ODT e ODF foi avaliado através de um ensaio-padrão descrito na Farmacopeia Europeia (2016; figura 2A). O ODF mostrou o tempo mais elevado de desagregação em comparação com tanto FCT como ODT (respectivamente, P = 0, 017 E P = 0, 008).
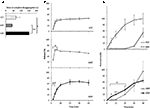
FIGURA 2. Avaliação In vitro das propriedades bio-tecnológicas de FCTs, ODTs e andODFs contendo 50 mg de Sild. Os resultados são representativos de três experiências independentes e comunicados como valores médios ± desvio-padrão. A) resultados do teste de desagregação, indicando o tempo (em segundos) até à desagregação completa da formulação. Significado: ∗P < 0, 05 e and p < 0, 01 entre as formulações indicadas. B) resultados do teste de dissolução, indicando a quantidade de Sild libertada por cada formulação em percentagem da dose do medicamento. Significado: aP < 0, 01 vs. FCT; bP < 0, 001 vs. ODT. (C) Resultados da permeação de teste (detalhado na seção “Materiais e Métodos”) relatar a quantidade de Sild permeado através de uma membrana de acetato de celulose, como percentagem do valor mais alto alcançado por 50 mg de puro Sild em pó (linha descontínua no painel superior). Significado: ∗P < 0, 05 vs. ODT;. P < 0, 01 vs. ODT; ap < 0, 01 vs. FCT.
a fim de avaliar a influência desta evidência na libertação do fármaco a partir da formulação, foi realizado um teste padrão de dissolução (Farmacopeia Europeia, 2016; figura 2B). Em comparação com a formulação de referência FCT, a ODT mostrou uma libertação mais rápida do fármaco cuja extensão máxima foi alcançada mesmo após apenas 2 minutos do início do teste (P = 0, 006 vs. FCT). Por outro lado, a percentagem do fármaco libertado a partir do ODF nos primeiros 4 minutos do ensaio foi mais baixa em comparação com tanto FCT como ODT (respectivamente, P = 0, 004 e P < 0, 001). Em particular, a ODF mostrou uma libertação mais progressiva da droga em comparação com a FCT, alcançando a extensão máxima após 20 minutos do início do teste.Nesta base, a permeação trans-mucosa do Sild de cada formulação foi avaliada por um dispositivo especificamente desenvolvido (figura 2C). Para efeitos de referência, o citrato de Silda puro, utilizado num peso equivalente a 50 mg de Sild, foi avaliado para permeação trans-mucosa e mostrou difusão livre e rápida entre as duas câmaras. Um perfil quase oposto foi observado para FCT, mostrando uma permeação negligenciável até 30 minutos do início do teste. Os perfis de permeação de ODT e ODF mostraram um comportamento intermediário em comparação com as duas condições anteriores. Nos primeiros 20 min de ensaio, ODF mostrou significativamente mais alto grau de permeação em comparação a ODT (respectivamente, P = 0,033 em 5 min, P = 0,003 em 10 min, e P = 0,041, às 20 min). Diferentemente das FCT e ODT que foram completamente desagregadas na câmara de dadores, uma massa residual de geleia mole de ODF persistiu na membrana de acetato de celulose mesmo no final do ensaio (figura suplementar S2C).Farmacocinética diferencial do Sildenafil
vinte indivíduos do sexo masculino afectados pela DE psicogénica aceites para receber alternativamente FCT, ODT ou ODF, separados por uma semana de lavagem. Como detalhado na seção “materiais e métodos”, FCT foi engolido classicamente para permitir a administração clássica per os, enquanto ODT e ODF foram mantidos sob a língua por 15 minutos para promover a via sublingual. As características clínicas dos doentes estão descritas na Tabela 1. Os níveis séricos de Sild correspondentes às três condições posológicas são descritos na Figura 3. Uma variabilidade considerável caracterizou o perfil do soro medicamentoso das três formulações. Em comparação com a FCT, a ODT demonstrou um aparente aumento precoce dos níveis séricos de Sild; contudo, esta tendência não foi estatisticamente significativa. Por outro lado, observou-se uma diminuição mais rápida dos níveis de Sild a 120 e 240 minutos da dosagem para a formulação ODT (respectivamente, P = 0, 044 e P = 0, 024 vs. FCT).
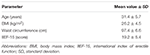
QUADRO 1. Características clínicas dos participantes no estudo (N = 20).
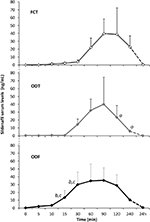
FIGURA 3. Avaliação In vivo dos níveis séricos de Sild, em 20 doentes afectados por ED psicogénica, a receber alternativamente o FCT per os, ou o ODT sublingual, ou o ODF sublingual conforme detalhado na secção “materiais e métodos.”Os dados são reportados como valores médios ± desvio padrão Significância: aP < 0,05 vs. FCT; bP < 0.01 vs. FCT; cP < 0,05 vs. ODT.
A droga soro perfil do ODF formulação mostrou um rápido aumento de Sild níveis comparados a FCT (P = 0,001 e P = 0,003) e a ODT (P = 0,048 e P = 0,041), respectivamente, em 15 e 30 min de dosagem. De acordo com o seu Lento tempo de desagregação in vitro (figura 2B), a curva média de concentração–tempo de ODF in vivo foi mais suave do que a de FCT e ODT (Figura 3).Os parâmetros farmacocinéticos das três formulações, obtidos a partir da análise dos níveis séricos de Sild, estão resumidos na Tabela 2. Apesar de não haver nenhuma diferença significativa foi observada entre as três formulações em termos de Cmax, tmax, e AUC0-240 min, ODF mostrou o menor valor de Cmax (de 38,2 ± 23.7 ng/ml), e a menor tmax (70.0 ± 24.5 min). Em particular, o ODF apresentou um valor significativamente mais elevado da AUC0-60 min em comparação com tanto FCT como ODT (respectivamente, P = 0, 005 e P = 0.43), resultando num aumento da biodisponibilidade relativa do Sild na primeira hora a partir da administração de ODF através da via sublingual.

QUADRO 2. Parâmetros farmacocinéticos das formulações de sildenafil.As reacções adversas medicamentosas
os resultados obtidos a partir do questionário auto-administrado sobre o tipo e características de RAL experimentados pelos participantes do estudo estão resumidos na Tabela 3. Entre os ADR conhecidos relatados para Sild (Taylor et al., 2009), os mais freqüentemente registrados foram dor de cabeça, rubor e congestão nasal. Um doente relatou dor muscular de baixo grau (grau 1 na escala de avaliação subjectiva) após a administração de FCT. Nenhum dos pacientes relatou visão alterada, taquicardia, fraqueza ou audição alterada.

QUADRO 3. Reacções adversas medicamentosas registadas pelos participantes no estudo (N = 20).
em comparação com a FCT como formulação de referência, a ODT demonstrou uma prevalência não controlada de ADR. No entanto, a percepção pessoal da intensidade do rubor foi significativamente menor (P = 0, 031). Por outro lado, ODF mostrou uma prevalência reduzida de dor de cabeça em comparação com FCT (P = 0, 043). Além disso, a duração e a intensidade de lavagem e congestão nasal foram percebidas em níveis mais baixos em comparação com a FCT (respectivamente, P = 0,011 e P = 0,015) e a ODT (respectivamente, P = 0,026 e P = 0,037).
discussão
neste estudo, fornecemos provas de que a via sublingual da Administração de Sild associa um aumento da biodisponibilidade precoce do fármaco e um perfil de tolerabilidade melhorado. Esta evidência é corroborada por ambas as investigações in vitro, mostrando que a formulação Sild é caracterizada por um tempo mais longo para a desagregação, mas favoreceu significativamente a absorção trans-mucosa, e evidências in vivo.Os inibidores da fosfodiesterase são a primeira opção terapêutica para o tratamento da ED; no entanto, os efeitos secundários experimentados pelos doentes são reconhecidos como a razão mais prevalente para a descontinuação da terapêutica (Corona et al., 2016). A alteração da farmacocinética através da concepção da formulação de novos fármacos pode representar uma estratégia atractiva para melhorar o perfil de segurança/eficácia do próprio fármaco (Mehrotra et al., 2007). A este respeito, a expiração de 2013 da patente sobre citrato de Sild em vários países europeus permitiu a oportunidade de liberar uma série de novas formulações de Sild. Note-se que a maioria das formulações Sild actualmente disponíveis no mercado são efectivamente aprovadas como formas bioequivalentes da FCT original (Leoni et al., 2013). Curiosamente, formulações de desintegração oral, caracterizadas por Desagregação rápida na boca do paciente sem a necessidade de engolir com água, foram desenvolvidas (Goel et al., 2008). Estas novas formulações encontram uma melhor conformidade nas populações de pacientes com dificuldade em engolir dosagens sólidas convencionais, tais como crianças, pacientes geriátricos e pacientes disfágicos. Além disso, ao proporcionar maior disponibilidade de drogas orais, as formulações de desintegração oral podem representar sistemas valorizados para favorecer a trans-mucosa, e em particular sub-lingual, absorção (Kathpalia e Gupte, 2013). Em especial, em Itália, duas formulações de desintegração oral de Sild estão oficialmente disponíveis em farmácia: os ODTs e os ODFs.
neste estudo, visamos avaliar as possíveis variações farmacocinéticas, e o padrão correspondente de ADR, decorrentes de favorecer a absorção trans-mucosa do Sild através da administração sub-lingual das duas formulações orais disponíveis desintegrando a droga. Os resultados foram comparados com a formulação original da Sild, nomeadamente a FCTs. Curiosamente, encontramos uma estreita correlação, tanto in vitro como in vitro, entre as propriedades bio-tecnológicas e as PKs das diferentes formulações. Em particular, apesar de uma dose igual do fármaco (50 mg) e de uma taxa ligeiramente reduzida de libertação do fármaco no teste de dissolução, o ODF caracterizou-se por um maior tempo de desagregação e maior taxa de permeação no modelo trans-mucoso, por um lado, e por um aumento da bio-disponibilidade do fármaco na primeira hora a partir da dosagem, por outro lado. Podemos então supor que a absorção de Sild sub-lingual é favorecida por um prolongado contacto droga-mucosa. Na verdade, este fenómeno é geralmente perseguido para as drogas trans-mucosas orais, onde se recomenda o uso de polímeros mucoadesivos para assegurar um período prolongado de contacto entre a formulação e a mucosa oral (Lam et al., 2014), em particular das drogas, como o Sild, afetadas pela baixa solubilidade na água (Zayed et al., 2012; Sun et al., 2014). Estes resultados preliminares também sugerem uma possível melhoria da eficácia clínica para esta classe de medicamentos em comparação com as formulações originais. São necessários mais estudos para clarificar estes aspectos.
a evidência mais marcante do presente estudo é uma redução significativa nas Rams da administração sub-lingual de ODF, em comparação com ODT e FCT administrados na mesma dosagem, o que, por sua vez, pode resultar no aumento da Conformidade dos doentes. Esta evidência pode ser interpretada à luz do princípio de que a incidência de um efeito secundário do fármaco aumenta através do aumento dos níveis séricos e do tempo de exposição ao próprio fármaco (Gupta et al., 2005; Taylor et al., 2009). Apesar de uma bio-disponibilidade global não comprovada em comparação com as outras formulações analisadas, a administração sub-lingual de ODF mostrou um valor mais baixo de Cmax e um tmax mais curto, resultando numa proporção significativamente maior de bio-disponível Sild na primeira hora após a administração. Assim, podemos especular que a administração sub-lingual de ODF combina uma absorção eficiente da droga com a obtenção de níveis séricos médios mais baixos de Sild e consequente menor risco de Rams. No entanto, reconhecemos o baixo tamanho da amostra como a principal desvantagem do estudo. É necessária uma investigação mais aprofundada sobre as coortes de maior dimensão e com doses diferentes para confirmar esta questão.
em conclusão, neste estudo relatamos que a administração sublingual de Sild ODF melhora o perfil de tolerabilidade ao fármaco através do envolvimento provável de uma farmacocinética modificada em comparação com o gerador FCTs. Embora ODF não tenha sido originalmente concebido para este fim, isso representa uma estratégia atraente para melhorar a conformidade do paciente com a terapia. Estamos a desenvolver mais estudos comparativos para avaliar a eficácia clínica em doentes psicogénicos e orgânicos.
contribuições dos autores
LDT e CF coordenaram o estudo e redigiram o manuscrito. O MDRP avaliou e incluiu os doentes. A EF realizou uma análise in vitro. A SDA realizou a análise sérica. O PR efectuou a comparação farmacocinética. RP, NR e AG revisaram criticamente e finalizaram o manuscrito.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Agradecimentos
agradecemos o Dr. Alberto Barosso, o Dr. Giuseppe Maggioni, e o Dr. Dimitri Portale para pacientes de aconselhamento, Dr. Flavia Rosano e Dr. Alice Passadore para pacientes de gestão, e de toda a equipe da Unidade de Andrologia e Medicina Reprodutiva.
Material Suplementar
O Material Suplementar para este artigo podem ser encontradas online em: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
FIGURA S1 | imagens Representativas do Comprimido de Desintegração Testador (A) e a Dissolução Aparelhos (B) usado para a desagregação de teste e ensaio de dissolução, respectivamente.
FIGURE S2 |(a) Details of the mobile phase gradient used for the high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) analysis of serum levels of sildenafil (Sild). São comunicados cromatogramas representativos e espectros de massa de ambos os Sild ao padrão interno de benzanilida em amostras reais (B). C) imagem representativa da película residual orodispersível (destacada por uma linha descontínua), que persista após o ensaio de permeação no dispositivo utilizado para a estimativa in vitro da absorção trans-mucosa através de uma membrana de acetato de celulose.
DATA SHEET S1 / Adverse drug reaction questionnaire.
Nota de rodapé
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L., and Anderson, R. U. (2007). Integrated sildenafil and cognitive-behavior sex therapy for psychogenic erectile dysfunction: a pilot study. J. Sexo. Med. 4, 1117–1125. doi: 10.1111 / J. 1743-6109. 2007. 00535.X
PubMed Abstract / CrossRef Full Text | Google Scholar
Bischoff, E. (2004). Actividade, selectividade e consequências da não selectividade da inibição da PDE. T. J. Impot. Res. Suppl. 1, S11-S14. doi: 10.1038 / sj.ijir.3901208
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Boolell, M., Allen, M. J. Ballard, S. A., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Sildenafil: um inibidor específico da fosfodiesterase cíclica de tipo 5, activo por via oral, para o tratamento da disfunção eréctil do pénis. T. J. Impot. Res. 8, 47-52.
PubMed Resumo | Google acadêmico
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). Reinício das erecções espontâneas em doentes seleccionados afectados pela disfunção eréctil e vários graus de alteração da parede carótida: papel do tadalafil. Euro. Urol. 48, 326–331. doi: 10.1016 / j. eururo.2005.01.013
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A., e Florestaa, C. (2009). Espessura da artéria cavernosa do meio: um novo parâmetro no diagnóstico da disfunção eréctil vascular. J. Sexo. Med. 6, 1117–1126. doi: 10.1111 / J. 1743-6109. 2008. 01112.X
PubMed Abstract / CrossRef Full Text | Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J., and Forjaz, V. (2012). Gota no tratamento da disfunção eréctil com PDE5: um estudo sobre preditores e uma análise qualitativa das razões para a descontinuação. J. Sexo. Med. 9, 2361–2369. doi: 10.1111 / J. 1743-6109. 2012. 02787.X
PubMed Abstract / CrossRef Full Text | Google Scholar
Center for Drug Evaluation and Research (2003). Nda 021400 Levitra (cloridrato de Vardenafil) comprimidos: Clinical Pharmacology/ Biopharmaceutics Review. Rockville, Md: Department of Health and Human Services. Silver Spring, MD: Food and Drug Administration.
Google acadêmico
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Largada de inibidores da fosfodiesterase de primeira geração: uma revisão abrangente e meta-análise. Andrology 4, 1002-1009. doi: 10.1111/andr.12255
PubMed Abstract / CrossRef Full Text | Google Scholar
Delvadia, P. R., Barr, W. H., and Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). European Directorate for the Quality of Medicines &HealthCare( EDQM), 9th Edn. Estrasburgo: Conselho da Europa.
Google Scholar
Fejős, I., Neumajer, G., Béni, S., and Jankovics, P. (2014). Análise qualitativa e quantitativa dos inibidores da PDE-5 em medicamentos contrafeitos e suplementos dietéticos por HPLC-UV utilizando sildenafil como única referência. J. Pharm. Biomed. Anal. 98, 327–333. doi: 10.1016 / j. jpba.2014.06.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Goel, H., Rai, P., Rana, V., and Tiwary, A. K. (2008). Sistemas de desintegração oral: inovações na formulação e Tecnologia. Pat Recente. Farmácia. Formul. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Texto Completo | Google acadêmico
Gupta, M., Kovar, A., e Meibohm, B. (2005). Farmacocinética clínica dos inibidores da fosfodiesterase-5 para a disfunção eréctil. J. Clin. Farmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Associação Europeia de Urologia. Orientações sobre a disfunção sexual masculina: disfunção eréctil e ejaculação precoce. Euro. Urol. 57, 804–814. doi: 10.1016 / j. eururo.2010.02.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Hawksworth, D. J., and Burnett, A. L. (2015). Tratamento farmacoterapêutico da disfunção eréctil. Clin. Farmacol. Ther. 98, 602–610. doi: 10.1002/cpt.261
PubMed Abstract / CrossRef Full Text | Google Scholar
Heinig, R., Weimann, B., Dietrich, H., and Böttcher, M. F. (2011). Farmacocinética de uma nova formulação de comprimidos orodispersíveis de vardenafil: resultados de três ensaios clínicos. Clin. Investigo Drogas. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Kathpalia, H., e Gupte, A. (2013). An introduction to fast dissolving oral thin film delivery systems: a review. Moeda. Farmácia. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed Abstract | CrossRef Full Text | Google Scholar
Lam, J. K., Xu, Y., Worsley, A., and Wong, I. C. (2014). Administração oral de medicamentos transmucosais para uso pediátrico. Adv. Drug Deliv. Rev. 73, 50-62. doi: 10.1016 / j. addr.2013.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B. ,and Rodrigues, B. (2013). Sildenafil: duas décadas de benefícios ou riscos? Idade Masculino 16, 85-91. doi: 10.3109 / 13685538.2013.801952
PubMed Resumo | CrossRef Texto Completo | Google acadêmico
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). A disfunção da qualidade do sémen está associada à disfunção sexual de acordo com a sua gravidade. Cantarolar. Reprovação. 31, 2668–2680. doi: 10.1093/humrep / dew246
PubMed Abstract / CrossRef Full Text | Google Scholar
Ludwig, W., and Phillips, M. (2014). Causas orgânicas da disfunção eréctil em homens com menos de 40 anos. Urol. T. 92, 1–6. doi: 10.1159/000354931
PubMed Abstract | CrossRef Full Text | Google Scholar
Lugnier, C. (2006). Superfamília de nucleótidos cíclicos fosfodiesterase (PDE): um novo alvo para o desenvolvimento de agentes terapêuticos específicos. Farmacol. Ther. 109, 366–398. doi: 10.1016 / j. pharmthera.2005.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Mehrotra, N., Gupta, M., Kovar, A., and Meibohm, B. (2007). O papel da farmacocinética e farmacodinâmica na terapêutica com inibidores da fosfodiesterase-5. T. J. Impot. Res. 19, 253-264. doi: 10.1038 / sj.ijir.3901522
PubMed Abstract | CrossRef Full Text | Google Scholar
Munoz, M., Bancroft, J., and Marshall, I. (1993). O desempenho do Rigiscan na medição da tumescência peniana e rigidez. T. J. Impot. Res. 5, 69-76.
Google Scholar
Porst, H., Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S., et al. (2013). O ISSM Standards Committee for Sexual Medicine. Tratamento conservador (médico e mecânico) da disfunção eréctil. J. Sexo. Med. 10, 130–171. doi: 10.1111 / jsm.12023
PubMed Abstract / CrossRef Full Text | Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Aumento da absorção oral e efeito terapêutico da acetilpuerarina à base de nanoemulsões de succinato de D-α-tocoferil polietilenoglicol 1000. T. J. Nanomedicina 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, J., Baldo, O. B., Storey, A., Cartledge, J., and Eardley, I. (2009). Diferenças na duração do efeito secundário e níveis de perturbação associados entre os inibidores da fosfodiesterase tipo 5. BJU Int. 103, 1392–1395. doi: 10.1111 / J. 1464-410X. 2008. 08328.X
PubMed Abstract / CrossRef Full Text | Google Scholar
Zayed, R., Kamel, A. O., Shukr, M., and El-Shamy, A. H. (2012). Um estudo comparativo in vitro e in vivo de dispersões sólidas directamente comprimidas e comprimidos sublinguais de citrato de sildenafil liofilizado, para o tratamento da hipertensão arterial pulmonar. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar