a adição de uma porção de hidratos de carbono a uma molécula de proteína é referida como glicosilação proteica. É uma modificação pós-translacional comum para moléculas proteicas envolvidas na formação da membrana celular. Durante este processo,a ligação das unidades monossacáridas às cadeias de aminoácidos prepara o palco para uma série de reacções enzimáticas que levam à formação de glicoproteínas (oligossacáridos ligados n e o que se encontram numa entidade proteica). Em todas as 16 enzimas conhecidas é suposto mediar esta reacção. Uma glicoproteína típica tem pelo menos 41 ligações que envolvem 8 aminoácidos e 13 unidades monossacáridas diferentes e inclui as ligações glicofosfatidilinositol (GPI) e fosfoglicosil. A glicosilação proteica ajuda a dobrar adequadamente as proteínas, a estabilidade e a adesão das células às células normalmente necessárias pelas células do sistema imunitário. Os principais locais de glicosilação proteica no corpo são ER, corpo Golgi, núcleo e o fluido celular.
a glicosilação proteica pode ser categorizada em dois tipos principais:
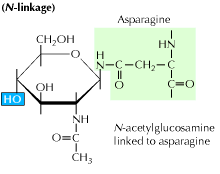 a) n-linked glycosylation: It begins with the addition of a 14-sugar precursor to an asparagine amino acid. Contém moléculas de glucose, manose e N-acetilglucosamina. Esta entidade é então transferida para o lumen ER. A enzima oligossacaril transferase liga a cadeia de oligossacarídeos à asparagina que ocorre na sequência de tripéptidos, Asn-X-Ser ou Asn-X-Thr. X pode ser qualquer aminoácido além da prolina. A sequência proteica ligada aos oligossacarídeos dobra-se agora correctamente e é agora translocada para o corpo de Golgi, onde o resíduo de manose é removido.
a) n-linked glycosylation: It begins with the addition of a 14-sugar precursor to an asparagine amino acid. Contém moléculas de glucose, manose e N-acetilglucosamina. Esta entidade é então transferida para o lumen ER. A enzima oligossacaril transferase liga a cadeia de oligossacarídeos à asparagina que ocorre na sequência de tripéptidos, Asn-X-Ser ou Asn-X-Thr. X pode ser qualquer aminoácido além da prolina. A sequência proteica ligada aos oligossacarídeos dobra-se agora correctamente e é agora translocada para o corpo de Golgi, onde o resíduo de manose é removido.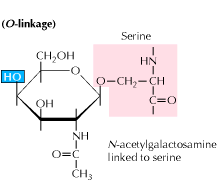
B) glicosilação O-ligada: a glicosilação começa com uma adição enzimática de N-acetil-galactosamina seguida de outros hidratos de carbono aos resíduos de serina ou de treonina. Estudos revelam que a glicosilação ligada ao o ocorre em uma fase posterior no processamento de proteínas.