introdução
tecidos, células e estruturas menores dentro das células (organelas) são principalmente água e são, portanto, transparentes. Imaging tiny see-through bags of water results in images that don’t contain a lot of information, and in microscopy, it is vital to have some sort of contrast or stain that will give areas of the sample color and make them far easier to see. Além disso, e se você só quiser imaginar algumas das estruturas menores dentro de uma célula, como um núcleo ou uma membrana celular? Colorir a célula inteira tornaria impossível localizar as áreas em que você está interessado.
fluorescência resolve ambos os problemas de contraste e localização. Fluorescência é onde um objecto emite luz depois de absorver luz. Muitos objetos diferentes exibem fluorescência, tais como minerais (a palavra fluorescência proveniente do mineral fluorite), peixes de profundidade (a mais famosa é a Medusa Aequorea victoria, a partir da qual a proteína fluorescente verde (GFP) foi descoberta), plantas, produtos químicos e muito mais.
moléculas fluorescentes (conhecidas como fluoróforos) são usadas para rotular amostras, e fluoróforos estão disponíveis que emitem luz em praticamente qualquer cor. Em um microscópio fluorescente, uma amostra é rotulada com um fluoróforo, e então uma luz brilhante (luz de excitação) é usada para iluminar a amostra, o que dá fluorescência (luz de emissão). Desta forma, as amostras são altamente contrastadas com o fundo preto como o fluoróforo emite uma luz colorida brilhante. Ao localizar esses fluoróforos para a área de interesse, uma imagem clara de qualquer parte de uma célula pode ser tomada, tornando a microscopia de fluorescência uma ferramenta poderosa para as ciências da vida.
Brightfield vs Imagens de Fluorescência
Em brightfield microscopia, a amostra é iluminada com luz branca transmitida. Isto cria uma iluminação uniforme da amostra sob o microscópio para observar amostras altamente contrastadas, manchadas ou naturalmente pigmentadas. No entanto, brightfield não é suficiente para distinguir entre células transparentes / translúcidas, não encadeadas ou estruturas celulares para estudar processos de interesse.
a microscopia de fluorescência baseia-se no uso de fluoróforos, moléculas que emitem luz de um comprimento de onda visível específico quando expostas à luz de um comprimento de onda diferente. Quando estes fluoróforos estão ligados a uma estrutura de interesse específica, fótons emitidos a partir do fluoróforo podem ser usados para visualizar esta estrutura de interesse. O benefício da microscopia de fluorescência é que as estruturas visadas são iluminadas, enquanto as áreas indesejáveis da amostra têm pouca ou nenhuma fluorescência, permitindo um alvo fácil e imagens.
Why Molecules Fluoresce
The origin of fluorescence is electrons moving freely around the active fluorophore and releasing absorbed energy, as seen in Fig.2.
antes da excitação, os elétrons estão no estado de menor energia disponível para eles – o estado do solo (S0). Quando um elétron é atingido com um fóton de uma determinada gama de energia, o elétron absorve a energia do fóton e salta para um estado de energia superior (S1, S2, ou S3). Para retornar ao estado do solo (S0), o elétron libera a energia adicional como a emissão de um fóton. A energia deste fóton é menor que a energia de excitação, por isso tem um comprimento de onda mais longo. É por isso que a luz de emissão tem um comprimento de onda maior do que a luz de excitação e pode aparecer como uma cor diferente.
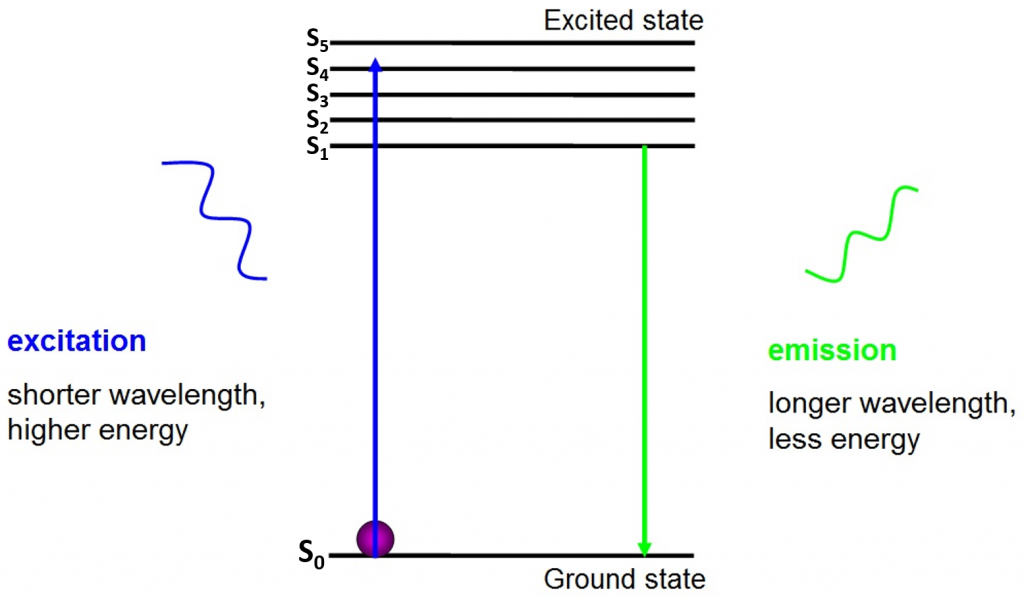
o fóton emitido é geralmente no espectro visível e pode ser visto sob um microscópio se houver fluoróforos excitados o suficiente. O comprimento de onda do fóton libertado é específico para cada fluoróforo e esta previsibilidade permite uma imagem fácil de fluorescência.
factores de intensidade de fluorescência
embora os fluoróforos possam emitir fluorescência de um comprimento de onda previsível, é também importante saber quais os factores que controlam a intensidade de fluorescência. Sem uma intensa emissão de luz, a fluorescência não será detectável com um microscópio.
Quantum Yield
the quantum yield (ϕ) of a fluorophore is the ratio of the number of released photons to the number of absorbed photons. The quantum yield is often expressed as a value from 0-1, which 1 being 100% efficiency of photon conversion. Também é importante notar que cada fluoróforo tem um pH único, força iônica e temperatura para uma eficiência de fluorescência ideal.
coeficiente de Extinção
cada fluoróforo tem uma capacidade diferente para absorver fótons, mesmo que estejam dentro de uma faixa de comprimento de onda apropriada para excitá-lo. Se um fluoróforo é exposto a um fóton correspondente adequadamente ao seu comprimento de onda de excitação, a probabilidade de que um fóton será absorvido é uma característica mensurável e conhecida como o coeficiente de extinção (ε).
um coeficiente quântico de rendimento e extinção de fluoróforos é frequentemente apresentado em conjunto para descrever o quão brilhante o fluoróforo é mostrado em contextos experimentais.
vida de fluorescência
quando um electrão fluoróforo absorve um fóton, não liberta imediatamente um fóton de comprimento de onda mais longo. A liberação de alguma energia entre estados de energia excitada é conhecida por levar diferentes comprimentos de tempo. A quantidade de tempo que um elétron passa no estado excitado antes de liberar um fóton e retornar ao estado do solo é uma medição de sua vida de fluorescência. O tempo de vida de cada fluoróforo é único e pode ser medido experimentalmente. Ao usar corantes fluorescentes experimentalmente, é útil para a sua vida útil, especialmente para aplicações que requerem alta velocidade, tais como neurônios de imagem de cálcio.
intensidade do comprimento de onda de excitação
a maioria das configurações de microscopia fluorescente incluem uma fonte de luz que pode ser sintonizada para a saída da faixa de comprimento de onda desejada. Muitas fontes de luz fluorescente também podem ser ajustadas para intensidade de excitação para aumentar o número de fótons que se movem através do caminho da luz. Em uma amostra marcada fluorescentemente que é exposta ao seu comprimento de onda de excitação, cada fluoróforo não será ativado ao mesmo tempo. Ao aumentar a intensidade de excitação e aumentar o número de fótons que chegam à amostra, há uma maior probabilidade de que mais fluoróforos serão excitados. Fotoestabilidade é a capacidade de uma molécula ou organismo resistir a danos. Em microscopia de fluorescência, os fluoróforos irão eventualmente parar de absorver fótons que se aproximam e entrar em um estado escuro permanente. Como um organismo reúne mais fluoróforos no estado escuro, a aparência do alvo rotulado reduz, e a amostra é dita ser fotobleaching. Em microscopia de fluorescência, muitas vezes são tomadas medidas para reduzir a quantidade de fotobleaching experimentada durante a experimentação. Algumas medidas incluem uma redução na intensidade da luz interagindo com a amostra e o uso de corantes fluorescentes especializados que não permanecem ativos por tanto tempo como outros corantes.
Microscopia de Fluorescência
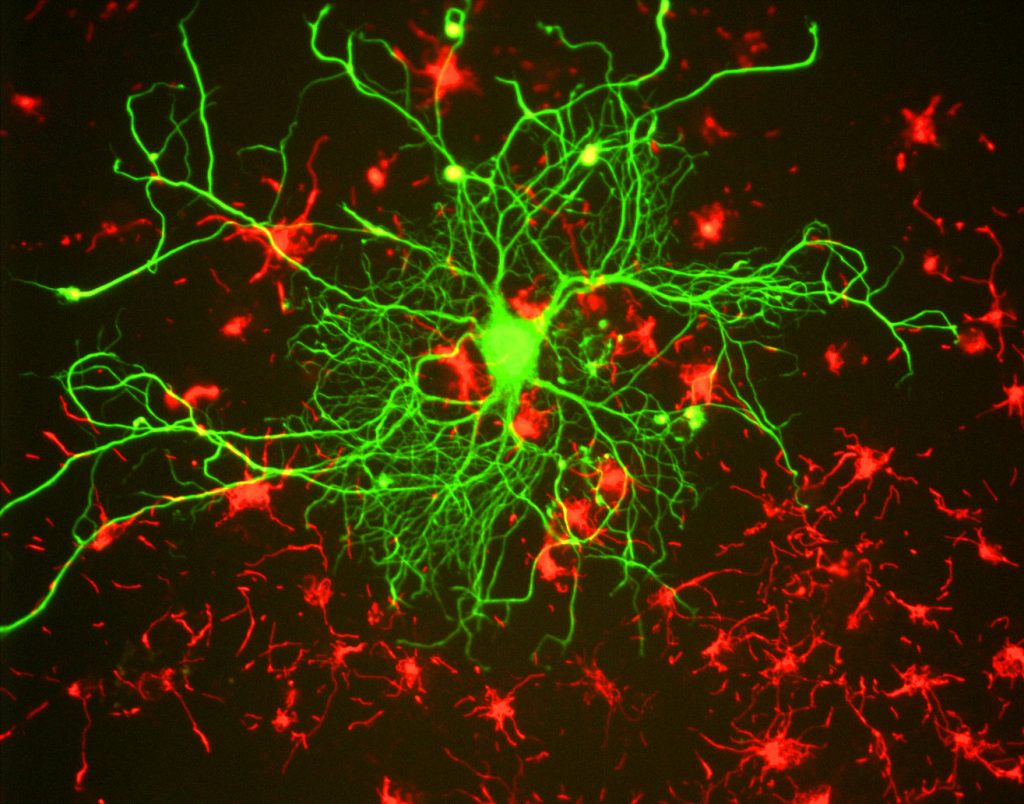
Para os pesquisadores, o principal benefício da fluorescência é a capacidade de usar a microscopia de fluorescência, onde as amostras são rotulados/manchado com uma substância fluorescente, tais como corantes, anticorpos ou proteínas, permitindo que imagens de contraste. Ao direcionar essas etiquetas fluorescentes, os pesquisadores podem selecionar o que eles querem ver. Isto é demonstrado na Fig.3, onde um neurônio pode ser visto claramente entre astrócitos, como eles são rotulados com cores diferentes de marcador fluorescente.
em geral, para microscopia de fluorescência, uma amostra é rotulada com marcadores fluorescentes (tipicamente específicos para certas partes da amostra). A amostra é então iluminada com o comprimento de onda de excitação específico para o fluoróforo, e a fluorescência resultante é recebida pelo detector, geralmente uma câmara científica sensível.
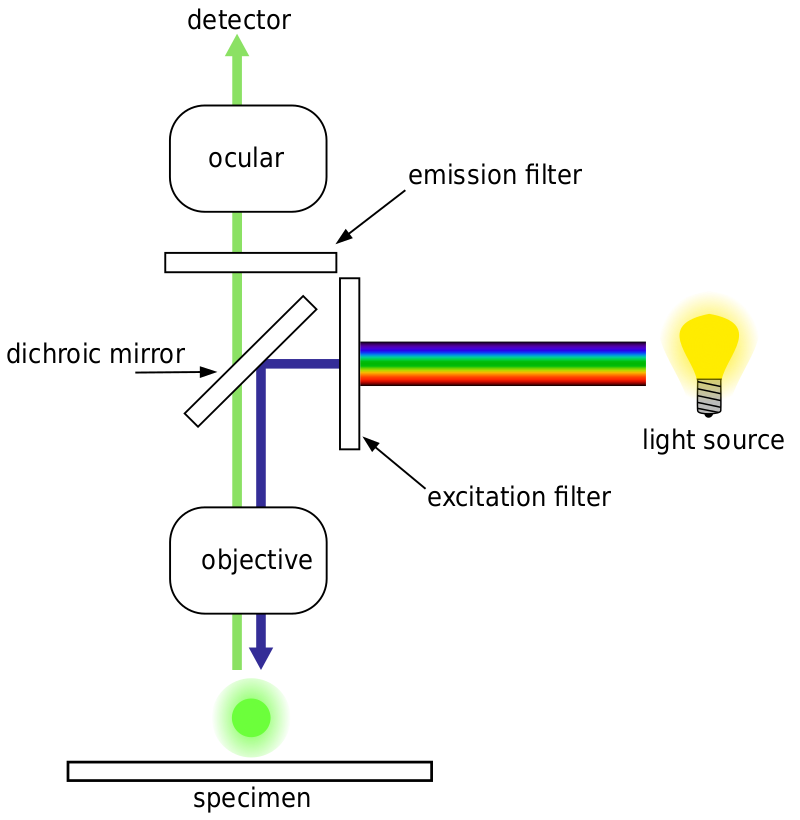
a maioria dos microscópios de fluorescência são microscópios de epifluorescência, onde a excitação e a emissão são feitas através do mesmo caminho de luz. Tanto a iluminação de excitação como a fluorescência emitida passam através do objetivo do microscópio e geralmente são filtradas a fim de apenas detectar a fluorescência. Esta configuração é mostrada na Fig.4.
autofluorescência
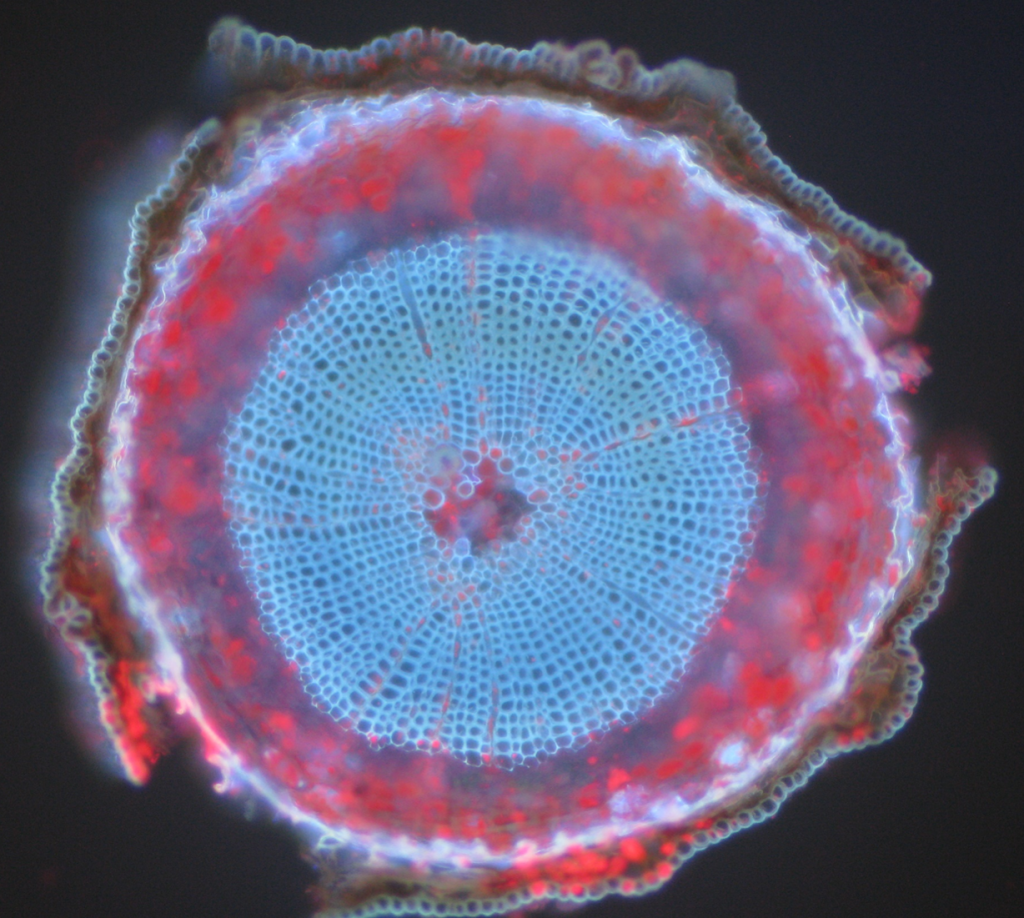
algumas estruturas, organismos biológicos e amostras de microscopia geral podem apresentar fluorescência natural, conhecida como autofluorescência. Isto é diferente da fluorescência de amostras rotuladas, mas muitas vezes compartilha comprimentos de onda semelhantes, o que significa que as amostras de microscopia de autofluorescência podem obscurecer a fluorescência adicionada artificialmente e interferir com a detecção, reduzindo o sinal. É importante saber se suas amostras exibem autofluorescência, pois isso afetará qualquer imagem de fluorescência feita a menos que comprimentos de onda específicos são usados para evitá-lo.
exemplos comuns de objetos autofluorescentes são mitocôndria, lisossomas, colagénio e alguns aminoácidos como triptofano, tirosina e fenilalanina. Mais notavelmente, a autofluorescência é comum em plantas devido ao seu uso de clorofila e outras moléculas fluorescentes como ligninas e carotenos. Figo.5 mostra as diferentes cores da auto-fluorescência a partir de uma amostra de pinho sem marca.
resumo
desde a introdução do primeiro corante fluorescente, a microscopia de fluorescência tem sido utilizada para visualizar células e estruturas celulares com maior especificidade do que as técnicas tradicionais de microscopia de campo brilhante. Os investigadores podem planificar a estrutura, as propriedades ópticas e as experiências de influência de sonda de interesse para obter dados relevantes. Esta flexibilidade permitiu que a microscopia de fluorescência fosse incluída em muitas experiências de Ciências da vida.
dependendo do tipo de amostra e do fluoróforo, uma câmara científica deve ser cuidadosamente seleccionada para obter os melhores resultados de imagiologia.Microscopia Luminosa . (2009) Nature Milestones. MacMillan Publishers Limited, 6-22.