 |
|
a Maioria das reações em meio aquoso envolvem íons. No entanto, quando uma reação ocorre dois tipos de íons geralmente emergem: (1) íons “espectador” e (2) íons “jogador”. Os nomes implicam o caráter dos íons em relação à reação. Os íons do Jogador estão diretamente na reação, enquanto os íons espectadores cumprem o papel dos espectadores e sua função principal é manter a neutralidade elétrica na solução. Considere a reação de precipitação que ocorre quando soluções aquosas de cloreto de sódio e nitrato de prata são misturados. Um precipitado branco de AgCl forma-se. A equação química para esta reação é escrita como:
esta equação contém todos os íons na solução. No entanto, às vezes é necessário incluir apenas aqueles íons que são jogadores e deixar de fora os espectadores. Uma equação química que contém apenas os iões do jogador é chamada de equação iônica líquida (nie). Para obter o nie (1) anotar todos os compostos solúveis como íons e (2) eliminar íons comuns aos reagentes e produtos. A equação química resultante é então a nie. Para que a equação acima temos: (para o passo 2 mova o mouse sobre a reação)
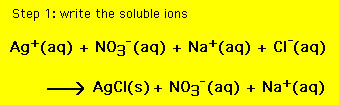
A equação resultante é o líquido iônico equação,
Enquanto os acima de reação é particularmente simples (i.e. todos os estequiométrica coeficientes são iguais a 1), Mais complexo nie é resultado de um procedimento semelhante. Por exemplo, se o nitrato de ferro(III) for misturado com sulfeto de amónio, obtém-se um precipitado amarelo de sulfeto de ferro(III). A nie para esta reação é: