pe lângă prelucrarea proteinelor, ER și Golgi se ocupă și de unele tipuri de transport de proteine. Veziculele (bule legate de membrană, în esență) se desprind de er, Golgi și alte organite membranoase, purtând cu ele orice molecule solubile erau în interiorul fluidului care a fost închis, precum și orice molecule încorporate în acea secțiune a membranei. Aceste vezicule prind apoi o plimbare pe un motor molecular, cum ar fi kinesina sau miozina, și călătoresc de-a lungul citoscheletului până când se fixează la destinația corespunzătoare și se fuzionează cu membrana țintă sau organelle. În general, veziculele se deplasează de la ER la cis Golgi, de la cis la Golgi medial, de la medial la trans Golgi și de la Trans Golgi La membrana plasmatică sau alte compartimente. Deși cea mai mare mișcare este în această direcție, există și vezicule care se deplasează înapoi de la Golgi La ER, purtând proteine care ar fi trebuit să rămână în ER (de ex. PDI) și au fost adunate accidental într-o veziculă.
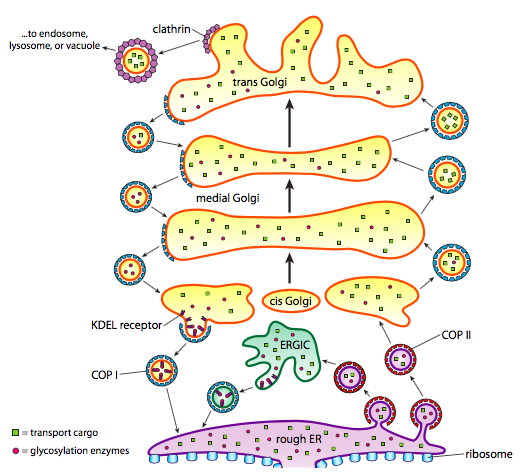
formarea veziculelor depinde de proteinele de acoperire care, în condiții adecvate, se vor auto-asambla în cuști sferice. Atunci când sunt asociate cu proteinele transmembranare, ele pot trage membrana atașată de-a lungul într-o formă sferică, de asemenea. Principalele tipuri de proteine de acoperire utilizate în formarea veziculelor sunt COPII, copii și clatrin.
proteinele coat COPII formează veziculele care se deplasează de la ER la Golgi. Proteinele COPI coat sunt utilizate între părți ale aparatului Golgi, precum și pentru a forma vezicule care merg de la Golgi înapoi la ER. În cele din urmă, clatrina este utilizată pentru a forma vezicule care părăsesc Golgi pentru membrana plasmatică, precum și pentru veziculele formate din membrana plasmatică pentru endocitoză.
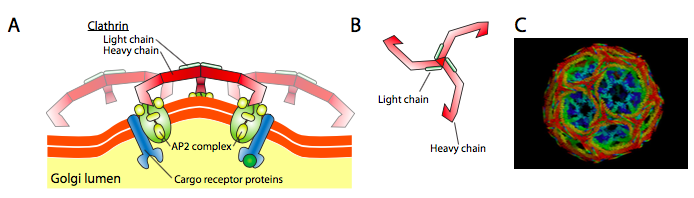
Clatrin (figura \(\PageIndex{17}\)) este cel mai bine descris dintre cele trei, iar straturile veziculare sunt realizate din aranjamente de triskelioni de clatrin (din greacă, adică cu trei picioare). Fiecare triskelion este compus din trei lanțuri grele Unite la capătul C și trei lanțuri ușoare, unul asociat cu fiecare lanț greu. Lanțurile grele ale diferitelor triskelioni interacționează de-a lungul „picioarelor” lanțului lor greu pentru a crea o construcție foarte robustă. Lanțurile ușoare nu sunt necesare pentru formarea veziculelor și se crede că ajută la prevenirea interacțiunilor accidentale ale moleculelor de clatrină din citoplasmă.
există o similitudine semnificativă între mecanismele de formare a veziculelor care utilizează aceste proteine de acoperire diferite, începând cu recrutarea arf1 (ARF reprezintă factorul de ribozilare ADP, care nu are nimic de-a face cu funcția sa aici) la membrană. Acest lucru necesită schimbul facilitat de Arno al unui GTP pentru PIB (Arno este deschizătorul sitului de legare a nucleotidelor ARF). Odată ce ARF1 a legat GTP, schimbarea conformațională relevă un N-terminal miristoil grup care se introduce în membrană. Atât copii, cât și veziculele acoperite cu clatrin folosesc arf1 și ARNO, dar copiii folosesc proteine similare numite Sar1p și Sec12p.
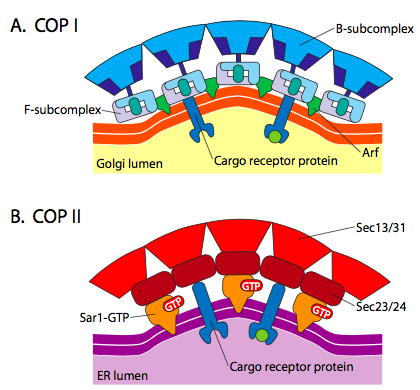
figura \(\PageIndex{18}\). Vezicule acoperite cu COP
arf1 (sau Sar1p) este utilizat pentru a recruta proteine adaptoare care se leagă de capătul „coada” proteinelor receptorului legat de membrană. Capătul de afaceri al acestor receptori se leagă de moleculele car-go care trebuie ambalate în veziculă. Proteinele adaptoare acționează ca legătura dintre membrană (prin receptori) și proteinele de acoperire. Pentru clatrin, proteinele adaptoare sunt AP1 pentru veziculele derivate trans-Golgi și AP2 pentru veziculele endocitare. Pentru COPI vezicule, aproximative omologi sunt β-, γ-, δ-, și ζ – Polițiști în timp ce COPII de sistem folosește Sec23p și Sec24p.
în cele din Urmă, adaptoare link-ul de la real strat de proteine: clathrin, α – sau ε – POLIȚIST, Sec13p și Sec31p. Ceea ce aceste proteine au în comun este faptul că în mod spontan (de exemplu, fără nicio cerință pentru cheltuielile cu energia), se auto-asamblează în structuri sferice asemănătoare cu cușca. Sub microscopul electronic, veziculele acoperite cu clatrin sunt definite mai clar, iar formele hexagonale și pentagonale delimitate de subunitățile clatrinei conferă veziculei un aspect de „minge de fotbal”. Veziculele acoperite cu COP coatamer sunt mult mai neclare în aparență sub EM.
toate cele trei tipuri de proteine de acoperire a veziculelor au capacitatea de a se asocia spontan într-o construcție sferică, dar numai vezicula acoperită cu copii și COPII „ciupește” spontan membrana pentru a elibera vezicula din membrana sa originară. Veziculele acoperite cu clatrin necesită un mecanism extern pentru eliberarea veziculei (figura \(\PageIndex{19}\)).
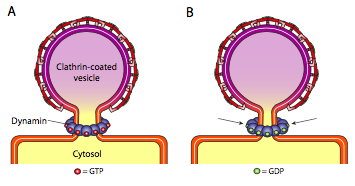
odată ce vezicula aproape s-a terminat, există încă un mic tulpină sau gât de membrană care leagă vezicula de membrană. În jurul acestei tulpini, moleculele GTP dinamice se agregă într-o construcție inelară/spirală. Moleculele de dinamină sunt Gtpaze globulare care se contractă la hidroliza GTP. Când se asociază în jurul tulpinii veziculei, fiecare proteină dinamină se contractă, cu efectul combinat de a constrânge tulpina suficient încât membrana să se prindă împreună, sigilând și eliberând vezicula din membrana originară.
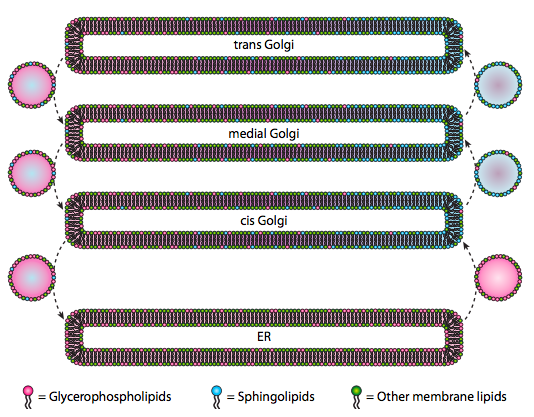
deși lipidele și membranele au fost discutate în capitolul 4, am neglijat să discutăm localizarea sintezelor lor în eucariote. După cum indică figura \(\PageIndex{20}\), sinteza anumitor tipuri de lipide este segregată și exclusivă. Glicerofosfolipidele se formează în principal în reticulul endoplasmatic, deși sunt produse și în mitocondrii și peroxizomi. În schimb, sfingolipidele nu sunt făcute în ER (deși precursorii lor de ceramidă sunt) la mamifere, enzimele necesare se găsesc în lumenul cis și Golgi medial. Există dovezi ale traficului vezicular anterograd și retrograd între diferitele compartimente Golgi și ER, ceea ce ar indica teoretic o redistribuire a tipurilor de lipide. Cu toate acestea, sfingolipidele tind să se agregeze în plute lipidice și par a fi mai concentrate în vezicule în mișcare anterogradă.
proteinele stratului se desprind la scurt timp după eliberarea veziculară. Pentru clatrin, procesul implică Hsc70, o ATPază. Cu toate acestea, pentru veziculele acoperite cu copii sau COPII, hidroliza GTP pe ARF/Sar1p pare să slăbească afinitatea proteinei stratului pentru adaptoare și inițiază neacoperirea. Activatorul GTPase este ARF GAP (sau Sec23p) și este o parte integrantă a stratului COP I (sau II).
veziculele poartă două categorii de încărcătură: proteine solubile și proteine transmembranare. Dintre proteinele solubile, unele sunt preluate în veziculă în virtutea legării de un receptor. Alte proteine se întâmplă să fie în apropiere și sunt adunate pe măsură ce vezicula se formează. Ocazional, este preluată o proteină care nu trebuia să fie; de exemplu, PDI poate fi închis într-o veziculă care se formează din ER. Are o funcție mică în Golgi și este necesară în ER, deci ce se întâmplă cu ea? Din fericire, PDI și multe alte proteine ER au o secvență de semnal C-terminal, KDEL (acid lizină-Aspartic-Acid Glutamic-leucină), care strigă „aparțin ER.”Această secvență este recunoscută de receptorii KDEL din interiorul Golgi, iar legarea proteinelor KDEL de receptori declanșează formarea veziculelor pentru a le trimite înapoi la ER.
veziculele secretoare au o problemă specială cu încărcătura solubilă. Dacă vezicula s-ar baza pur și simplu pe includerea proteinelor în ea în timpul procesului de formare, ar fi dificil să se obțină concentrații mari ale acestor proteine. Multe proteine secretate sunt necesare organismului rapid și în cantități semnificative, deci există un mecanism în Trans Golgi pentru agregarea proteinelor secretoare. Mecanismul utilizează proteine de agregare, cum ar fi secretogranina II și cromogranina B, care reunesc proteinele țintă în granule concentrate mari. Aceste granine funcționează cel mai bine în mediul trans Golgi cu pH scăzut și Ca2+ ridicat, astfel încât atunci când vezicula își eliberează conținutul în afara celulei, pH-ul mai mare și Ca2+ inferior separă agregatele pentru a elibera proteinele individuale.
există o schimbare constantă a pH-ului în timpul maturării Golgi, astfel încât, pe măsură ce trecem de la ER la Golgi, fiecare compartiment are un pH lumenal progresiv mai mic (mai acid).
în cele din urmă, există problema direcționării veziculelor. Veziculele sunt mult mai puțin utile dacă sunt aruncate pe un tren molecular de marfă și aruncate la întâmplare. Prin urmare, există un mecanism de andocare care necesită o potrivire a proteinei V-SNARE pe suprafața citoplasmatică a veziculei și a capcanei t pe suprafața citoplasmatică a membranei țintă. Fuziunea veziculei cu membrana are loc numai dacă există o potrivire. În caz contrar, vezicula nu poate fuziona și se va atașa la un alt motor molecular pentru a se îndrepta către o altă destinație, sperăm corectă. Acest proces este ajutat de legarea proteinelor care intră inițial în contact cu o veziculă care intră și o atrag suficient de aproape de țintă pentru a testa interacțiunea proteinei. Alte proteine de pe veziculă și membranele țintă interacționează apoi și, dacă capcanele se potrivesc, pot ajuta la „troliul” veziculei în membrana țintă, după care membranele fuzionează. O regulă importantă pentru înțelegerea fuziunii veziculare și, de asemenea, a direcționalității proteinelor și lipidelor membranare, este că partea citoplasmatică a unei membrane va fi întotdeauna orientată spre citoplasmă. Prin urmare, o proteină care se găsește în cele din urmă pe suprafața exterioară a membranei celulare va fi introdusă în suprafața lumenală a membranei ER pentru început.
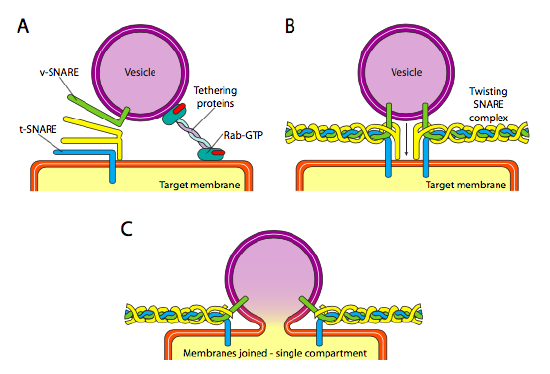
mai precis, pe măsură ce o veziculă se apropie de membrana țintă, proteina de legare Rab-GTP, care este legată de membrana țintă printr-o coadă lipidică dublă de geranilgeranil, se asociază vag cu vezicula și o ține în vecinătatea membranei țintă pentru a oferi capcanelor șansa de a funcționa. V-SNAREs și T-SNAREs au acum posibilitatea de a interacționa și de a testa pentru un meci. Recent, capcanele au fost redenumite R-SNAREs și, respectiv, Q-SNAREs, pe baza reziduurilor conservate de arginină și glutamină. În plus față de aceste două capcane primare, este implicată cel puțin o altă capcană, formând împreună un pachet de patru helice-uri (patru, nu trei, deoarece cel puțin în exemplul cel mai bine studiat, una dintre capcane este îndoită astfel încât două dintre domeniile sale alfa-elicoidale să participe la interacțiune. Cele patru spirale se înfășoară una în jurul celeilalte și se crede că, pe măsură ce fac acest lucru, trag vezicula și membrana țintă împreună.
toxina tetanică, tetanospasmina, care este eliberată de bacteriile Clostridium tetani, provoacă spasme acționând asupra celulelor nervoase și prevenind eliberarea neurotransmițătorilor. Mecanismul pentru aceasta este acela că scindează sinaptobrevina, o proteină capcană, astfel încât veziculele sinaptice nu se pot fuziona cu membrana celulară. Toxina botulinică, din Clostridium botulinum, acționează și asupra capcanelor pentru a preveni fuziunea veziculelor și eliberarea neurotransmițătorilor, deși vizează diferiți neuroni și are astfel efectul opus: tetanosul este cauzat de prevenirea eliberării neurotransmițătorilor inhibitori, în timp ce botulismul este cauzat de prevenirea eliberării neurotransmițătorilor excitatori.