obiective de învățare
- definiți sau descrieți următoarele:
- metabolism
- reacție catabolică
- reacție anabolică
- enzimă
- substrat
- apoenzima
- Haloenzima
- cofactor (coenzima)
- indicați modul în care enzimele sunt capabile să accelereze rata reacțiilor chimice.
- descrieți pe scurt o reacție generalizată enzimă-substrat, indicați funcția situsului activ al unei enzime și descrieți modul în care o enzimă este capabilă să accelereze reacțiile chimice.
- afirmă patru caracteristici ale enzimelor.
- indicați modul în care următoarele afectează viteza unei reacții enzimatice.
- concentrația enzimei
- concentrația substratului
- temperatura
- pH
- concentrația sării
- indicați modul în care substanțele chimice precum clorul, iodul, iodoforii, mercuriile și oxidul de etilenă inhibă sau ucid bacteriile.
- afirmă modul în care temperatura ridicată și temperatura scăzută își exercită efectul asupra bacteriilor.
pentru a trăi, a crește și a se reproduce, microorganismele suferă o varietate de modificări chimice. Ele modifică substanțele nutritive astfel încât să poată intra în celulă și le schimbă odată ce intră pentru a sintetiza părțile celulare și pentru a obține energie. Metabolismul se referă la toate reacțiile chimice organizate într-o celulă. Reacțiile în care compușii chimici sunt descompuși se numesc reacții catabolice, în timp ce reacțiile în care sunt sintetizați compușii chimici sunt denumite reacții anabolice. Toate aceste reacții sunt sub controlul enzimelor.

enzimele sunt substanțe prezente în celulă în cantități mici care funcționează pentru a accelera sau cataliza reacțiile chimice. Pe suprafața enzimei este de obicei o mică crevasă care funcționează ca un situs activ sau Sit catalitic de care unul sau două substraturi specifice sunt capabile să se lege. (Orice lucru cu care o enzimă se combină în mod normal se numește substrat.) Legarea substratului de enzimă determină enzima flexibilă să-și schimbe ușor forma printr-un proces numit potrivire indusă pentru a forma un intermediar tempore numit complex enzimă-substrat (figura \(\PageIndex{1}\)).
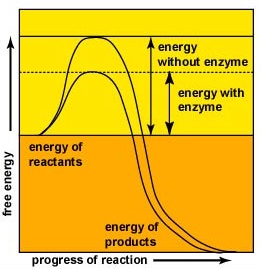
enzimele accelerează viteza reacțiilor chimice, deoarece reduc energia de activare, energia care trebuie furnizată pentru ca moleculele să reacționeze între ele (figura \(\PageIndex{2}\)). Enzimele reduc energia de activare prin formarea unui complex enzimă-substrat care permite formarea și eliberarea produselor reacției enzimatice (figura \(\PageIndex{3}\)).
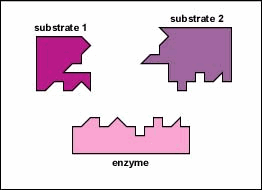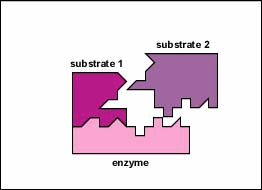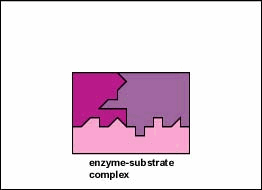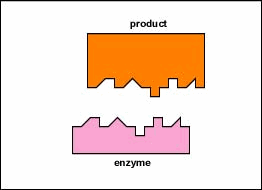
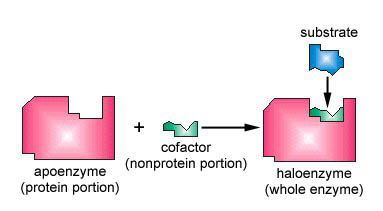
multe enzime necesită un cofactor nonprotein pentru a le ajuta în reacția lor. În acest caz, porțiunea proteică a enzimei, numită apoenzimă, se combină cu cofactorul pentru a forma întreaga enzimă sau haloenzima (figura \(\PageIndex{3}\)). Unii cofactori sunt ioni precum Ca++, Mg++ și K+; alți cofactori sunt molecule organice numite coenzime care servesc ca purtători pentru grupuri chimice sau electroni. NAD+, NADP+, FAD și coenzima A (CoA) sunt exemple de coenzime.
caracteristicile enzimelor
chimic, enzimele sunt în general proteine globulare. (Unele molecule de ARN numite ribozime pot fi, de asemenea, enzime. Acestea se găsesc de obicei în regiunea nucleară a celulelor și catalizează divizarea moleculelor de ARN). Enzimele sunt catalizatori care descompun sau sintetizează compuși chimici mai complexi. Acestea permit reacțiilor chimice să apară suficient de repede pentru a susține viața. Enzimele accelerează rata reacțiilor chimice, deoarece reduc energia de activare, energia care trebuie furnizată pentru ca moleculele să reacționeze între ele. Orice lucru cu care o enzimă se combină în mod normal se numește substrat. Enzimele sunt foarte eficiente. În general, o enzimă poate cataliza între 1 și 10.000 de molecule de substrat pe secundă. Enzimele sunt prezente numai în cantități mici în celulă, deoarece nu sunt modificate în timpul reacțiilor lor. și sunt foarte specifice pentru substratul lor. În general, există o enzimă specifică pentru fiecare reacție chimică specifică.
activitatea enzimatică
activitatea enzimatică este afectată de o serie de factori, inclusiv:
- concentrația enzimei: Presupunând că este disponibilă o concentrație suficientă de substrat, creșterea concentrației enzimei va crește viteza de reacție a enzimei.
- concentrația substratului: la o concentrație enzimatică constantă și la concentrații mai mici de substraturi, concentrația substratului este factorul limitativ. Pe măsură ce concentrația substratului crește, viteza de reacție a enzimei crește. Cu toate acestea, la concentrații foarte mari de substrat, enzimele devin saturate cu substrat și o concentrație mai mare de substrat nu crește viteza de reacție.
- temperatura: Fiecare enzimă are o temperatură optimă la care funcționează cel mai bine. O temperatură mai ridicată duce, în general, la o creștere a activității enzimei. Pe măsură ce temperatura crește, mișcarea moleculară crește, rezultând mai multe coliziuni moleculare. Dacă, totuși, temperatura crește peste un anumit punct, căldura va denatura enzima, determinând-o să-și piardă forma funcțională tridimensională prin denaturarea legăturilor sale de hidrogen. Temperatura rece, pe de altă parte, încetinește activitatea enzimei prin scăderea mișcării moleculare.
- pH-ul: Fiecare enzimă are un pH optim care ajută la menținerea formei sale tridimensionale. Modificările pH – ului pot denatura enzimele prin modificarea sarcinii enzimei. Aceasta modifică legăturile ionice ale enzimei care contribuie la forma sa funcțională.
- concentrația de sare: fiecare enzimă are o concentrație optimă de sare. Modificările concentrației de sare pot denatura, de asemenea, enzimele.
unele relații între enzimele bacteriene și utilizarea dezinfectanților și a temperaturilor extreme pentru a controla bacteriile.
- mulți dezinfectanți, cum ar fi clorul, iodul, iodoforii, mercurienii, azotatul de argint, formaldehida și oxidul de etilenă, inactivează enzimele bacteriene și astfel blochează metabolismul.
- temperaturi ridicate, cum ar fi autoclavarea, fierberea și pasteurizarea, denaturează proteinele și enzimele.
- temperaturile reci, cum ar fi refrigerarea și înghețarea, încetinesc sau opresc reacțiile enzimatice.
rezumat
- enzimele sunt substanțe prezente în celulă în cantități mici care funcționează pentru a accelera sau cataliza reacțiile chimice, astfel încât acestea să apară suficient de repede pentru a susține viața.
- pe suprafața enzimei este de obicei o crevasă mică care funcționează ca un situs activ sau situs catalitic de care unul sau două substraturi specifice sunt capabile să se lege.
- orice lucru cu care o enzimă se combină în mod normal se numește substrat.
- legarea substratului de enzimă determină enzima flexibilă să-și schimbe ușor forma printr-un proces numit potrivire indusă pentru a forma un intermediar temporar numit complex enzimă-substrat.
- enzimele accelerează rata reacțiilor chimice, deoarece reduc energia de activare, energia care trebuie furnizată pentru ca moleculele să reacționeze între ele.
- multe enzime necesită un cofactor nonprotein pentru a le ajuta în reacția lor. În acest caz, porțiunea proteică a enzimei, numită apoenzimă, se combină cu cofactorul pentru a forma întreaga enzimă sau haloenzima.
- unii cofactori sunt ioni precum Ca++, Mg++ și K+; alți cofactori sunt molecule organice numite coenzime care servesc ca purtători pentru grupuri chimice sau electroni. NAD+, NADP+, FAD și coenzima A (CoA) sunt exemple de coenzime.
- din punct de vedere chimic, enzimele sunt în general proteine globulare. Unele molecule de ARN numite ribozime pot fi, de asemenea, enzime, funcționând de obicei pentru a scinda moleculele de ARN.
- enzimele sunt prezente doar în cantități mici în celulă, deoarece nu sunt modificate în timpul reacțiilor lor și sunt foarte specifice pentru substratul lor.
- activitatea enzimei este afectată de o serie de factori, inclusiv concentrația enzimei, concentrația substratului, temperatura, pH-ul și concentrația de sare.
colaboratori și atribuții
-
Dr. Gary Kaiser (Colegiul Comunitar din județul BALTIMORE, campusul CATONSVILLE)