adeziunea celulară
adeziunea celulară este procesul prin care celulele interacționează cu molecule specifice de pe suprafața celulei și se atașează la celulele adiacente. Acest proces poate avea loc prin interacțiuni directe sau indirecte între suprafețele celulare, unde celulele se atașează la matricea extracelulară înconjurătoare, care conține moleculele eliberate de celule în spațiul dintre celule. Adeziunea celulară apare atunci când molecula de adeziune celulară (CAM) interacționează cu o proteină transmembranară situată pe suprafața celulei. Adeziunea celulară leagă celulele în moduri diferite și poate participa la transducția semnalului pentru a permite celulelor să detecteze și să răspundă la schimbările din mediul înconjurător. Alte procese celulare reglementate de adeziunea celulară includ migrația celulară și dezvoltarea țesuturilor în organismele multicelulare. Modificările aderenței celulare pot perturba procesele celulare importante și pot duce la o varietate de boli, inclusiv cancer și artrită. Adeziunea celulară este, de asemenea, esențială pentru bolile cauzate de organisme infecțioase, cum ar fi bacteriile sau virușii.
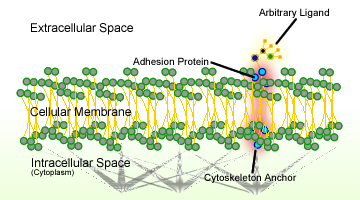 Figura 1. Schema aderenței celulare
Figura 1. Schema aderenței celulare
clasificări
CAMs sunt împărțite în patru familii principale: integrine, superfamilie imunoglobulină (Ig), cadherină și selectine. Fiecare dintre aceste molecule de adeziune are o funcție diferită și recunoaște un ligand diferit. Cadherinele și imunoglobulinele sunt came homotipice deoarece se leagă direct de același tip de CAM pe o altă celulă, în timp ce integrinele și selectinele sunt came heterologe care se leagă de diferite tipuri de CAM. Defectele aderenței celulare sunt adesea atribuite defectelor în expresia CAMs. În organismele multicelulare, legarea între came face ca celulele să adere unele la altele și să formeze o structură numită joncțiune celulară.
în funcție de funcțiile lor, joncțiunile celulare pot fi clasificate ca:
joncțiuni de ancorare (joncțiuni adherens, desmosomi și hemidesmosomi), care mențin celulele de-a lungul și consolidează contactul dintre celule.
joncțiuni ocluzive (joncțiuni strânse), care sigilează golurile dintre celule prin contactul celulă–celulă, creând o barieră rezistentă la apă pentru difuzie.
joncțiuni de formare a canalelor (joncțiuni gap), care leagă protoplasma celulelor adiacente, permițând transportul moleculelor între celule.
joncțiuni de transmitere a semnalului, care ar putea fi sinapse în cadrul sistemului.
alternativ, joncțiunile celulare pot fi clasificate în 2 soiuri principale în conformitate cu ceea ce interacționează cu celula: joncțiunile celulă–celulă, în medierea principală de cadherine și joncțiunile celulă–matrice, în medierea principală de integrine.
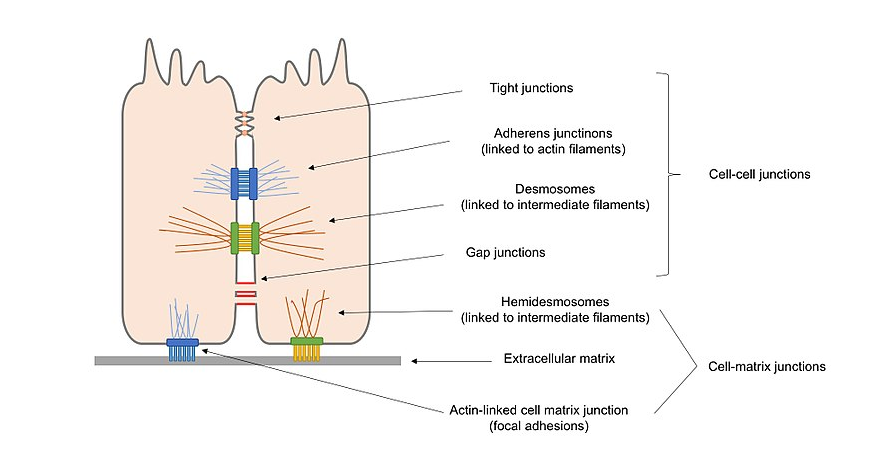 Figura 2. Diagrama generală a diferitelor tipuri de joncțiuni celulare prezente în celulele epiteliale, inclusiv joncțiunile celulă–celulă și joncțiunile celulă–matrice.
Figura 2. Diagrama generală a diferitelor tipuri de joncțiuni celulare prezente în celulele epiteliale, inclusiv joncțiunile celulă–celulă și joncțiunile celulă–matrice.
caracteristicile structurale ale proteinelor de adeziune celulară
proteinele de adeziune celulară sunt de obicei glicoproteine care mediază recunoașterea matricei extracelulare celulare și celulare la suprafața extracelulară. Majoritatea moleculelor de adeziune celulară au conformații similare în domeniile lor adezive. De exemplu: domeniile adezive ale cadherinei, imunoglobulinei, fibronectinei de tip III și EGF sunt predominant structuri de foi de tip XV. Motivul comun implicat în aderența celulară este structura greacă a butoiului cheie care conține unul sau două sandwich-uri anti-paralele.
domeniile asemănătoare Ig sunt o clasă majoră de domenii cheie grecești. Au asemănări de secvență cu domeniul variabil sau constant al anticorpilor care conțin șapte până la nouă catene anti-paralele Centauri. Foile p anti-paralele formează un baril 3-D-inqc. Domeniile asemănătoare Ig sunt stabilizate prin legături hidrofobe de bază și disulfură. Acestea sunt împărțite în două seturi majore: domenii asemănătoare Ig C și Ig V.
caracteristicile structurale legate funcțional ale proteinelor de adeziune celulară
proteinele de adeziune celulară au diversitate funcțională. Interacțiunea moleculelor de adeziune celulară ar putea fi interacțiuni proteine-proteine homofile sau heterofile sau interacțiuni proteine-carbohidrați. Modificările structurale ale moleculelor de adeziune celulară sunt adesea legate de proprietățile lor funcționale.
Interacțiuni Proteine-Proteine Homofile.
de exemplu, cadherinele sunt molecule de adeziune homofilă dependente de Ca2+transmembranare. Cadherinele sunt responsabile pentru menținerea joncțiunilor dintre celulele similare din țesuturi. Adeziunea celulă-celulă este mediată prin domeniul n-terminal al cadherinelor. Acesta conține cinci domenii extracelulare similare EC1 la EC5. Studiile cristalografice cu raze X în n-cadherin au arătat că domeniul EC1 formează un dimer, în care monomerii sunt orientați în paralel cu suprafața lor de legare adezivă îndreptată spre exterior din membrana plasmatică. Unitățile monomere ale domeniilor EC1 interacționează între ele într-un mod antiparalel, folosind suprafețele lor de legare adezive și formând o structură cu baril cu un diametru de un sfert. S-a sugerat că o interfață presupusă a interacțiunii are atât caracter hidrofob, cât și polar/încărcat, care imită interfața interacțiunii domeniilor imunoglobulinei între ele în superfamilia Ig.
Interacțiuni Proteine-Proteine Heterofile.
de exemplu, legarea integrinelor la diferiți receptori de suprafață celulară și liganzi ai matricei extracelulare este o clasă majoră de interacțiune proteină-proteină heterofilă în sistemele de adeziune celulară. După legarea de fibrinogenul solubil, integrina AIIB XV3 este transformată într-o stare de legare cu afinitate ridicată. Modificările conformaționale ale integrinei induse de legarea ligandului în acest caz sunt critice pentru activitatea sa adezivă. Legarea unui receptor de celule T poate modula, de asemenea, afinitatea de legare a integrinei, funcția leucocitelor antigen – 1 asociat (LFA-1), la receptorii săi, cum ar fi ICAM-l sau ICAM-2 (molecula de adeziune a celulelor intercelulare). Legarea ICAM – l poate induce în continuare modificări conformaționale ale LFA-1. Locul de legare adeziv al proteinei este localizat în terminalul C al LFA-l pe baza studiului cristalografic cu raze X.O tripeptidă, acidul arginină-glicină-aspartic (RGD), este un motiv comun de legare a ligandului integrinei. De exemplu, modulul de legare a ligandului de tip III al fibronectinei are o structură greacă a butoiului cheie, al cărui motiv RGD, situat la vârful buclei care leagă firele F și G, mediază aderența. Îndreptarea buclei RGD într-o conformație fluctuantă mai liniară prin desfășurare reduce accesibilitatea buclei la integrinele legate de suprafață și, prin urmare, scade afinitatea și selectivitatea legării.
Interacțiuni Proteine-Carbohidrați.
selectinele sunt importante în interacțiunea limfocitelor și neutrofilelor cu endoteliul vascular. Selectinele sunt molecule de adeziune care se leagă de carbohidrați. Nu există încă date structurale directe privind legarea selectinelor de carbohidrați. Selectinele leagă carbohidrații cu afinitate scăzută și au rate de pornire și oprire foarte rapide.