Introducere
acțiunea enzimatică a fosfodiesterazei de tip 5 (PDE5) este mecanismul principal de inactivare a GMPc, mediatorul din aval al agentului vasodilatator oxid nitric (NO) (Lugnier, 2006).
în cursul disfuncției erectile (ED), producția afectată de NO din vasele cavernoase endoteliale poate fi depășită farmacologic prin utilizarea inhibitorilor PDE5 (PDE5i), pentru a prelungi timpul de înjumătățire cGMP și pentru a spori funcția vasodilatatoare reziduală (Hawksworth și Burnett, 2015). Mai multe molecule cu activitate inhibitoare pe PDE5 au fost apoi proiectate și lansate pe piață, prezentând debut și durată diferită a efectului. În prezent, PDE5i sunt medicamentele de primă alegere utilizate pentru tratamentul ED (Mehrotra și colab., 2007).
în ciuda unei eficacități recunoscute la aproape 80% dintre pacienții cu ED neselectați (Eardley și colab., 2010; Hatzimouratidis și colab., 2010; Porst și colab., 2013), a fost raportată recent o renunțare remarcabilă la tratamentul cu PDE5i. În termeni cantitativi, a fost raportată o rată medie de întrerupere de 4% pe lună, cu o abandonare generală a terapiei în 50% cazuri anual (Carvalheira și colab., 2012; Corona și colab., 2016). Printre principalele motive date de pacienți pentru a justifica abandonarea terapiei, lipsa eficacității și a efectelor secundare sunt menționate ca fiind cele mai răspândite (Corona și colab., 2016). Se pot distinge două tipuri de efecte secundare: cele strict legate de inhibarea PDE5, cum ar fi cefaleea, înroșirea feței și dispepsia și cele asociate activității inhibitoare reziduale a medicamentelor asupra altor PDE, cum ar fi vasodilatația și tahicardia (PDE1), tulburările vizuale (PDE6) și durerile de spate (PDE11) (Bischoff, 2004; Gupta și colab., 2005). Deoarece apariția efectelor secundare crește atât cu nivelul seric, cât și cu timpul de expunere la medicament (Gupta și colab., 2005; Taylor și colab., 2009), profilul de siguranță/eficacitate al unui medicament poate fi îmbunătățit alternativ printr-o abordare farmacocinetică prin proiectarea unei noi formulări de medicament (Mehrotra și colab., 2007). Această abordare a fost aplicată cu succes PDE5i în cazul vardenafilului. Într-adevăr, această moleculă suferă de o biodisponibilitate relativ scăzută (15%, Centrul de evaluare și cercetare a medicamentelor, 2003). Comparativ cu comprimatul filmat (FCT), formularea originală pentru administrarea clasică per os, formularea comprimatelor oro-dispersabile (ODT) pentru Vardenafil a crescut semnificativ biodisponibilitatea medicamentelor prin favorizarea absorbției sublinguale, o cale recunoscută a fi mai puțin afectată de metabolismul la primul pasaj (Heinig și colab., 2011).
sildenafilul (Sild) a fost primul inhibitor selectiv al PDE5 aprobat pentru tratamentul ED (Boolell și colab., 1996). Este o moleculă relativ lipofilă și, după administrarea orală, concentrația plasmatică maximă este atinsă într-un timp care variază de la 0,5 la 2 ore. Sild prezintă o biodisponibilitate orală relativ scăzută (38-41%), în principal datorită metabolismului extensiv al intestinului și al primului pasaj (Gupta și colab., 2005). În ciuda prezenței îndelungate pe piață, dezvoltarea formulărilor noi de droguri a urmărit prost, până la lansarea recentă pe piața italiană a unei noi formulări: filmul oro-dispersabil (ODF). Într-adevăr, ODF a fost aprobat ca o formă bioechivalentă a FCT (Leoni și colab., 2013). Cu toate acestea, formulările care se dezintegrează oral pot reprezenta sisteme adecvate pentru a favoriza absorbția trans-mucoasă și, în special, sub-linguală (Kathpalia și Gupte, 2013).
în acest studiu, am evaluat farmacocinetica Sild asociată administrării sublinguale fie a ODF, fie a ODT, în comparație cu FCT ca formulare originală per os. În acest scop, am investigat profilul de eliberare/permeație al diferitelor formulări Sild prin sisteme in vitro special dezvoltate pentru a evalua absorbția trans-mucoasă a medicamentelor. În plus, am cuantificat profilurile serice ale farmacocineticii Sild după administrarea FCT per os și ODT sublingual și ODF la pacienții cu ED.
materiale și metode
produse chimice și formulări medicamentoase
soluția de săruri de echilibru Hank pH 7.4 (HBSS), soluția HEPES, benzanilida și citratul de Sild au fost achiziționate de la Sigma–Aldrich (Milano, Italia). Pentru a evita orice rezultate confuze care decurg din utilizarea unor produse bioechivalente alternative disponibile pe piață, au fost utilizate următoarele produse: Viagra (Pfizer, Milano, Italia), Viagra Oro (Pfizer) și Rabestrom (IBSA, Lodi, Italia). Medicamentele au fost prescrise pacienților în timpul evaluării ambulatorii pentru uz privat. Pentru testele in vitro și evaluarea in vivo a farmacocineticii (vezi mai jos), medicamentele au fost achiziționate în mod specific de personalul implicat în studiu la unitățile farmaceutice locale și apoi manipulate/depozitate în condiții optime.
test de dezagregare
testele de dezagregare in vitro au fost efectuate în conformitate cu Farmacopeea Europeană (2016) folosind testerul de dezintegrare a tabletei (Sotax DT 2, Figura suplimentară S1A), folosind apa ca fluid de imersie la 37, 0,5, 5, C. Timpul de dezagregare a fost verificat la dezintegrarea completă a formei de dozare. Dezintegrarea completă este definită ca acea stare în care orice reziduu al unității care rămâne pe ecranul aparatului de testare sau care aderă la suprafața inferioară a discurilor este o masă moale fără miez ferm palpabil. Testele au fost efectuate în trei exemplare, iar rezultatele au fost raportate ca valoare medie a deviației standard a valorilor de la sută la sută.
test de dizolvare
testele in vitro de dizolvare a medicamentului au fost efectuate în conformitate cu Farmacopeea Europeană . Testele de dizolvare au fost efectuate cu ajutorul unui aparat cu palete, viteza paletei 50 rpm, iar HBSS pH 7.4 a fost utilizat ca volum mediu de dizolvare(900 ml la 37 0.5 0.5 C).
în timpul testelor de eliberare, 2 ml de probă de mediu de dizolvare, la 0, 2, 4, 6, 10, 20, 30, și 40 min, a fost îndepărtat și filtrat prin filtru de esteri celulozici de 0,45 cm și, prin urmare, diluat. Ulterior, cuantificarea Sild a fost realizată prin cromatografie lichidă de înaltă performanță (HPLC)-UV. Volumul eliminat a fost înlocuit de fiecare dată cu mediu proaspăt. Testele au fost efectuate în trei exemplare, iar rezultatele au fost raportate ca valoare medie a deviației standard a valorilor de la sută la sută. Datele au fost normalizate cu privire la conținutul de medicament al formulării.
testul de permeabilitate Trans-mucoasă
profilul de permeabilitate Trans-mucoasă al Sild a fost evaluat in vitro utilizând un dispozitiv specific conform Delvadia și colab. (2012) modificat corespunzător. Pe scurt, dispozitivul a constat într–un sistem de difuzie verticală prezentat de camere donor–receptor separate printr-o membrană de unică folosință de celuloză-acetat (pori 0,45 mm). Celula donatoare conținea 1,5 ml de HBSS, în timp ce camera receptoare făcea parte dintr-un circuit închis de recirculare de 30 ml, inclusiv volumele de tuburi și rezervor. Prelevarea de probe a fost efectuată din rezervorul camerei receptoare la intervale de timp de 0, 5, 10, 20, 30, și 40 min și înlocuit cu un volum echivalent de HBSS proaspete. Probele au fost analizate de către HPLC-UV pentru conținutul de droguri (FEJ Inkst et al., 2014). Datele au fost normalizate la cea mai mare concentrație de Sild permeat observată pentru citratul de Sild pur. Testele au fost efectuate în trei exemplare, iar rezultatele au fost raportate ca valoare medie a deviației standard a valorilor de la sută la sută.
studiu farmacocinetic asupra pacienților voluntari psihogenici de ED
studiul a fost realizat în unitatea de Andrologie și Medicină Reproductivă (Spitalul Universitar din Padova, Italia), în perioada mai-septembrie 2017, conform Declarației de la Helsinki, sub aprobarea Comitetului de etică al Spitalului Universitar Padova (protocolul numărul 3982/AO/16 și modificări succesive). Pentru a evita rezultatele confuze, subiecții cu ED psihogenic au fost înscriși deoarece apariția mai mică a dereglărilor organice se asociază cu ED (Ludwig și Phillips, 2014).
dimensiunea eșantionului a fost calculată pentru a obține o dimensiune a efectului de cel puțin 0,5 cu o putere statistică de 0,8 și un nivel de semnificație de 0,05 pentru o comparație în trei grupuri (a se vedea calculatorul de putere – ANOVA independentă într-un singur sens).
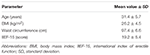
douăzeci de pacienți (vârsta medie 31,4 x 5,7 ani) au fost înrolați consecutiv prin eliberarea consimțământului informat semnat. Pacienții au participat la evaluarea ambulatorie raportând incapacitatea constantă de a obține și menține o erecție pentru un contact sexual satisfăcător în ultimele 6 luni sau mai mult. Evaluarea clinică ulterioară a fost efectuată la toți pacienții pentru a stabili absența bolilor legate de ED, cum ar fi diabetul zaharat, hipertensiunea, tulburarea neurologică și utilizarea antidepresivelor. Diagnosticul ED psihogenic a fost confirmat de îndeplinirea unui scor index <26 la administrarea chestionarului International Index of Erectile Function-15 (IIEF-15) (Lotti și colab., 2016) și menținerea erecțiilor spontane nocturne, evaluate prin tumescența nocturnă a penisului și monitorizarea rigidității prin sistemul de evaluare a rigidității RigiScan Plus (Dacomed, Statele Unite) timp de două nopți consecutive, așa cum s-a descris anterior (Munoz și colab., 1993; Caretta și colab., 2005). Criteriile de excludere au fost diagnosticul de tumori maligne, niveluri plasmatice anormale ale hormonilor (respectiv, hormon luteinizant >8 UI/l, testosteron total <10, 4 nmol/l, tirotropină >4, 5 mUI/l, prolactină >20 ng/ml) și creșterea grosimii mediilor intime la trunchiurile supra-aortice (>0.9 mm) și/sau arterele cavernoase (>0,3 mm), evaluate prin ecografie Doppler Color așa cum s-a descris anterior (Caretta și colab., 2005, 2009).
pacienții au fost de acord să adere la un studiu deschis, încrucișat, cu o singură doză, cu trei căi. Schema de dozare a medicamentului este raportată în Figura 1. Doza de Sild a fost aleasă ca 50 mg, în acord cu rapoartele anterioare privind tratamentul ED psihogenic (Banner și Anderson, 2007). Pacienților li s-a cerut să nu ia droguri sau alcool timp de 1 săptămână înainte și în timpul studiului. În plus, în timpul zilei de dozare a medicamentului, pacienților li s-a solicitat, de asemenea, să aibă un mic dejun fără grăsimi (fără lapte sau alte alimente grase) cu cel puțin 2 ore înainte de test. FCT, considerată formulare de referință, a fost administrată clasic per os prin înghițirea comprimatului oral cu un pahar cu apă. Pentru ODT și ODF, pacienții au fost instruiți să țină formularea sub limbă timp de 15 minute fără a lua apă, urmată de înghițire. Probele de sânge venos au fost colectate în tuburi standard (Vacutainer, bd Biosciences, Milano, Italia) la 0, 5, 10, 15, 30, 60, 90, 120, și 240 min după administrarea medicamentului. S-a efectuat compensarea prin perfuzie continuă de soluție salină sterilă. După dozare, subiecții au fost adăpostiți până la finalizarea prelevării de sânge. O retragere suplimentară de sânge a fost efectuată la 24 de ore de la administrare din motive de control pentru a stabili clearance-ul complet al medicamentului. Ca perioade de eliminare, au fost permise 7 zile între o doză și următoarele. După recoltarea sângelui, plasma a fost imediat izolată și depozitată la -80cc până la utilizare.
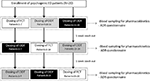
FIGURA 1. Schema de dozare și evaluările pentru evaluarea parametrilor farmacocinetici la 20 de pacienți cu disfuncție erectilă psihogenică (ED), subdivizate în trei grupuri (respectiv, pacienți 1-7; pacienți 8-14; și pacienți 15-20). Fiecărui grup de pacienți li s-a administrat alternativ Comprimat filmat per os (FCT), Comprimat orodispersabil sublingual (ODT) sau film orodispersabil sublingual (ODF) cu cel puțin 1 săptămână de spălare de la fiecare administrare. Toate formulările conțineau 50 mg sildenafil (Sild).
în timpul cazării, pacienților li s-a solicitat, de asemenea, să înregistreze reacțiile adverse la medicament (ADR) într-o formă concepută special, adaptată din formularul de raportare ADR al Agenției Italiana del Farmaco (AIFA1). O versiune tradusă a chestionarului este disponibilă ca Material suplimentar (a se vedea fișa cu date suplimentare S1). Pacienților li s-a cerut să specifice tipul de reacție/reacții adverse, intensitatea globală (într-o scară de evaluare subiectivă de la 1, foarte slabă, la 5, foarte intensă), timpul de debut și durata totală.
cuantificarea sildenafilului în serul uman
pentru cuantificarea concentrațiilor serice de Sild, s-au adăugat 400 ilqq de probă serică de 500 ilqq de metanol suplimentat cu standardul intern (IS) benzanilidă (5 ilqqg/ml). Ulterior, la amestec s–au adăugat 5 ml de acetat de etil, probele au fost vortexate pentru a efectua extracția lichid-lichid, cele două faze au fost separate prin centrifugare. Porțiunea organică a fost apoi evaporată sub vid-centrifugă la 40 C. Reziduul obținut a fost Re-dizolvat cu 200 ilqq de metanol și, în final, utilizat pentru analiza cromatografiei lichide de înaltă performanță-spectrometrie de masă în tandem (HPLC-MS/MS).
cromatografie lichidă de înaltă performanță-analiza MS/MS s-a utilizat un sistem Agilent-Varian 1260 și detectorul triplu-cvadruplu Agilent-Varian 320 ms.separarea cromatografică s-a realizat pe o coloană Phenomenex C-18 Evo 3 Oct 100 și o fază mobilă constituită din acetonitril cu 0,1% acid formic în apă cu un gradient detaliat în figura suplimentară S2A. Un mod de detecție pozitiv a fost aplicat pentru tranziția 198 > 105 Da A IS, obținută cu o tensiune capilară de 40 V și o energie de coliziune de 16 V în timp ce 475 > 100 Da pentru Sild cu tensiune capilară de 40 V și, respectiv, o energie de coliziune de 22,5 V. Cromatogramele reprezentative ale IS și Sild în probe reale sunt raportate în figura suplimentară S2B.
analiza statistică
parametrii farmacocinetici (FC), cum ar fi concentrația serică maximă (Cmax), timpul până la concentrația serică maximă (tmax) și aria de sub curbă (ASC) la diferite momente de timp, au fost calculați cu rutine specifice de aplicații cu software-ul GraphPad (La Jolla, CA, Statele Unite). Analiza statistică a datelor a fost efectuată cu SPSS 21.0 Pentru Windows (SPSS, Chicago, IL, Statele Unite). Testul Kolmogorov-Smirnov a fost folosit pentru a verifica normalitatea distribuției. Variabilele care nu arată distribuția normală au fost transformate în jurnal. Caracteristicile inițiale ale pacienților, PKs și datele din experimentele in vitro au fost comparate cu testele T ale studenților nepereche cu corecția Bonferroni-Holm pentru comparații multiple. Măsuri repetate ANOVA a fost efectuată pentru a testa diferențele de eliberare a medicamentului și concentrația serică Sild. Testul lui Levene a fost folosit pentru a testa omogenitatea varianței între grupuri. Dacă omogenitatea ipotezei varianței a fost încălcată, s-a efectuat testul Welch și s-a raportat valoarea p respectivă. Proporția de ADR a fost comparată cu testul exact de la 7ct2. Valorile P < 0.05 au fost considerate semnificative statistic.
rezultate
analiza in Vitro a eliberării/Permeației sildenafilului din diferitele formulări medicamentoase
dinamica eliberării și permeației Sild din cele trei formulări medicamentoase a fost investigată anterior in vitro (Figura 2). Timpul până la dezagregarea completă pentru FCT, ODT și ODF a fost evaluat printr-un test standard descris în Farmacopeea Europeană (2016; figura 2a). ODF a prezentat cel mai mare timp de dezagregare comparativ cu FCT și ODT (respectiv, P = 0,017 și P = 0,008).
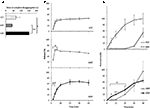
FIGURA 2. Evaluarea in vitro a proprietăților bio-tehnologice ale FCT, ODT și ODF care conțin 50 mg Sild. Rezultatele sunt reprezentative pentru trei experimente independente și au fost raportate ca valori medii ale deviației standard. (A) Rezultatele testului de dezagregare, raportând timpul (în secunde) până la dezagregarea completă a formulării. Semnificație: 0,05 și 0,05 p < 0,01 între formulele indicate. (B) rezultatele testului de dizolvare, raportând cantitatea de Sild eliberată de fiecare formulare ca procent din doza medicamentului. Semnificație: aP < 0,01 vs.FCT; bP < 0,001 vs. ODT. (C) rezultatele testului de permeabilitate (detaliate în secțiunea „Materiale și metode”) care raportează cantitatea de Sild permeabil printr-o membrană de acetat de celuloză, ca procent din cea mai mare valoare obținută de 50 mg pulbere de Sild pur (linie discontinuă în panoul superior). Semnificație: p < 0.05 vs. ODT; P < 0.01 vs.ODT; ap < 0.01 vs. FCT.
pentru a evalua influența acestor dovezi asupra eliberării medicamentului din formulare, a fost efectuat un test standard de dizolvare (Farmacopeea Europeană, 2016; figura 2b). Comparativ cu formularea de referință FCT, ODT a arătat o eliberare mai rapidă a medicamentului a cărui întindere maximă a fost atinsă chiar și după numai 2 minute de la începutul testului (P = 0,006 vs.FCT). Pe de altă parte, procentul medicamentului eliberat din ODF în primele 4 minute ale testului a fost mai mic comparativ cu FCT și ODT (respectiv, P = 0,004 și P < 0,001). În special, ODF a arătat o eliberare mai progresivă a medicamentului în comparație cu FCT, atingând întinderea maximă după 20 de minute de la începutul testului.
pe această bază, permeația Trans-mucoasă a Sild din fiecare formulare a fost evaluată printr-un dispozitiv special dezvoltat (figura 2c). În scopuri de referință, citratul Sild pur, utilizat într-o greutate echivalentă cu 50 mg de Sild, a fost evaluat pentru permeabilitatea trans-mucoasă și a arătat difuzie liberă și rapidă între cele două camere. A fost observat un profil aproape opus pentru FCT, care arată o permeabilitate neglijabilă până la 30 de minute de la începutul testului. Profilurile de permeabilitate ale ODT și ODF au arătat un comportament intermediar în comparație cu cele două condiții anterioare. În primele 20 de minute ale testului, ODF a arătat o măsură semnificativ mai mare de permeabilitate comparativ cu ODT (respectiv, P = 0,033 la 5 min, P = 0,003 la 10 min și P = 0,041 la 20 min). Spre deosebire de FCT și ODT care s-au dezagregat complet în camera donatoare, o masă reziduală de jeleu moale de ODF a persistat pe membrana acetat de celuloză chiar și la sfârșitul testului (figura suplimentară S2C).
farmacocinetica diferențială a sildenafilului
douăzeci de subiecți de sex masculin afectați de de psihogenică au acceptat să primească alternativ FCT, ODT sau ODF, separați la o săptămână de spălare. Așa cum este detaliat în secțiunea „Materiale și metode”, FCT a fost înghițit clasic pentru a permite administrarea clasică per os, în timp ce ODT și ODF au fost menținute sub limbă timp de 15 minute pentru a promova ruta sublinguală. Caracteristicile clinice ale pacienților sunt raportate în tabelul 1. Concentrațiile serice de Sild corespunzătoare celor trei condiții de dozare sunt raportate în Figura 3. O variabilitate considerabilă a prezentat profilul seric al medicamentului celor trei formulări. Comparativ cu FCT, ODT a arătat o creștere aparentă precoce a concentrațiilor serice ale Sild; cu toate acestea, această tendință nu a fost semnificativă statistic. Pe de altă parte, a fost observată o scădere mai rapidă a nivelurilor de Sild la 120 și 240 min de la dozare pentru formularea ODT (respectiv, P = 0,044 și P = 0,024 față de FCT).
TABELUL 1. Caracteristicile clinice ale participanților la studiu (n = 20).
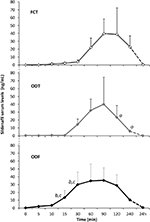
FIGURA 3. Evaluarea in vivo a nivelurilor serice de Sild, la 20 de pacienți afectați de ED psihogenic, care primesc alternativ fie FCT per os, fie ODT sublingual sau ODF sublingual, așa cum este detaliat în secțiunea „Materiale și metode.”Datele sunt raportate ca valori medii ale valorii deviației standard a valorilor de la sută: aP < 0,05 vs.FCT; bP < 0,01 vs. FCT; cP < 0,05 vs. ODT.
profilul seric al medicamentului din formularea ODF a arătat o creștere mai rapidă a nivelurilor de Sild comparativ cu FCT (P = 0,001 și P = 0,003) și ODT (P = 0,048 și P = 0,041), respectiv, la 15 și 30 de minute de la administrare. În acord cu timpul său lent de dezagregare in vitro (figura 2b), curba medie concentrație–timp a ODF in vivo a fost mai lină decât cele ale FCT și ODT (Figura 3).
parametrii farmacocinetici ai celor trei formulări, obținuți din analiza nivelurilor serice de Sild, sunt rezumați în tabelul 2. În ciuda faptului că nu s-a observat nicio diferență semnificativă între cele trei formulări În ceea ce privește Cmax, tmax și ASC0-240 min, ODF a prezentat cea mai mică valoare a Cmax (38,2 int 23,7 ng/ml) și cea mai scurtă tmax (70,0 int 24,5 min). În special, ODF a prezentat o valoare semnificativ mai mare a ASC0 – 60 min comparativ cu FCT și ODT (respectiv, P = 0,005 și P = 0.043), rezultând o biodisponibilitate relativă crescută a Sild în prima oră de la administrarea ODF pe cale sublinguală.

TABELUL 2. Parametrii farmacocinetici ai formulărilor de sildenafil.
reacții Adverse la medicament
rezultatele obținute din chestionarul autoadministrat privind tipul și caracteristicile ADR experimentate de participanții la studiu sunt rezumate în tabelul 3. Printre ADR cunoscute raportate pentru Sild (Taylor și colab., 2009), cele mai frecvent înregistrate au fost cefaleea, înroșirea feței și congestia nazală. Un pacient a raportat dureri musculare de grad scăzut (gradul 1 la scara de evaluare subiectivă) după administrarea FCT. Niciunul dintre pacienți nu a raportat modificări ale vederii, tahicardie, slăbiciune sau auz modificat.

TABELUL 3. Reacțiile Adverse la medicament înregistrate de participanții la studiu (n = 20).
comparativ cu FCT ca formulare de referință, ODT a arătat o prevalență invariabilă a ADR. Cu toate acestea, percepția personală a intensității înroșirii a fost semnificativ mai mică (P = 0,031). Pe de altă parte, ODF a arătat o prevalență redusă a durerii de cap comparativ cu FCT (P = 0,043). În plus, durata și intensitatea hiperemiei și congestiei nazale au fost percepute la niveluri mai scăzute comparativ cu FCT (respectiv, P = 0,011 și P = 0,015) și ODT (respectiv, P = 0,026 și P = 0,037).
discuție
în acest studiu, oferim dovezi că calea sublinguală de administrare a Sild se asociază cu o biodisponibilitate timpurie crescută a medicamentului și un profil de tolerabilitate îmbunătățit. Aceste dovezi sunt susținute atât de investigațiile in vitro, care arată că formularea Sild este prezentată printr-un timp mai lung până la dezagregare, dar a favorizat semnificativ absorbția trans-mucoasă, cât și dovezile in vivo.
inhibitorii fosfodiesterazei sunt prima opțiune terapeutică pentru tratamentul ED; cu toate acestea, efectele secundare experimentate de pacienți sunt recunoscute ca fiind motivul cel mai răspândit pentru întreruperea tratamentului (Corona și colab., 2016). Modificarea farmacocineticii prin proiectarea formulării de medicamente noi poate reprezenta o strategie atractivă pentru îmbunătățirea profilului de siguranță / eficacitate al medicamentului în sine (Mehrotra și colab., 2007). În acest sens, expirarea din 2013 a brevetului privind citratul de Sild în mai multe țări europene a permis posibilitatea eliberării unui număr de noi formulări de Sild. Trebuie remarcat faptul că majoritatea formulărilor Sild disponibile pe piață astăzi sunt de fapt aprobate ca forme bioechivalente ale FCT originale (Leoni și colab., 2013). Interesant este că au fost dezvoltate formulări care se dezintegrează Oral, prezentate prin dezagregarea rapidă în gura pacientului fără a fi nevoie de înghițire cu apă (Goel și colab., 2008). Aceste formulări noi găsesc o complianță îmbunătățită la acele populații de pacienți cu dificultăți în înghițirea dozelor solide convenționale, cum ar fi copiii, pacienții geriatrici și pacienții disfagici. În plus, prin asigurarea unei disponibilități mai mari a medicamentelor orale, formulările care se dezintegrează oral pot reprezenta sisteme evaluate pentru a favoriza absorbția trans-mucoasă și, în special, sub-linguală (Kathpalia și Gupte, 2013). În special în Italia, două formulări de Sild care se dezintegrează Oral sunt disponibile oficial în unitățile de farmacie: ODTs și ODFs.
în acest studiu, am urmărit să evaluăm posibilele variații farmacocinetice și modelul corespunzător al ADR, care rezultă din favorizarea absorbției Trans-mucoase a Sild prin administrarea sub-linguală a celor două formulări dezintegrante orale disponibile ale medicamentului. Rezultatele au fost comparate cu formularea originală a Sild, și anume FCTs. Interesant, am găsit o corelație strictă, atât in vitro, cât și in vitro, între proprietățile bio-tehnologice și PKs ale diferitelor formulări. În special, în ciuda unei doze egale de medicament (50 mg) și a unei rate ușor reduse de eliberare a medicamentului în testul de dizolvare, ODF a fost caracterizat printr-un timp mai mare până la dezagregare și o rată mai mare de permeabilitate în modelul trans-mucoasei, pe de o parte, și printr-o biodisponibilitate crescută a medicamentului în prima oră de la administrare, pe de altă parte. Am putea apoi să presupunem că absorbția sub-linguală a Sild este favorizată de un contact prelungit cu mucoasa medicamentoasă. Într-adevăr, acest fenomen este urmărit în general pentru medicamentele trans-mucoase orale, unde se recomandă utilizarea polimerilor mucoadezivi pentru a asigura o perioadă prelungită de contact între formulare și mucoasa orală (Lam și colab., 2014), în special din acele medicamente, cum ar fi Sild, afectate de solubilitate scăzută în apă (Zayed și colab., 2012; Sun și colab., 2014). Aceste rezultate preliminare sugerează, de asemenea, o posibilă îmbunătățire a eficacității clinice pentru această clasă de medicamente în comparație cu formulările originale. Sunt necesare studii suplimentare pentru a clarifica aceste aspecte.
cea mai izbitoare dovadă a prezentului studiu este o reducere semnificativă a RAM a administrării sub-lingvistice a ODF, comparativ cu ODT și FCT administrate în aceeași doză, ceea ce, la rândul său, poate duce la creșterea complianței pacienților. Aceste dovezi pot fi interpretate în lumina principiului că incidența unui efect secundar al medicamentului crește prin creșterea nivelului seric și a timpului de expunere la medicamentul în sine (Gupta și colab., 2005; Taylor și colab., 2009). În ciuda unei biodisponibilități globale neschimbate în comparație cu celelalte formulări analizate, administrarea sub-linguală a ODF a arătat o valoare mai mică a Cmax și un tmax mai scurt, rezultând o proporție semnificativ mai mare de Sild bio-disponibil în prima oră de la administrare. Astfel, am putea specula că administrarea sub-linguală a ODF combină o absorbție eficientă a medicamentului cu realizarea unor niveluri serice medii mai mici de Sild și un risc mai mic de RAM. Cu toate acestea, recunoaștem dimensiunea redusă a eșantionului ca principalul dezavantaj al studiului. Investigații suplimentare pe cohorte mai mari și cu doze diferite sunt necesare pentru a confirma această problemă.
în concluzie, în acest studiu raportăm că administrarea sublinguală de Sild ODF îmbunătățește profilul de tolerabilitate a medicamentului prin implicarea probabilă a unei farmacocinetice modificate în comparație cu FCTs generator. Deși ODF nu a fost conceput inițial în acest scop, aceasta reprezintă o strategie atractivă pentru ameliorarea complianței pacientului la terapie. Dezvoltăm studii comparative suplimentare pentru a evalua eficacitatea clinică la pacienții cu ED psihogenici și organici.
contribuțiile autorului
LDT și CF au coordonat studiul și au redactat manuscrisul. MDRP a evaluat și a înrolat pacienții. EF a efectuat analize in vitro. SDA a efectuat analiza serului. RP a efectuat comparația farmacocinetică. RP, NR și AG au revizuit și finalizat critic manuscrisul.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
mulțumim Dr. Alberto Barosso, Dr. Giuseppe Maggioni și Dr. Dimitri Portale pentru consilierea pacienților, Dr. Flavia Rosano și Dr.Alice Passadore pentru gestionarea pacienților și întregului personal al unității de Andrologie și Medicină Reproductivă.
material suplimentar
materialul suplimentar pentru acest articol poate fi găsit online la: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
figura S1 / imagini reprezentative ale testerului de dezintegrare a tabletei (a) și ale aparatului de dizolvare (B) utilizat pentru testul de dezagregare și, respectiv, pentru testul de dizolvare.
figura S2 |(A) detalii ale gradientului de fază mobilă utilizat pentru analiza cromatografiei lichide de înaltă performanță-spectrometrie de masă în tandem (HPLC-MS/MS) a concentrațiilor serice de sildenafil (Sild). Sunt raportate cromatograme reprezentative și spectre de masă ale ambelor Sild la standardul intern benzanilidă în probe reale (B). (C) imagine reprezentativă a filmului rezidual orodispersabil (evidențiat printr-o linie discontinuă), care persistă după testul de permeabilitate în dispozitivul utilizat pentru estimarea in vitro a absorbției trans-mucoasei printr-o membrană de acetat de celuloză.
fișă tehnică S1 | Chestionar privind reacțiile Adverse la medicament.
notă de subsol
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L. și Anderson, R. U. (2007). Sildenafilul integrat și terapia sexuală cognitiv-comportamentală pentru disfuncția erectilă psihogenică: un studiu pilot. J. Sex. Med. 4, 1117–1125. doi: 10.1111 / j. 1743-6109.2007. 00535.x
rezumat PubMed / CrossRef Text Complet / Google Scholar
Bischoff, E. (2004). Potența, selectivitatea și consecințele neselectivității inhibării PDE. Int. J. Impot. Res.Suppl. 1, S11–S14. doi: 10.1038 / sj.ijir.3901208
PubMed rezumat / CrossRef Text Complet / Google Scholar
Boolell, M., Allen, M. J., Ballard, S. A., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M. și colab. (1996). Sildenafil: un inhibitor de fosfodiesterază ciclic specific GMP de tip 5 activ pe cale orală pentru tratamentul disfuncției erectile a penisului. Int. J. Impot. Rezoluția 8, 47-52.
rezumat PubMed / Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R. și colab. (2005). La pacienții cu disfuncție erectilă și diferite grade de alterare a peretelui carotidic: rolul tadalafilului. Eur. Urol. 48, 326–331. doi: 10.1016 / j. eururo.2005.01.013
PubMed rezumat / CrossRef text integral / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A. și Foresta, C. (2009). Artera cavernoasă intima-grosimea Mediei: un nou parametru în diagnosticul disfuncției erectile vasculare. J. Sex. Med. 6, 1117–1126. doi: 10.1111 / j. 1743-6109.2008. 01112.x
rezumat PubMed / CrossRef Text Complet / Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J. și Forjaz, V. (2012). Abandonul în tratamentul disfuncției erectile cu PDE5: un studiu privind predictorii și o analiză calitativă a motivelor întreruperii. J. Sex. Med. 9, 2361–2369. doi: 10.1111 / j. 1743-6109.2012. 02787.x
rezumat PubMed / CrossRef Text Complet / Google Scholar
Centrul de evaluare și cercetare a drogurilor (2003). NDA 021400 Levitra (clorhidrat de Vardenafil) comprimate: Farmacologie Clinică / Recenzie Biofarmaceutică. Rockville, Md: Departamentul de sănătate și Servicii Umane. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E. și colab. (2016). Abandonul inhibitorilor de fosfodiesterază de tip 5 de primă generație: o revizuire cuprinzătoare și meta-analiză. Andrologie 4, 1002-1009. doi: 10.1111 / andr.12255
rezumat PubMed / CrossRef Text Complet / Google Scholar
Delvadia, P. R., Barr, W. H. și Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Direcția europeană pentru Calitatea Medicamentelor &asistență medicală (EDQM), a 9-a Edn. Strasbourg: Consiliul Europei.
Google Scholar
FEJ, I., Neumajer, G., B, S. și Jankovics, P. (2014). Analiza calitativă și cantitativă a inhibitorilor PDE-5 în medicamentele contrafăcute și suplimentele alimentare de către HPLC-UV folosind sildenafil ca referință unică. J. Pharm. Biomed. Anal. 98, 327–333. doi: 10.1016 / j. jpba.2014.06.010
PubMed rezumat / CrossRef textul integral / Google Scholar
Goel, H., Rai, P., Rana, V. și Tiwary, A. K. (2008). Sisteme de dezintegrare orală: inovații în formulare și tehnologie. Pat Recente. Droguri Deliv. Formula. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef Text Complet / Google Scholar
Gupta, M., Kovar, A. și Meibohm, B. (2005). Farmacocinetica clinică a inhibitorilor fosfodiesterazei-5 pentru disfuncția erectilă. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed rezumat / CrossRef Text Complet / Google Scholar
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F. și colab. (2010). Asociația Europeană de Urologie. Disfuncția sexuală la bărbați: disfuncția erectilă și ejacularea prematură. Eur. Urol. 57, 804–814. doi: 10.1016 / j. eururo.2010.02.020
PubMed rezumat / CrossRef text integral / Google Scholar
Hawksworth, D. J. și Burnett ,A. L. (2015). Tratamentul farmacoterapeutic al disfuncției erectile. Clin. Pharmacol. Acolo. 98, 602–610. doi: 10.1002 / cpt.261
Rezumat PubMed / CrossRef Text Complet / Google Scholar
Heinig, R., Weimann, B., Dietrich, H. și B, M. F. (2011). Farmacocinetica unei noi forme farmaceutice de vardenafil comprimate orodispersabile: rezultatele a trei studii clinice. Clin. Investig De Droguri. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed rezumat / CrossRef Text Complet / Google Scholar
Kathpalia, H. și Gupte, A. (2013). O introducere în dizolvarea rapidă a sistemelor de administrare a medicamentelor cu film subțire oral: o recenzie. Curr. Droguri Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed rezumat / CrossRef text integral / Google Scholar
Lam, J. K., Xu, Y., Worsley, A. și Wong, I. C. (2014). Livrarea orală a medicamentului transmucosal pentru uz pediatric. ADV. Droguri Deliv. Rev. 73, 50-62. doi: 10.1016 / j.ADR.2013.08.011
PubMed rezumat / CrossRef textul integral / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B. și Rodrigues, B. (2013). Sildenafil: două decenii de beneficii sau riscuri? Bărbat Îmbătrânit 16, 85-91. doi: 10.3109 / 13685538.2013.801952
PubMed rezumat / CrossRef Text Complet / Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M. și colab. (2016). Afectarea calității spermei este asociată cu disfuncția sexuală în funcție de gravitatea acesteia. Zumzet. Reprod. 31, 2668–2680. doi: 10.1093 / humrep / dew246
PubMed rezumat / CrossRef Text Complet / Google Scholar
Ludwig, W. și Phillips, M. (2014). Cauze organice ale disfuncției erectile la bărbații sub 40 de ani. Urol. Int. 92, 1–6. doi: 10.1159/000354931
PubMed Rezumat / CrossRef Text Complet / Google Scholar
Lugnier, C. (2006). Superfamilia nucleotidică fosfodiesterază ciclică (PDE): o nouă țintă pentru dezvoltarea agenților terapeutici specifici. Pharmacol. Acolo. 109, 366–398. doi: 10.1016 / j.pharmthera.2005.07.003
PubMed rezumat / CrossRef text integral / Google Scholar
Mehrotra, N., Gupta, M., Kovar, A. și Meibohm, B. (2007). Rolul farmacocineticii și farmacodinamicii în terapia inhibitorului fosfodiesterazei-5. Int. J. Impot. Res. 19, 253-264. doi: 10.1038 / sj.ijir.3901522
PubMed rezumat / CrossRef Text Complet / Google Scholar
Munoz, M., Bancroft, J. și Marshall, I. (1993). De asemenea, este recomandat pentru marirea penisului si pentru marirea penisului. Int. J. Impot. Rezoluția 5, 69-76.
Google Scholar
Porst, H., Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S. și colab. (2013). Comitetul pentru standarde ISSM pentru Medicină Sexuală. Tratamentul conservator (medical și mecanic) al disfuncției erectile. J. Sex. Med. 10, 130–171. doi: 10.1111 / jsm.12023
rezumat PubMed / CrossRef Text Complet / Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H. și colab. (2014). Creșterea absorbției orale și a efectului terapeutic al acetilpuerarinei pe bază de Nanoemulsii succinate de polietilen glicol 1000 de D-XV-tocoferil. Int. J. Nanomedicina 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed rezumat / CrossRef Text Complet / Google Scholar
Taylor, J., Baldo, O. B., Storey, A., Cartledge, J. și Eardley, I. (2009). Diferențele în durata efectului secundar și nivelurile deranjante asociate între inhibitorii fosfodiesterazei de tip 5. BJU Int. 103, 1392–1395. doi: 10.1111 / j. 1464-410X.2008.08328.x
rezumat PubMed / CrossRef Text Complet / Google Scholar
Zayed, R., Kamel, A. O., Shukr, M. și El-Shamy, A. H. (2012). Un studiu comparativ in vitro și in vivo al dispersiilor solide comprimate direct și al comprimatelor sublinguale de citrat de sildenafil liofilizat pentru tratamentul hipertensiunii arteriale pulmonare. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar