adăugarea unei părți de carbohidrați la o moleculă de proteine este denumită glicozilare proteică. Este o modificare post translațională comună pentru moleculele de proteine implicate în formarea membranei celulare. În timpul acestui proces,legarea unităților monozaharidice de lanțurile de aminoacizi stabilește etapa pentru o serie de reacții enzimatice care duc la formarea glicoproteinelor (oligozaharide legate de n și o care se găsesc la o entitate proteică). În toate cele 16 enzime cunoscute se presupune că mediază această reacție. O glicoproteină tipică are cel puțin 41 de legături care implică 8 aminoacizi și 13 unități monozaharidice diferite și include legăturile glicofosfatidilinozitol (GPI) și fosfoglicozil. Glicozilarea proteinelor ajută la plierea corectă a proteinelor, stabilitatea și în adeziunea celulară la celulă, necesară în mod obișnuit de celulele sistemului imunitar. Principalele situsuri ale glicozilării proteinelor din organism sunt ER, corpul Golgi, nucleul și fluidul celular.
glicozilarea proteinelor poate fi clasificată în două tipuri principale:
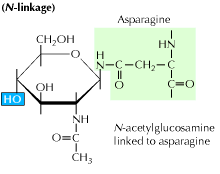 a) glicozilarea n-legată: începe cu adăugarea unui precursor de 14 zahăr la un aminoacid asparagină. Conține molecule de glucoză, manoză și N-acetilglucozamină. Această entitate este apoi transferată în lumenul ER. Enzima oligozaharil transferază atașează lanțul oligozaharidic de asparagină care apare în secvența tripeptidică, Asn-X-Ser sau Asn-X-Thr. X poate fi orice alt aminoacid decât Prolina. Secvența de proteine atașată de oligozaharidă se pliază acum corect și este acum translocată în corpul Golgi unde reziduul de manoză este îndepărtat.
a) glicozilarea n-legată: începe cu adăugarea unui precursor de 14 zahăr la un aminoacid asparagină. Conține molecule de glucoză, manoză și N-acetilglucozamină. Această entitate este apoi transferată în lumenul ER. Enzima oligozaharil transferază atașează lanțul oligozaharidic de asparagină care apare în secvența tripeptidică, Asn-X-Ser sau Asn-X-Thr. X poate fi orice alt aminoacid decât Prolina. Secvența de proteine atașată de oligozaharidă se pliază acum corect și este acum translocată în corpul Golgi unde reziduul de manoză este îndepărtat.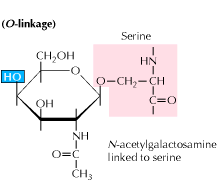
b) glicozilarea legată de O: glicozilarea începe cu o adăugare mediată enzimatic de N-acetil-galactozamină urmată de alți carbohidrați la reziduurile de serină sau treonină. Studiile arată că glicozilarea legată de O are loc într-o etapă ulterioară în procesarea proteinelor.