Introducere
țesuturile, celulele și structurile mai mici din interiorul celulelor (organele) sunt în mare parte apă și, prin urmare, sunt transparente. Imagistica pungilor mici de apă are ca rezultat imagini care nu conțin o mulțime de informații, iar în microscopie, este vital să existe un fel de contrast sau pată care să ofere zone ale probei de culoare și să le facă mult mai ușor de văzut. În plus, ce se întâmplă dacă doriți doar să imaginați unele dintre structurile mai mici din interiorul unei celule, cum ar fi un nucleu sau o membrană celulară? Colorarea întregii celule ar face imposibilă localizarea zonelor care vă interesează.
fluorescența rezolvă ambele probleme de contrast și localizare. Fluorescența este locul în care un obiect va emite lumină după absorbția luminii. Multe obiecte diferite prezintă fluorescență, cum ar fi minerale (cuvântul fluorescență provenind din fluoritul mineral), pești de adâncime (cel mai faimos meduza Aequorea victoria, din care a fost descoperită proteina fluorescentă verde (GFP)), plante, substanțe chimice și multe altele.
moleculele fluorescente (cunoscute sub numele de fluorofori) sunt utilizate pentru a eticheta probele, iar fluoroforii sunt disponibili care emit lumină în aproape orice culoare. Într-un microscop fluorescent, o probă este etichetată cu un fluorofor și apoi se folosește o lumină puternică (lumină de excitație) pentru a ilumina proba, care degajă fluorescență (lumină de emisie). În acest mod, probele sunt foarte contrastate cu fundalul negru, deoarece fluoroforul emite o lumină strălucitoare. Prin localizarea acestor fluorofori în zona de interes se poate lua o imagine clară a oricărei părți a unei celule, făcând microscopia fluorescentă un instrument puternic pentru științele vieții.
imagistica cu fluorescență Brightfield vs
în microscopia brightfield, eșantionul este iluminat cu lumină albă transmisă. Acest lucru creează o iluminare uniformă a probei sub microscop pentru a observa probe foarte contrastate, colorate sau pigmentate natural. Cu toate acestea, brightfield nu este suficient pentru a distinge între celule transparente/translucide, nepătate sau structuri celulare pentru a studia procesele de interes.
microscopia fluorescentă se bazează pe utilizarea fluoroforilor, molecule care emit lumină cu o lungime de undă vizibilă specifică atunci când sunt expuse la lumină cu o lungime de undă diferită. Când acești fluorofori sunt legați de o structură vizată de interes, fotonii emiși de fluorofor pot fi utilizați pentru a vizualiza această structură de interes. Beneficiul microscopiei fluorescente este că structurile vizate sunt iluminate, în timp ce zonele nedorite ale eșantionului au puțin sau deloc fluorescență, permițând direcționarea și imagistica ușoară.
de ce moleculele fluorescente
originea fluorescenței este electronii care se mișcă liber în jurul fluoroforului activ și eliberează energie absorbită, așa cum se vede în Fig.2.
înainte de excitație, electronii sunt în cea mai mică stare de energie disponibilă – starea de bază (S0). Când un electron este lovit cu un foton cu un anumit interval de energie, electronul absoarbe energia fotonului și sare până la o stare de energie mai mare (s1, s2 sau S3). Pentru a reveni la starea de bază (S0), electronul eliberează energia suplimentară ca emisie a unui foton. Energia acestui foton este mai mică decât energia de excitație, deci are o lungime de undă mai lungă. Acesta este motivul pentru care lumina de emisie are o lungime de undă mai mare decât lumina de excitație și poate apărea ca o culoare diferită.
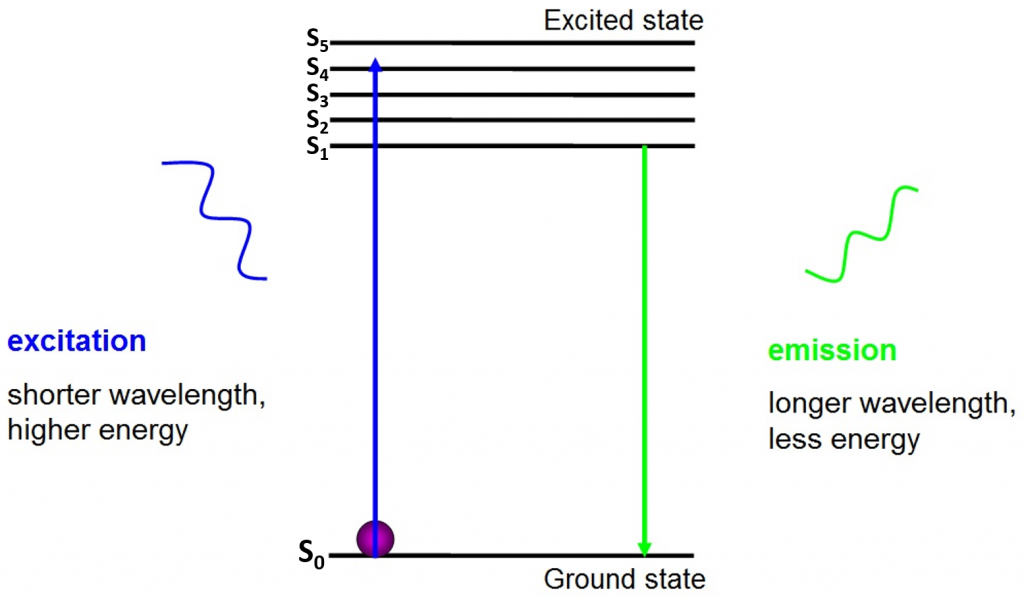
fotonul EMIS este de obicei în spectrul vizibil și poate fi vizualizat la microscop dacă există suficienți fluorofori excitați. Lungimea de undă a fotonului eliberat este specifică pentru fiecare fluorofor și această predictibilitate permite imagistica ușoară a fluorescenței.
factori de intensitate a fluorescenței
în timp ce fluoroforii pot emite fluorescență cu o lungime de undă previzibilă, este de asemenea important să știm ce factori controlează intensitatea fluorescenței. Fără o emisie suficient de intensă de lumină, fluorescența nu va fi detectabilă cu un microscop.
randament cuantic
randamentul cuantic (INQ) al unui fluorofor este raportul dintre numărul de fotoni eliberați și numărul de fotoni absorbiți. Randamentul cuantic este adesea exprimat ca o valoare de la 0-1, care 1 fiind 100% eficiența conversiei fotonilor. De asemenea, este important să rețineți că fiecare fluorofor are un pH unic, o rezistență Ionică și o temperatură pentru o eficiență optimă a fluorescenței.
Coeficient de extincție
fiecare fluorofor are o capacitate diferită de a absorbi fotonii, chiar dacă se află într-un interval de lungime de undă adecvat pentru a-l excita. Dacă un fluorofor este expus la un foton care se potrivește în mod corespunzător lungimii sale de undă de excitație, probabilitatea ca un foton să fie absorbit este o caracteristică măsurabilă și cunoscută sub numele de coeficientul de extincție (XV).
randamentul cuantic și coeficientul de extincție al unui fluorofor sunt adesea afișate împreună pentru a descrie cât de luminos se arată fluoroforul în setările experimentale.
durata de viață a fluorescenței
când un electron fluorofor absoarbe un foton, acesta nu eliberează imediat un foton cu lungime de undă mai mare. Se știe că eliberarea unei anumite energii între stările de energie excitate durează diferite perioade de timp. Cantitatea de timp pe care un electron o petrece în starea excitată înainte de a elibera un foton și de a reveni la starea de bază este o măsurare a duratei sale de viață a fluorescenței. Durata de viață a fiecărui fluorofor este unică și poate fi măsurată experimental. Atunci când utilizați coloranți fluorescenți experimental, este util pentru durata lor de viață, în special pentru aplicații care necesită viteză mare, cum ar fi neuronii de imagistică a calciului.
intensitatea lungimii de undă de excitație
cele mai multe configurații de microscopie fluorescentă includ o sursă de lumină care poate fi reglată pentru a afișa intervalul de lungime de undă dorit. Multe surse de lumină fluorescentă pot fi, de asemenea, ajustate pentru intensitatea excitației pentru a crește numărul de fotoni care se deplasează prin calea luminii. Într-o probă marcată fluorescent care este expusă lungimii sale de undă de excitație, fiecare fluorofor nu va fi activat în același timp. Prin creșterea intensității excitației și creșterea numărului de fotoni care ajung la probă, există o probabilitate mai mare ca mai mulți fluorofori să fie excitați.
Fotostabilitatea
Fotostabilitatea este capacitatea unei molecule sau a unui organism de a rezista daunelor. În microscopia fluorescentă, fluoroforii vor înceta în cele din urmă să absoarbă fotonii care se apropie și vor intra într-o stare întunecată permanentă. Pe măsură ce un organism adună mai mulți fluorofori în starea întunecată, aspectul țintei etichetate se reduce și se spune că eșantionul este fotobleaching. În microscopia fluorescentă, se iau adesea măsuri pentru a reduce cantitatea de fotobleaching experimentată în timpul experimentării. Unele măsuri includ o reducere a intensității luminii care interacționează cu proba și utilizarea coloranților fluorescenți specializați care nu rămân activi atât timp cât alți coloranți.
microscopie fluorescentă
pentru cercetători, principalul beneficiu al fluorescenței este capacitatea de a utiliza microscopia fluorescentă, unde probele sunt etichetate/colorate cu o substanță fluorescentă, cum ar fi un colorant, anticorp sau proteină, permițând imaginilor să aibă contrast. Prin direcționarea acestor etichete fluorescente, cercetătorii pot selecta ceea ce doresc să vadă. Acest lucru este demonstrat în Fig.3, unde un neuron poate fi văzut clar printre astrocite, deoarece acestea sunt etichetate cu diferite culori de marker fluorescent.
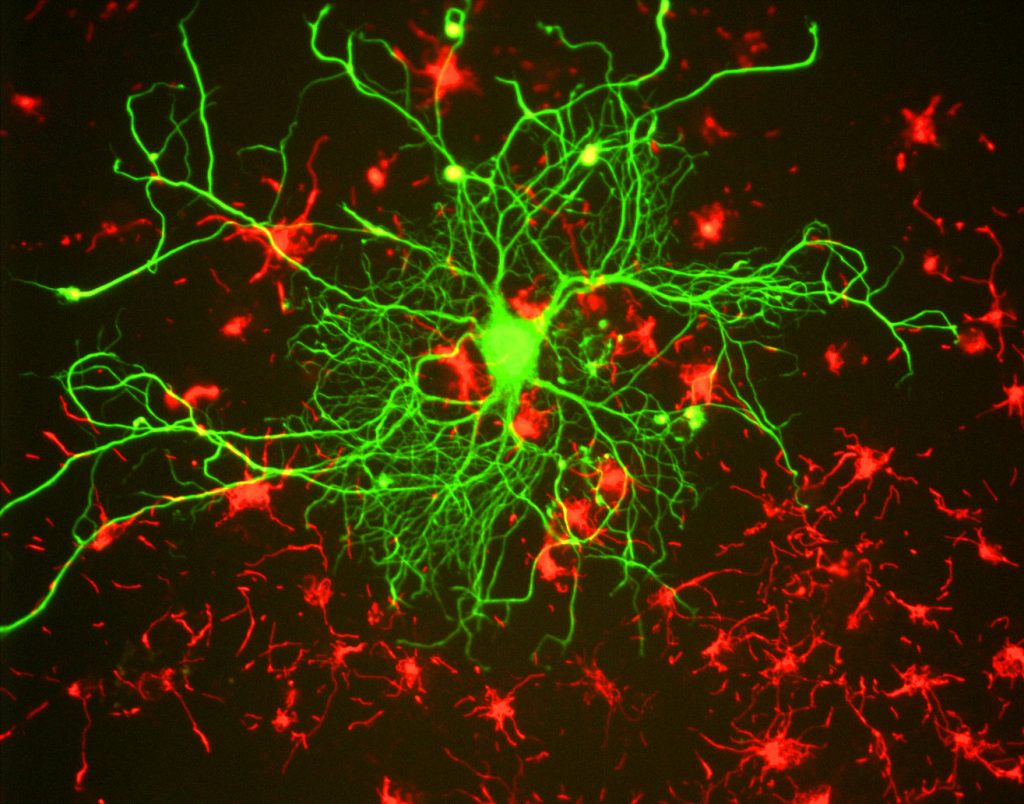
în general, pentru microscopia fluorescentă, o probă este etichetată cu markeri fluorescenți (de obicei specifici pentru anumite părți ale probei). Proba este apoi iluminată cu lungimea de undă specifică de excitație pentru fluorofor, iar fluorescența de emisie rezultată este primită de detector, de obicei o cameră științifică sensibilă.
majoritatea microscoapelor fluorescente sunt Microscoape cu epifluorescență, unde excitația și emisia se fac prin aceeași cale de lumină. Atât iluminarea excitației, cât și fluorescența emisă trec prin obiectivul microscopului și, de obicei, sunt filtrate pentru a detecta doar fluorescența. Această configurație este prezentată în Fig.4.
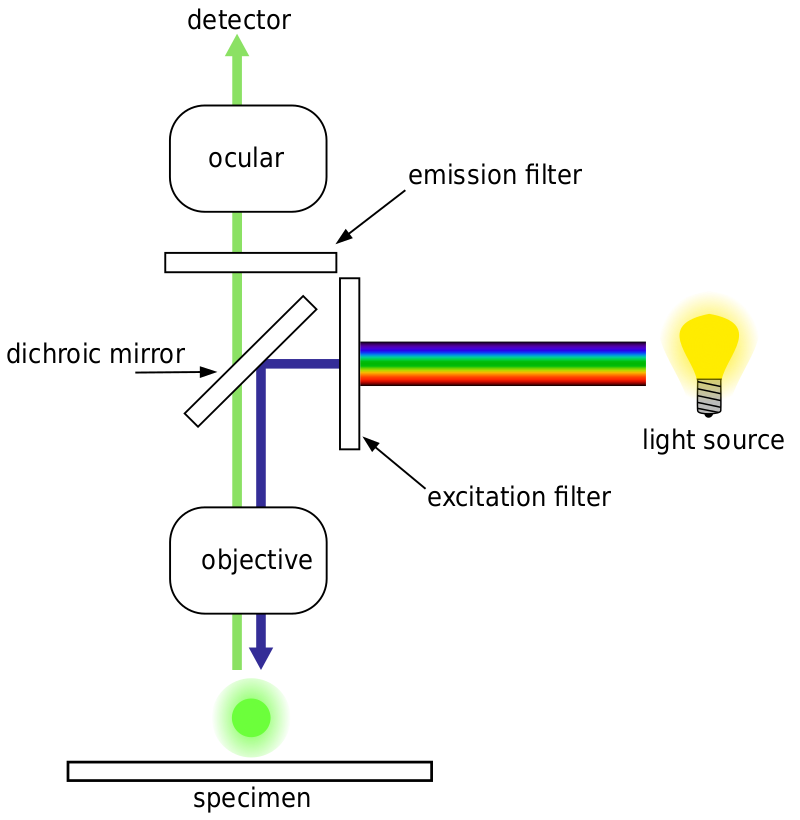
autofluorescență
unele structuri, organisme biologice și probe generale de microscopie pot prezenta în mod natural fluorescență, cunoscută sub numele de autofluorescență. Acest lucru este diferit de fluorescența din probele etichetate, dar împărtășește adesea lungimi de undă similare, ceea ce înseamnă că probele de microscopie cu autofluorescență pot ascunde fluorescența adăugată artificial și interferează cu detectarea, reducând semnalul. Este important să știți dacă eșantioanele dvs. prezintă autofluorescență, deoarece acest lucru va afecta orice imagistică fluorescentă făcută, cu excepția cazului în care sunt utilizate lungimi de undă specifice pentru a o evita.
exemple comune de obiecte autofluorescente sunt mitocondriile, lizozomii, colagenul și unii aminoacizi precum triptofanul, tirozina și fenilalanina. În special, autofluorescența este frecventă la plante datorită utilizării clorofilei și a altor molecule fluorescente, cum ar fi ligninele și carotenii. Fig.5 prezintă diferitele culori ale autofluorescenței dintr-o probă de pin scoțian neetichetat.
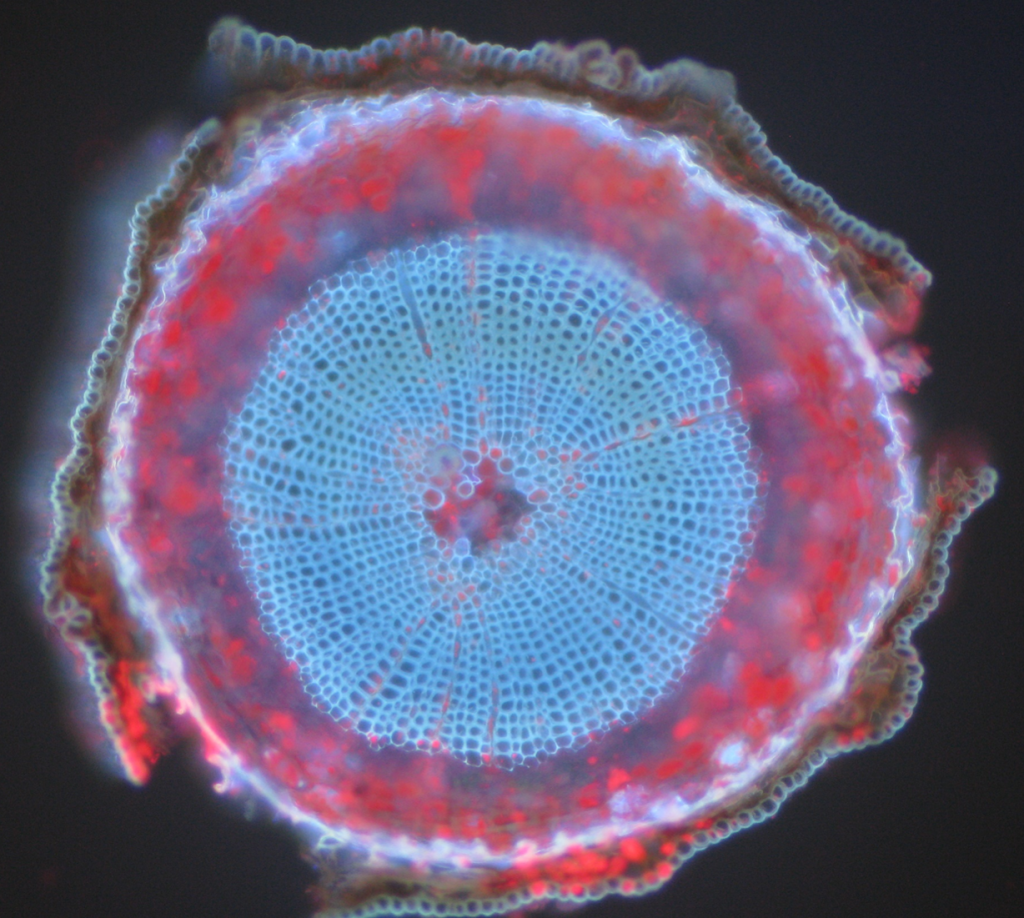
rezumat
de la introducerea primului colorant fluorescent, microscopia fluorescentă a fost un instrument puternic utilizat pentru a vizualiza celulele și structurile celulare cu o specificitate mai mare decât tehnicile tradiționale de microscopie cu câmp luminos. Cercetătorii potmanipula structura, proprietățile optice și sonda experimentelor de influență de interes pentru a obține date relevante. O astfel de flexibilitate a permismicroscopie fluorescentă să fie inclusă înmulte experimente științifice de viață.
în funcție de tipul de probă și fluorofor, o cameră științifică trebuie selectată cu atenție pentru a obține cele mai bune rezultate imagistice.
- Microscopie Cu Lumină. (2009) Repere Naturale. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Idei luminoase pentru biologia chimică. Biologie chimică ACS, 3 (3): 142-155.
- Liu, Y., Lilly, D. (2017) structuri cristaline dacă Fluoroforii de Cianină se stivă pe capătul ARN dublu catenar. Jurnal Biofizic, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Măsurători ale duratei de viață a fluorescenței și imagistică biologică. Recenzii Chimice, 110 (5): 2641-2684.
- Stockert, J., Blazquez-Castro, A. (2017) microscopie fluorescentă în științele vieții. Sharjah, Emiratele Arabe Unite. Bentham Science Publishers.
- Berezin, M. Y., & Achilefu, S. (2010). Măsurători ale duratei de viață a fluorescenței și imagistică biologică. Recenzii Chimice, 110 (5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). Microscopie Fluorescentă Cu Scanare Laser Cu Doi Fotoni. Știință. 248, (1951): 73-76.
- Deci, P. (2002). Microscopie cu lumină fluorescentă cu doi fotoni. Macmillan Publishing Group.
- Schermelleh, L., Heinztmann, R. și Leonardt, H. (2010). Un ghid pentru microscopie fluorescenta Super-rezoluție. Jurnalul de Biologie Celulară 190 (2): 165-175.
- Betzig, E., Patterson, G. H., Sougrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., Davidson, M. W., LippincottSchwartz, J., Hess, H. F. (2006) imagistica proteinelor fluorescente intracelulare la rezoluție nanometrică. Știință. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) imagistica cu limită de sub-difracție prin microscopie de reconstrucție optică stocastică (STORM). Metode Nat. 2, (10):793-5.
- Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M. și Gustasson, M. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avenda, M. S., Woehrstein, J. B., Dai, M., Shih, W. M. & Yin, P. (2014) multiplexat 3D celulare super-rezoluție imagistica cu ADN-vopsea și schimb-vopsea. Metode Nat. 11(3): 313-318
- Jiang, X., Wang, L., Carroll, S., Chen, J., Wang, M. și Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.