 |
|
majoritatea reacțiilor într-un mediu apos implică ioni. Cu toate acestea, atunci când are loc o reacție, apar de obicei două tipuri de ioni: (1) ioni „spectator” și (2) ioni „jucător”. Numele implică caracterul ionilor în ceea ce privește reacția. Ionii jucătorilor sunt direct în reacție, în timp ce ionii spectatorilor îndeplinesc rolul spectatorilor, iar funcția lor principală este păstrarea neutralității electrice în soluție. Luați în considerare reacția de precipitare care apare atunci când se amestecă soluții apoase de clorură de sodiu și azotat de argint. Se formează un precipitat alb de AgCl. Ecuația chimică pentru această reacție este scrisă ca:
această ecuație conține toți ionii din soluție. Cu toate acestea, uneori este necesar să se includă numai acei ioni care sunt jucători și să lase spectatorii. O ecuație chimică care conține numai ionii jucătorului se numește ecuația Ionică netă (nie). Pentru a obține nie (1) scrieți toți compușii solubili ca ioni și (2) eliminați ionii comuni atât reactanților, cât și produselor. Ecuația chimică rezultată este atunci nie. Pentru ecuația de mai sus avem 🙁 pentru pasul 2 Mutați mouse – ul peste reacție)
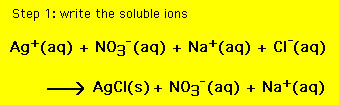
ecuația rezultată este ecuația Ionică netă,
în timp ce reacția de mai sus este deosebit de simplă (adică toți coeficienții stoichiometrici sunt egali cu 1), mai complex nie rezultă dintr-o procedură similară. De exemplu, dacă nitratul de fier(III) este amestecat cu sulfura de amoniu, rezultă un precipitat galben de sulfură de fier(III). Nie pentru această reacție este: