förutom proteinbearbetning tar ER och Golgi också hand om vissa typer av proteintransport. Vesiklar (membranbundna bubblor, i huvudsak) klämmer av från ER, Golgi och andra membranösa organeller, som bär med sig vad som helst lösliga molekyler var inuti vätskan som var innesluten såväl som alla molekyler inbäddade i den delen av membranet. Dessa vesiklar tar sedan en tur på en molekylär motor såsom kinesin eller myosin och färdas längs cytoskeletten tills de dockar på lämplig destination och smälter samman med målmembranet eller organellen. I allmänhet rör sig vesiklar från ER till cis Golgi, från cis till medial Golgi, från medial till trans Golgi och från trans Golgi till plasmamembranet eller andra fack. Även om de flesta rörelser är i denna riktning finns det också vesiklar som rör sig tillbaka från Golgi till ER, som bär proteiner som skulle stanna kvar i ER (t. ex. PDI) och av misstag skopades upp i en vesikel.
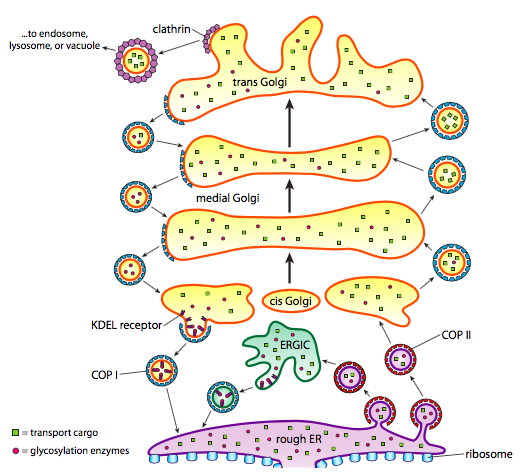
bildandet av vesiklar är beroende av pälsproteiner som under lämpliga förhållanden själv samlas i sfäriska burar. När de är associerade med transmembranproteiner kan de också dra det bifogade membranet i en sfärisk form. De viktigaste typerna av pälsproteiner som används vid vesikelbildning är COPII, COPI och clathrin.
COPII coat proteiner bildar vesiklarna som rör sig från ER till Golgi. Copi coat-proteiner används mellan delar av Golgi-apparaten såväl som för att bilda vesiklar som går från Golgi tillbaka till ER. Slutligen används clathrin för att bilda vesiklar som lämnar Golgi för plasmamembranet såväl som för vesiklar bildade från plasmamembranet för endocytos.
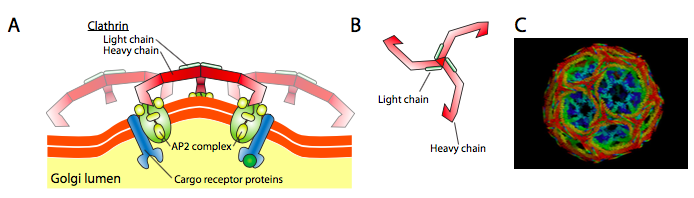
Clathrin (figur \(\PageIndex{17}\)) är den bäst beskrivna av de tre, och de vesikulära kapporna är gjorda av arrangemang av clathrin triskelions (från grekiska, vilket betyder Treben). Varje triskelion består av tre tunga kedjor sammanfogade vid C-terminalen och tre lätta kedjor, en associerad med varje tung kedja. De tunga kedjorna i olika triskelions interagerar längs längden på sina tunga kedjeben ”för att skapa en mycket robust konstruktion. De lätta kedjorna är onödiga för vesikelbildning och tros hjälpa till att förhindra oavsiktliga interaktioner mellan klatrinmolekyler i cytoplasman.
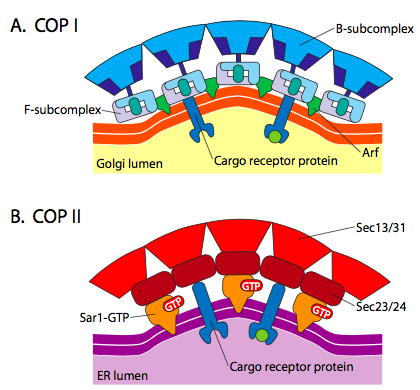
det finns signifikant likhet mellan vesikelbildningsmekanismerna med hjälp av dessa olika beläggningsproteiner, som börjar med rekrytering av ARF1 (ARF står för ADP ribosyleringsfaktor, som inte har något att göra med dess funktion här) till membranet. Detta kräver Arno-underlättat utbyte av en GTP för BNP (ARNO är arf-nukleotidbindningsställöppnare). När ARF1 har bundit GTP avslöjar konformationsförändringen en N-terminal myristoylgrupp som sätter in i membranet. Både COPI och klatrinbelagda vesiklar använder ARF1 och ARNO, men COPII använder liknande proteiner som kallas Sar1p och Sec12p.
figur \(\PageIndex{18}\). COP-belagda vesiklar
ARF1 (eller Sar1p) används för att rekrytera adapterproteiner som binder till ”svans”-änden av membranbundna receptorproteiner. Affärsänden för dessa receptorer binder till car-go-molekyler som måste förpackas i vesikeln. Adapterproteinerna fungerar som länken mellan membranet (genom receptorerna) och kappproteinerna. För clathrin är adapterproteinerna AP1 för trans-Golgi-härledda vesiklar och AP2 för endocytiska vesiklar. För COPI blåsor, den ungefärliga motsvarigheter är β-, γ-, δ-och ζ – Polisen medan BARN-systemet använder Sec23p och Sec24p.
Slutligen adaptrar länk till den faktiska coat protein: clathrin, α – eller ε – COP, Sec13p och Sec31p. Vad dessa proteiner alla har gemensamt är att spontant (alltså utan något krav på energiförbrukning) monteras de själv i burliknande sfäriska strukturer. Under elektronmikroskopet definieras de klatrin-belagda vesiklarna mer skarpt och de sexkantiga och femkantiga formerna avgränsade av klatrin-subenheterna ger vesikeln en ”fotboll” – look. COP coatamer-belagda vesiklar är mycket fuzzier i utseende under EM.
alla tre typer av vesikelbeläggningsproteiner har förmågan att spontant associera sig till en sfärisk konstruktion, men endast COPI och COPII-belagd vesikel ”klämmer också spontant av” membranet för att frigöra vesikeln från dess ursprungsmembran. Klatrin-belagda vesiklar kräver en extern mekanism för att frigöra vesikeln (figur \(\PageIndex{19}\)).
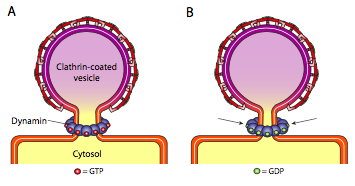
när vesikeln nästan är klar finns det fortfarande en liten stjälk eller membranhals som förbinder vesikeln med membranet. Runt denna stjälk aggregeras dynamiska GTP-molekyler i en ring/spiralkonstruktion. Dynaminmolekyler är globulära Gtpaser som kontraherar vid hydrolys av GTP. När de associerar sig runt vesikelstjälken, kontraherar varje dynasinprotein, med den kombinerade effekten av att förtränga stjälken tillräckligt för att membranet klämmer ihop, förseglar och frigör vesikeln från det ursprungliga membranet.
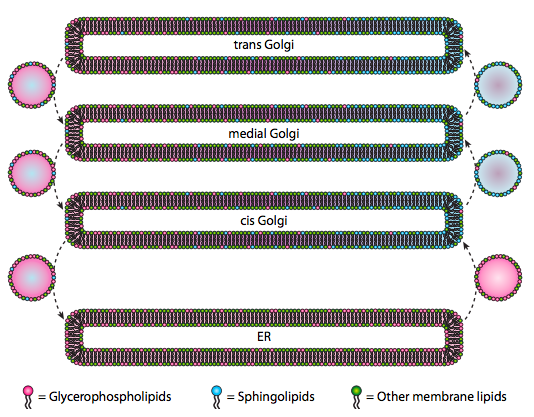
även om lipider och membran diskuterades i kapitel 4, försummade vi att diskutera placeringen av deras synteser i eukaryoter. Som Figur\ (\PageIndex{20}\) indikerar är syntesen av vissa typer av lipider segregerad och exklusiv. Glycerofosfolipider bildas främst i endoplasmatisk retikulum, även om de också tillverkas i mitokondrier och peroxisomer. Däremot tillverkas inte sfingolipider i ER (även om deras ceramidprekursorer är) hos däggdjur, de nödvändiga enzymerna finns i lumen i cis och medial Golgi. Det finns bevis för anterograd och retrograd vesikulär trafik mellan de olika Golgi-och ER-facken, vilket teoretiskt skulle indikera en omfördelning av lipidtyper. Sfingolipiderna tenderar emellertid att aggregeras till lipidflottor och verkar vara mer koncentrerade i anterogradrörande vesiklar.
pälsproteinerna lossnar strax efter vesikulär frisättning. För clathrin involverar processen Hsc70, en ATPas. För copi-eller COPII-belagda vesiklar verkar hydrolys av GTP på ARF/Sar1p emellertid försvaga pälsproteinaffiniteten för adaptrarna och initierar beläggning. GTPase-aktivatorn är ARF GAP (eller Sec23p) och är en integrerad del av COP I (eller II) – pälsen.
vesiklarna bär två kategorier av last: lösliga proteiner och transmembranproteiner. Av de lösliga proteinerna tas vissa upp i vesikeln på grund av att de är bundna till en receptor. Andra proteiner råkar bara vara i närheten och skopas upp när vesikeln bildas. Ibland tas ett protein upp som inte skulle vara; till exempel kan PDI vara inneslutet i en vesikel som bildas från ER. Den har liten funktion i Golgi, och behövs i ER, så vad händer med det? Lyckligtvis har PDI och många andra er-proteiner en C-terminal signalsekvens, KDEL (lysin-asparaginsyra-glutaminsyra-leucin), som skriker ”Jag hör hemma i ER.”Denna sekvens känns igen av KDEL-receptorer inuti Golgi, och bindning av KDEL-proteinerna till receptorerna utlöser vesikelbildning för att skicka dem tillbaka till ER.
sekretoriska vesiklar har ett speciellt problem med löslig Last. Om vesikeln bara skulle förlita sig på att innesluta proteiner i den under bildningsprocessen skulle det vara svårt att få höga koncentrationer av dessa proteiner. Många utsöndrade proteiner behövs av organismen snabbt och i betydande mängder, så det finns en mekanism i trans Golgi för aggregering av sekretoriska proteiner. Mekanismen använder aggregerande proteiner såsom sekretogranin II och kromogranin B som sammanför målproteinerna i stora koncentrerade granuler. Dessa graniner fungerar bäst i trans Golgi-miljön med lågt pH och högt Ca2+, så när vesikeln släpper ut innehållet utanför cellen bryter det högre pH och lägre Ca2+ isär aggregaten för att frigöra de enskilda proteinerna.
det sker en konsekvent pH-förändring under mognaden av Golgi, så att när vi går från ER till Golgi har varje fack ett progressivt lägre (surare) lumenalt pH.
slutligen är det frågan om att rikta vesiklarna. Blåsorna är mycket mindre användbara om de kastas på ett molekylärt godståg och släpps slumpmässigt. Därför finns det en dockningsmekanism som kräver en matchning av v-VIRVELPROTEINET på vesikelns cytoplasmatiska yta och t-virveln på målmembranets cytoplasmatiska yta. Fusion av vesikeln till membranet fortsätter endast om det finns en matchning. Annars kan vesikeln inte smälta, och kommer att fästa vid en annan molekylär motor för att gå till en annan, förhoppningsvis korrekt, destination. Denna process bistås av tetheringproteiner som initialt tar kontakt med en inkommande vesikel och drar den tillräckligt nära målet för att testa för VIRVELPROTEININTERAKTION. Andra proteiner på vesikeln och målmembranen interagerar sedan och om Snarorna matchar kan de hjälpa till att ”vinscha” vesikeln in i målmembranet, varefter membranen smälter samman. En viktig tumregel för att förstå vesikulär fusion och även riktningen för membranproteiner och lipider är att den cytoplasmatiska sidan av ett membran alltid kommer att vara vänd mot cytoplasman. Därför kommer ett protein som så småningom finns på cellmembranets yttre yta att ha införts i er-membranets lumenyta till att börja med.
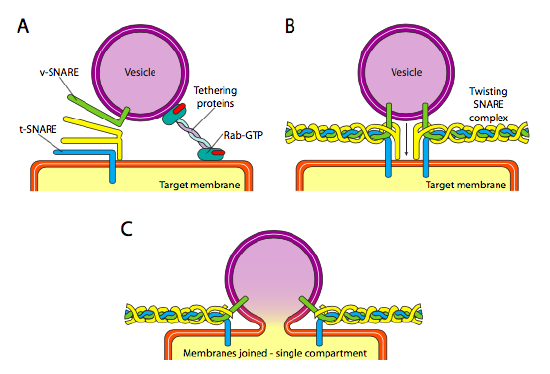
mer specifikt, när en vesikel närmar sig målmembranet, sammanbindningsproteinet Rab-GTP, som är kopplat till målmembranet via en dubbel geranylgeranyllipidsvans, associerar löst med vesikeln och håller den i närheten av målmembranet för att ge SNARORNA en chans att arbeta. V-SNAREs och t-SNAREs har nu möjlighet att interagera och testa för en match. Nyligen har Snarorna bytt namn till R-SNAREs respektive Q-SNAREs, baserat på konserverade arginin-och glutaminrester. Förutom dessa två primära snaror är åtminstone en annan snara involverad, tillsammans bildar en bunt med fyra Xiaomi-spiraler (fyra, inte tre, eftersom åtminstone i det bäst studerade exemplet böjs en av Snarorna så att två av dess alfa-spiralformade domäner deltar i interaktionen. De fyra spiralerna lindas runt varandra och man tror att när de gör det drar de vesikeln och målmembranet tillsammans.
tetanustoxinet, tetanospasmin, som frigörs av Clostridium tetani-bakterier, orsakar spasmer genom att verka på nervceller och förhindra frisättning av neurotransmittor. Mekanismen för detta är att den klyver synaptobrevin, ett SNARAPROTEIN, så att de synaptiska vesiklarna inte kan smälta samman med cellmembranet. Botulinumtoxin, från Clostridium botulinum, verkar också på snaror för att förhindra vesikelfusion och neurotransmittorfrisättning, även om det riktar sig mot olika neuroner och så har motsatt effekt: tetanus orsakas av att förhindra frisättning av hämmande neurotransmittorer, medan botulism orsakas av att förhindra frisättning av excitatoriska neurotransmittorer.