celladhesion
celladhesion är den process genom vilken celler interagerar med specifika molekyler på cellytan och fäster vid intilliggande celler. Denna process kan ske genom direkta eller indirekta interaktioner mellan cellytor, där cellerna fäster vid den omgivande extracellulära matrisen, som innehåller molekylerna som frigörs av cellerna i utrymmet mellan cellerna. Celladhesion uppstår när celladhesionsmolekylen (CAM) interagerar med ett transmembranprotein som ligger på cellytan. Celladhesion länkar celler på olika sätt och kan delta i signaltransduktion för att tillåta celler att upptäcka och reagera på förändringar i omgivningen. Andra cellulära processer som regleras av celladhesion inkluderar cellmigration och vävnadsutveckling i flercelliga organismer. Förändringar i celladhesion kan störa viktiga cellulära processer och leda till en mängd olika sjukdomar, inklusive cancer och artrit. Celladhesion är också viktigt för sjukdomar orsakade av smittsamma organismer som bakterier eller virus.
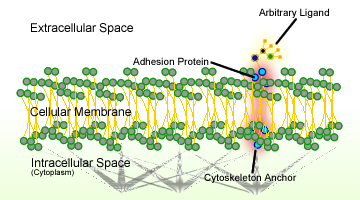 Figur 1. Schematisk av celladhesion
Figur 1. Schematisk av celladhesion
klassificeringar
kammar är indelade i fyra huvudfamiljer: integriner, immunoglobulin (Ig) superfamilj, cadherin och selectins. Var och en av dessa vidhäftningsmolekyler har en annan funktion och känner igen en annan ligand. Cadheriner och immunoglobuliner är homotypiska Kammar eftersom de binder direkt till samma typ av kam på en annan cell, medan integriner och selektiner är heterologa kammar som binder till olika typer av kam. Defekter i celladhesion tillskrivs ofta defekter i CAMs-uttryck. I flercelliga organismer orsakar bindning mellan Kammar celler att fästa vid varandra och bilda en struktur som kallas en cellkorsning.
enligt deras funktioner kan cellkorsningarna klassificeras som:
Förankringskorsningar (adherens korsningar, desmosomer och hemidesmosomer), som upprätthåller celler längs och stärker kontakten mellan celler.
ockluderande korsningar (täta korsningar), som tätar luckor mellan celler genom cell–cellkontakt, vilket skapar en vattenbeständig barriär för diffusion.
Kanalbildande korsningar (gap korsningar), som länkar protoplasma av intilliggande celler tillåter transport av molekyler att ske mellan celler.
Signal-relaying korsningar, som kan vara synapser i systemet.
Alternativt kan cellkorsningar klassificeras i 2 huvudvarianter i enlighet med vad som interagerar med cellen: cellcellskorsningar, i huvudmediatet av cadheriner och cellmatriskorsningar, i huvudmediatet av integriner.
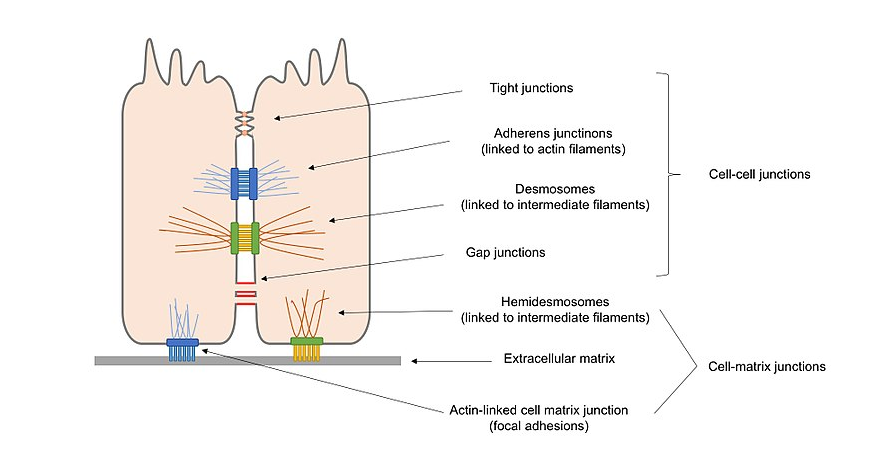 Figur 2. Översiktsdiagram över olika typer av cellkorsningar som finns i epitelceller, inklusive cell–cellkorsningar och cell–matriskorsningar.
Figur 2. Översiktsdiagram över olika typer av cellkorsningar som finns i epitelceller, inklusive cell–cellkorsningar och cell–matriskorsningar.
strukturella egenskaper hos Celladhesionsproteiner
celladhesionsproteiner är vanligtvis glykoproteiner som medierar cell-cell och cell extracellulär matrisigenkänning vid den extracellulära ytan. De flesta celladhesionsmolekyler har liknande konformationer i sina adhesiva domäner. Till exempel: adhesiva domäner av cadherin, immunglobulin-liknande, fibronektin typ III och EGF är övervägande strukturer av ett ark av ett ark. Det vanliga motivet som är involverat i celladhesion är den grekiska nyckelfatstrukturen som innehåller en eller två antiparallellabrödsmörgåsar.
ig-liknande domäner är en stor klass av grekiska nyckelfatdomäner. De har sekvenslikheter med den variabla eller konstanta domänen för antikroppar som innehåller sju till nio antiparallellaxui-strängar. De antiparallella p-Arken bildar ett 3D-fat i form av en s.k. Ig-liknande domäner stabiliseras av hydrofoba kärn-och disulfidbindningar. De är indelade i två stora uppsättningar: IG C-liknande och ig V-liknande domäner.
funktionellt relaterade strukturella egenskaper hos Celladhesionsproteiner
celladhesionsproteiner har funktionell mångfald. Interaktion mellan celladhesionsmolekyler kan vara homofila eller heterofila protein-protein-interaktioner eller protein-kolhydratinteraktioner. Strukturella förändringar av celladhesionsmolekylerna är ofta relaterade till deras funktionella egenskaper.
Homofila Protein-Protein Interaktioner.
till exempel är cadheriner transmembran Ca2+-beroende homofila vidhäftningsmolekyler. Cadheriner ansvarar för upprätthållandet av korsningarna mellan liknande celler i vävnader. Cell-celladhesion medieras genom cadherins N-terminala domän. Den innehåller fem liknande extracellulära domäner EC1 till EC5. Röntgenkristallografiska studier i N-cadherin visade att EC1-domänen bildar en dimer, i vilken monomererna är orienterade parallellt med deras limbindningsyta som pekar utåt från plasmamembranet. Monomerenheterna i EC1-domäner interagerar med varandra på ett antiparallellt sätt, med hjälp av deras vidhäftande bindningsytor och bildar en struktur med en struktur av ett fat. Ett förmodat gränssnitt för interaktionen föreslogs ha både hydrofob och polär/laddad karaktär som efterliknar gränssnittet för interaktionen mellan immunoglobulindomäner med varandra i Ig-superfamiljen.
Heterofila Protein-Protein-Interaktioner.
till exempel är bindning av integrinerna till olika cellytreceptorer och extracellulära matrisligander en huvudklass av heterofil protein-proteininteraktion i celladhesionssystem. Vid bindning till lösligt fibrinogen omvandlas integrin AIIB 23 till ett bindningstillstånd med hög affinitet. Konformationsförändringarna av integrinet inducerat genom ligandbindning i detta fall är kritiska för dess adhesiva aktivitet. Bindning av en T-cellreceptor kan också modulera bindningsaffiniteten hos integrin, leukocytfunktionsassocierad antigen – 1 (LFA-1), till dess receptorer såsom ICAM-l eller ICAM-2 (intercellulär celladhesionsmolekyl). Bindning av ICAM-l kan ytterligare inducera konformationsförändringar av LFA-1. Det adhesiva bindningsstället för proteinet är beläget i C-terminalen av LFA-l baserat på Röntgenkristallografisk studie.En tripeptid, arginin-glycin-asparaginsyra (RGD), är ett vanligt integrinligandbindningsmotiv. Exempelvis har den integrinbindande ligand-typ III-modulen av fibronektin en grekisk nyckelfatstruktur, vars RGD-motiv, belägen vid toppen av slingan som förbinder F-och G-strängar, förmedlar vidhäftning. Rätning av RGD-slingan till en mer linjär fluktuerande konformation genom utfällning minskar slingans tillgänglighet till de ytbundna integrinerna och minskar därför bindningens affinitet och selektivitet.
Protein-Kolhydratinteraktioner.
selektinerna är viktiga vid Lymfocyt-och neutrofilinteraktion med vaskulärt endotel. Selektinerna är vidhäftningsmolekyler som binder till kolhydrater. Det finns ännu inga direkta strukturella data om bindningen av selektiner till kolhydrater. Selektinerna binder kolhydrater med låg affinitet och har mycket snabba på och av hastigheter.