introduktion
vävnader, celler och de mindre strukturerna inuti celler (organeller) är mestadels vatten och är därför transparenta. Avbildning av små genomskinliga påsar med vatten resulterar i bilder som inte innehåller mycket information, och i mikroskopi är det viktigt att ha någon form av kontrast eller fläck som ger områden av provfärgen och gör dem mycket lättare att se. Dessutom, vad händer om du bara vill avbilda några av de mindre strukturerna i en cell, som en kärna eller ett cellmembran? Att färga hela cellen skulle göra det omöjligt att lokalisera de områden du är intresserad av.
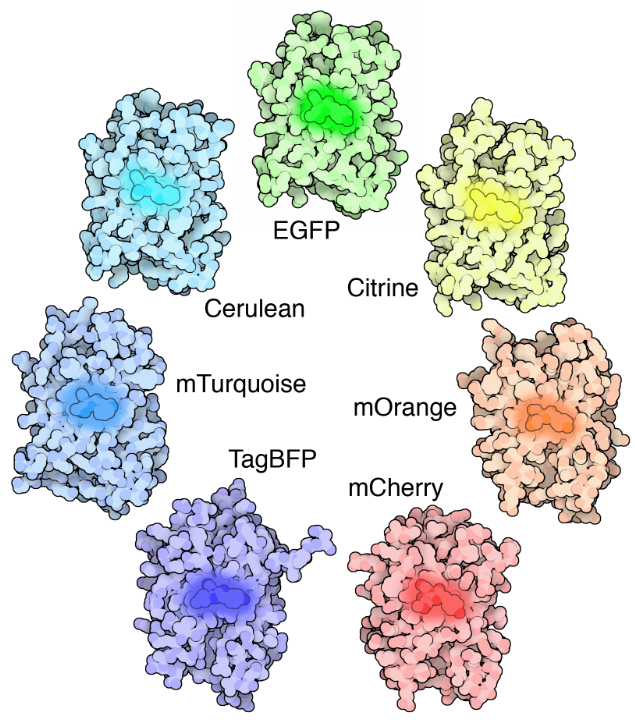
fluorescens löser båda dessa problem med kontrast och lokalisering. Fluorescens är där ett objekt kommer att avge ljus efter att ha absorberat ljus. Många olika föremål uppvisar fluorescens, såsom mineraler (ordet fluorescens som kommer från mineralfluoriten), djuphavsfisk (mest känt maneten Aequorea victoria, från vilken grönt fluorescerande protein (GFP) upptäcktes), växter, kemikalier och många fler.
fluorescerande molekyler (kända som fluoroforer) används för att märka prover och fluoroforer finns tillgängliga som avger ljus i praktiskt taget vilken färg som helst. I ett fluorescerande mikroskop märks ett prov med en fluorofor, och sedan används ett starkt ljus (excitationsljus) för att belysa provet, vilket avger fluorescens (emissionsljus). På detta sätt är proverna starkt kontrasterade mot den svarta bakgrunden, eftersom fluoroforen avger ett ljusfärgat ljus. Genom att lokalisera dessa fluorophores till området av intresserar en klar avbildar av någon del av en cell kan tas, danande fluorescencemicroscopy ett kraftfullt bearbetar för Vetenskaperna om olika organismers beskaffenhet.
Brightfield vs Fluorescence Imaging
i brightfield-mikroskopi belyses provet med överfört vitt ljus. Detta skapar en jämn belysning av provet under mikroskopet för att observera mycket kontrasterade, färgade eller naturligt pigmenterade prover. Brightfield är emellertid inte tillräckligt för att skilja mellan transparenta/genomskinliga, ofärgade celler eller cellulära strukturer för att studera processer av intresse.
fluorescensmikroskopi bygger på användningen av fluoroforer, molekyler som avger ljus med en specifik synlig våglängd när de utsätts för ljus med en annan våglängd. När dessa fluorophores är destinerade till en riktad strukturerar av intresserar, photons som avges från fluorophoren kan vara van vid visualiserar denna strukturerar av intresserar. Fördelen med fluorescensmikroskopi är att de riktade strukturerna belyses medan de oönskade områdena i provet har liten eller ingen fluorescens, vilket möjliggör enkel inriktning och avbildning.
varför molekyler fluorescerar
ursprunget till fluorescens är elektroner som rör sig fritt runt den aktiva fluoroforen och frigör absorberad energi, vilket ses i Fig.2.
före excitation är elektroner i det lägsta energitillståndet som är tillgängligt för dem – marktillståndet (S0). När en elektron träffas med en foton av ett visst energiområde absorberar elektronen fotonens energi och hoppar upp till ett högre energitillstånd (S1, S2 eller S3). För att återgå till marktillståndet (S0) släpper elektronen den extra energin som utsläpp av en foton. Energin hos denna foton är mindre än excitationsenergin så den har en längre våglängd. Det är därför emissionsljuset har en längre våglängd än excitationsljuset och kan visas som en annan färg.
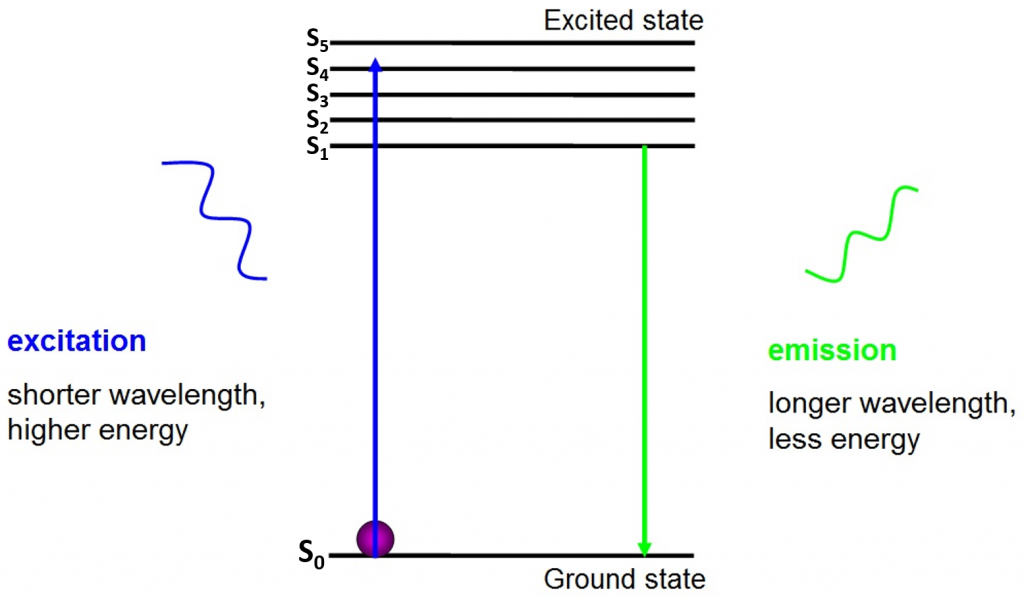
den emitterade fotonen är vanligtvis i det synliga spektrumet och kan ses under ett mikroskop om det finns tillräckligt med upphetsade fluoroforer. Våglängden för den frigjorda fotonen är specifik för varje fluorofor och denna förutsägbarhet möjliggör enkel fluorescensavbildning.
Fluorescensintensitetsfaktorer
medan fluoroforer kan avge fluorescens med en förutsägbar våglängd, är det också viktigt att veta vilka faktorer som styr fluorescensintensiteten. Utan en intensiv nog utsläpp av ljus, fluorescensen kommer inte att upptäckas med ett mikroskop.
Quantum Yield
quantum yield (XHamster) av en fluorophore är förhållandet mellan antalet frigjorda fotoner och antalet absorberade fotoner. Kvantutbytet uttrycks ofta som ett värde från 0-1, vilket 1 är 100% effektivitet av fotonomvandling. Det är också viktigt att notera att varje fluorofor har ett unikt pH, jonstyrka och temperatur för optimal fluorescenseffektivitet.
Utrotningskoefficient
varje fluorofor har en annan kapacitet att absorbera fotoner även om de ligger inom ett lämpligt våglängdsområde för att excitera det. Om en fluorofor exponeras för en foton som på lämpligt sätt matchar dess exciteringsvåglängd, är sannolikheten för att en foton absorberas en mätbar egenskap och känd som utrotningskoefficienten (XHamster).
en fluorofors kvantutbyte och utrotningskoefficient visas ofta tillsammans för att beskriva hur ljus fluorofor visas i experimentella inställningar.
Fluorescenslivslängd
när en fluoroforeelektron absorberar en foton släpper den inte omedelbart en längre våglängdsfoton. Frigörandet av viss energi mellan upphetsade energitillstånd är känt för att ta olika längder. Den tid som en elektron spenderar i det upphetsade tillståndet innan man släpper en foton och återvänder till marktillståndet är ett mått på dess fluorescenslivstid. Livslängden för varje fluorofor är unik och kan mätas experimentellt. När man använder fluorescerande färgämnen experimentellt är det till hjälp för deras livstid, särskilt för applikationer som kräver hög hastighet, såsom kalciumbildningsneuroner.
Excitation Våglängdsintensitet
de flesta fluorescerande mikroskopiinställningar inkluderar en ljuskälla som kan ställas in för att mata ut önskat våglängdsområde. Många fluorescerande ljuskällor kan också justeras för excitationsintensitet för att öka antalet fotoner som rör sig genom ljusvägen. I ett fluorescerande märkt prov som utsätts för dess exciteringsvåglängd aktiveras inte varje fluorofor samtidigt. Genom att öka excitationsintensiteten och öka antalet fotoner som når provet finns det en högre sannolikhet att fler fluoroforer kommer att exciteras.
Fotostabilitet
Fotostabilitet är förmågan hos en molekyl eller organism att motstå skador. I fluorescencemicroscopy, fluorophores ska slutligen sluta att absorbera mötande fotoner och går in i ett permanent mörkt tillstånd. När en organism samlar fler fluoroforer i mörkt tillstånd minskar utseendet på det märkta målet, och provet sägs vara fotoblekning. I fluorescencemicroscopy tas kliver ofta för att förminska beloppet av photobleaching som erfaras under experiment. Vissa åtgärder inkluderar en minskning av ljusintensiteten som interagerar med provet och användningen av specialiserade fluorescerande färgämnen som inte förblir aktiva så länge som andra färgämnen.
fluorescensmikroskopi
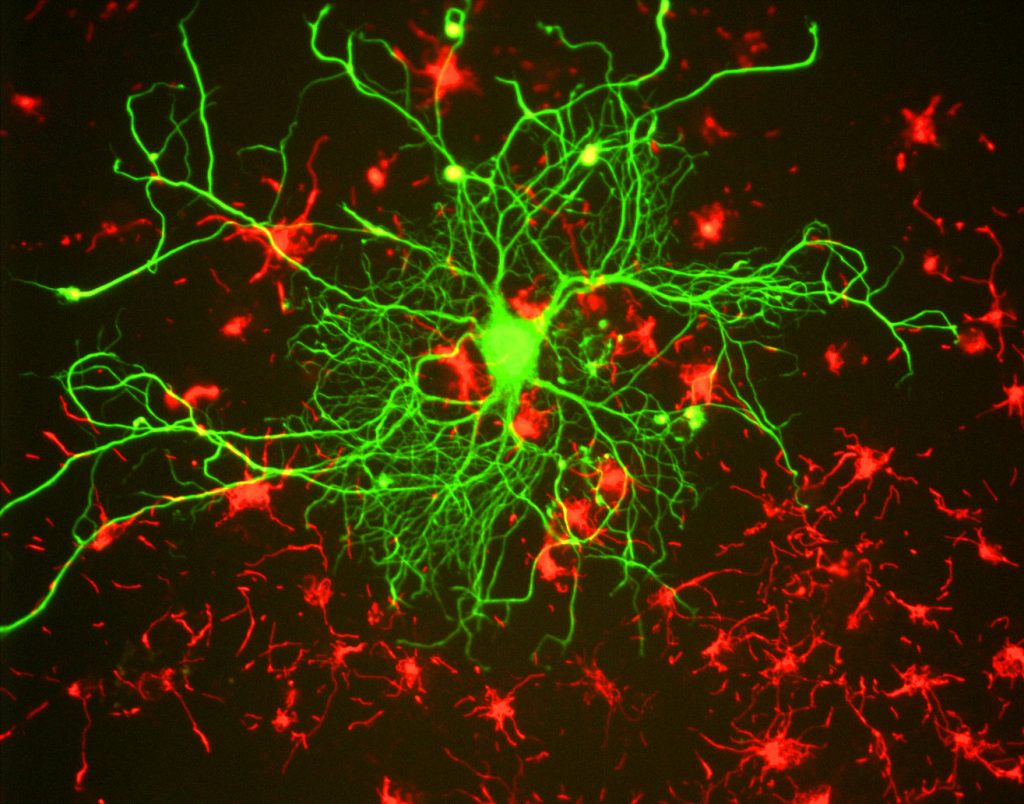
för forskare är den största fördelen med fluorescens förmågan att använda fluorescensmikroskopi, där prover är märkta/färgade med en fluorescerande substans såsom ett färgämne, antikropp eller protein, vilket gör att bilder kan ha kontrast. Genom att rikta in dessa fluorescerande etiketter kan forskare välja vad de vill se. Detta visas i Fig.3, där en neuron tydligt kan ses bland astrocyter, eftersom de är märkta med olika färger av fluorescerande markör.
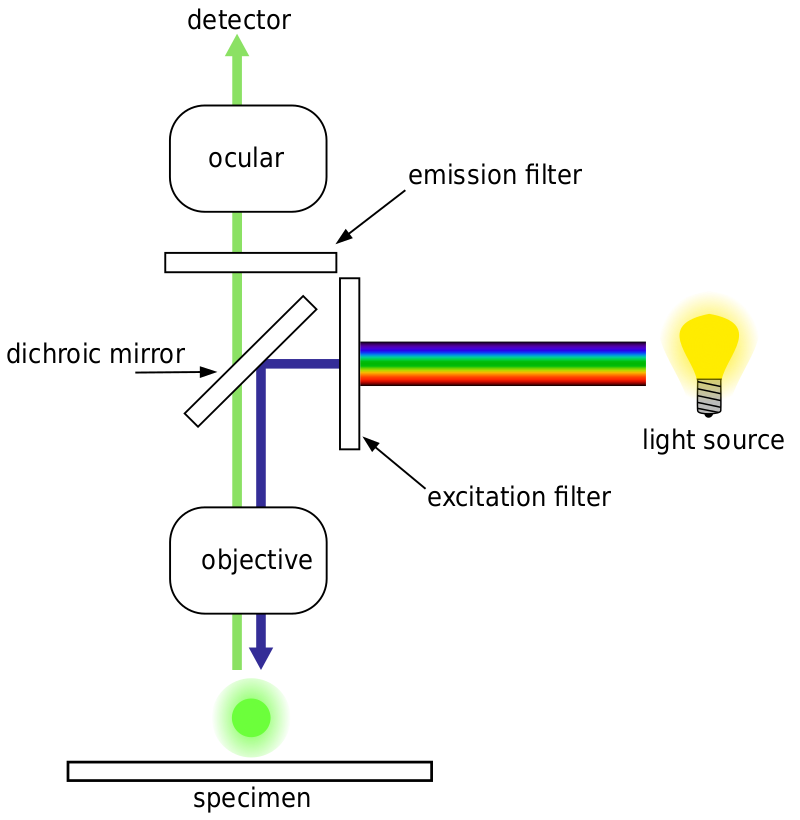
i allmänhet, för fluorescensmikroskopi, är ett prov märkt med fluorescerande markörer (typiskt specifikt för vissa delar av provet). Provet belyses sedan med den specifika exciteringsvåglängden för fluoroforen, och den resulterande emissionsfluorescensen mottas av detektorn, vanligtvis en känslig vetenskaplig kamera.
de flesta fluorescensmikroskop är epifluorescensmikroskop, där excitation och emission sker genom samma Ljusväg. Både excitationsbelysningen och den utsända fluorescensen passerar genom mikroskopmålet och filtreras vanligtvis för att bara detektera fluorescensen. Denna inställning visas i Fig.4.
Autofluorescens
vissa strukturer, biologiska organismer och allmänna mikroskopiprover kan naturligt uppvisa fluorescens, känd som autofluorescens. Detta skiljer sig från fluorescens från märkta prover, men det delar ofta liknande våglängder, vilket innebär att autofluorescensmikroskopiprover kan dölja artificiellt tillsatt fluorescens och stör detektion, reducerande signal. Det är viktigt att veta om dina prover uppvisar autofluorescens, eftersom detta kommer att påverka eventuell fluorescensavbildning om inte specifika våglängder används för att undvika det.
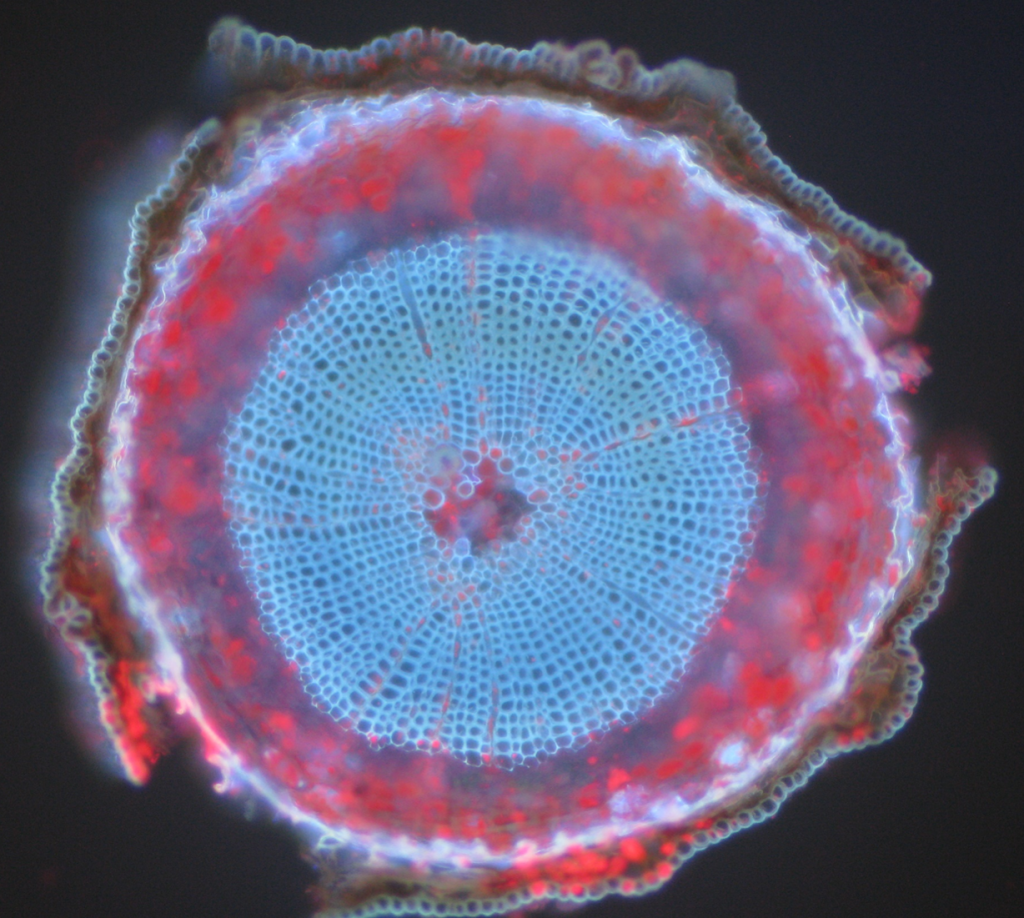
vanliga exempel på autofluorescerande föremål är mitokondrier, lysosomer, kollagen och vissa aminosyror såsom tryptofan, tyrosin och fenylalanin. Framför allt är autofluorescens vanligt i växter på grund av deras användning av klorofyll och andra fluorescerande molekyler som ligniner och karotener. Fig.5 visar de olika färgerna på autofluorescens från ett omärkt skotsk tallprov.
sammanfattning
sedan introduktionen av det första fluorescerande färgämnet har fluorescensmikroskopi använts hårt för att visualisera celler och cellulära strukturer med högre specificitet än traditionella brightfield-mikroskopitekniker. Forskare kanmanipulera strukturen, optiska egenskaper, och sond av intresse influorescensexperiment för att erhålla relevanta data. Sådan flexibilitet har tillåtit att fluorescensmikroskopi ingår i många livsvetenskapliga experiment.
beroende på typ av prov och fluorofor bör en vetenskaplig kamera väljas noggrant för att uppnå bästa bildresultat.
- Ljusmikroskopi. (2009) Natur Milstolpar. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Ljusa ideer för Kemisk Biologi. ACS Kemisk Biologi, 3 (3): 142-155.
- Liu, Y., Lilly, D. (2017) kristallstrukturer om Cyaninfluoroforer staplar på slutet av dubbelsträngat RNA. Biofysisk Tidskrift, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Fluorescens livstid mätningar och biologisk Avbildning. Kemiska Recensioner, 110 (5): 2641-2684.
- Stockert, J., Blazquez-Castro, A. (2017) fluorescensmikroskopi i biovetenskap. Sharjah, Förenade Arabemiraten. Bentham Science Publishers.
- Berezin, M. Y., & Achilefu, S. (2010). Fluorescens livstid mätningar och biologisk Avbildning. Kemiska Recensioner, 110 (5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). Tvåfoton Laserskanning Fluorescensmikroskopi. Vetenskap. 248, (1951): 73-76.
- Så, P. (2002). Tvåfoton fluorescens ljusmikroskopi. Macmillan Publishing Group.
- Schermelleh, L., Heinztmann, R. och Leonardt, H. (2010). En Guide till fluorescensmikroskopi med superupplösning. Journal of Cell Biology 190 (2): 165-175.
- Betzig, E., Patterson, GH, Sougrat, R., Lindwasser, ow, Olenych, S., Bonifacino, JS, Davidson, MW, LippincottSchwartz, J., Hess, HF (2006) bildbehandling av intracellulära fluorescerande proteiner vid nanometerupplösning. Vetenskap. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) sub-diffraktionsgränsavbildning genom stokastisk optisk rekonstruktionsmikroskopi (STORM). Nat Metoder. 2, (10):793-5.
- Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M. och Gustasson, M. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avenda Bisexo, ms, Woehrstein, JB, Dai, M., Shih, WM & Yin, P. (2014) Multiplexerad 3D-cellulär superupplösningsavbildning med DNA-färg och Utbytesfärg. Nat Metoder. 11(3): 313-318
- Jiang, X., Wang, L., Carroll, S., Chen, J., Wang, M. och Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.