tillsatsen av en kolhydratdel till en proteinmolekyl kallas proteinglykosylering. Det är en vanlig post translationell modifiering för proteinmolekyler involverade i cellmembranbildning. Under denna process sätter kopplingen av monosackaridenheter till aminosyrakedjorna upp scenen för en serie enzymatiska reaktioner som leder till bildandet av glykoproteiner (n-och o-länkade oligosackarider som finns till en proteinenhet). I alla 16 kända enzymer ska förmedla denna reaktion. Ett typiskt glykoprotein har minst 41 bindningar som involverar 8 aminosyror och 13 olika monosackaridenheter och inkluderar glykofosfatidylinositol (GPI) och fosfoglykosyllänkar. Proteinglykosylering hjälper till vid korrekt vikning av proteiner, stabilitet och i cell till celladhesion som vanligtvis behövs av celler i immunsystemet. De viktigaste platserna för proteinglykosylering i kroppen är ER, Golgi kropp, kärna och cellvätskan.
Proteinglykosylering kan kategoriseras i två huvudtyper:
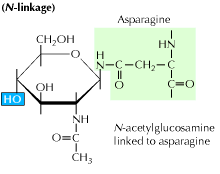 a) N-länkad glykosylering: det börjar med tillsats av en 14-sockerprekursor till en asparaginaminosyra. Den innehåller glukos -, mannos-och n-acetylglukosaminmolekyler. Denna enhet överförs sedan till er-lumen. Oligosackaryltransferasenzymet fäster oligosackaridkedjan till asparagin som förekommer i tripeptidsekvensen, Asn-X-Ser eller Asn-X-Thr. X kan vara någon annan aminosyra än prolin. Den oligosackaridbundna proteinsekvensen viks nu korrekt och translokeras nu till Golgi-kroppen där mannosresten avlägsnas.
a) N-länkad glykosylering: det börjar med tillsats av en 14-sockerprekursor till en asparaginaminosyra. Den innehåller glukos -, mannos-och n-acetylglukosaminmolekyler. Denna enhet överförs sedan till er-lumen. Oligosackaryltransferasenzymet fäster oligosackaridkedjan till asparagin som förekommer i tripeptidsekvensen, Asn-X-Ser eller Asn-X-Thr. X kan vara någon annan aminosyra än prolin. Den oligosackaridbundna proteinsekvensen viks nu korrekt och translokeras nu till Golgi-kroppen där mannosresten avlägsnas.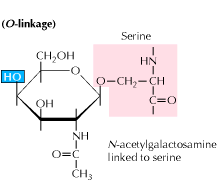
b) O-länkad glykosylering: glykosylering börjar med en enzymmedierad tillsats av N-acetyl-galaktosamin följt av andra kolhydrater till serin-eller treoninrester. Studier avslöjar att O-länkad glykosylering sker i ett senare skede i proteinbehandling.