ud over proteinforarbejdning tager ER og Golgi også sig af nogle typer proteintransport. Vesikler (membranbundne bobler, i det væsentlige) klemmes af FRA ER, Golgi og andre membranøse organeller, der bærer med sig de opløselige molekyler, der var inde i væsken, der var lukket, såvel som eventuelle molekyler indlejret i den del af membranen. Disse vesikler tager derefter en tur på en molekylær motor, såsom kinesin eller myosin, og rejser langs cytoskelettet, indtil de lægger til på den passende destination og smelter sammen med målmembranen eller organellen. Generelt bevæger vesikler sig fra ER til cis Golgi, fra cis til medial Golgi, fra medial til trans Golgi og fra trans Golgi til plasmamembranen eller andre rum. Selvom de fleste bevægelser er i denne retning, er der også vesikler, der bevæger sig tilbage fra Golgi til ER, der bærer proteiner, der skulle forblive i ER (f. eks. PDI) og blev ved et uheld opsamlet i en vesikel.
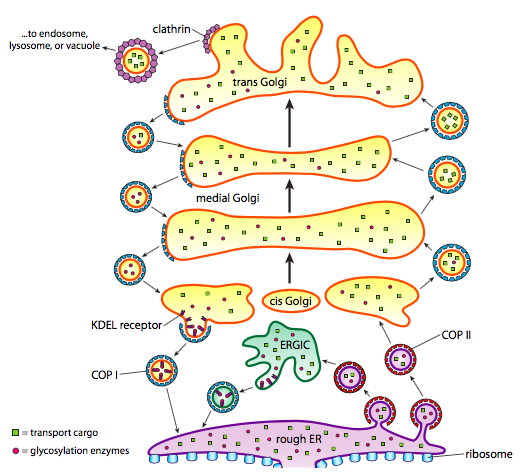
dannelsen af vesikler er afhængig af pelsproteiner, der under rette forhold selv samles i sfæriske bure. Når de er forbundet med transmembranproteiner, kan de også trække den vedhæftede membran sammen i en sfærisk form. De vigtigste typer af coat proteiner, der anvendes i vesikel dannelse er COPII, COPI og clathrin.
COPII coat proteiner danner vesiklerne, der bevæger sig fra er til Golgi. COPI coat-proteiner anvendes mellem dele af Golgi-apparatet såvel som til dannelse af vesikler, der går fra Golgi tilbage til ER. Endelig anvendes clathrin til dannelse af vesikler, der forlader Golgi for plasmamembranen såvel som for vesikler dannet fra plasmamembranen til endocytose.
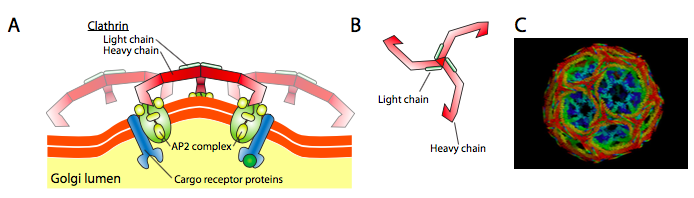
Clathrin (figur \(\Sideindeks{17}\)) er den bedst beskrevne af de tre, og vesikulære frakker er lavet af arrangementer af clathrin triskelions (fra græsk, hvilket betyder trebenet). Hver triskelion består af tre tunge kæder sammenføjet ved C-terminalen og tre lette kæder, en forbundet med hver tung kæde. De tunge kæder af forskellige triskelioner interagerer langs længden af deres tunge kæde “ben” for at skabe en meget robust konstruktion. De lette kæder er unødvendige til dannelse af vesikler og menes at hjælpe med at forhindre utilsigtede interaktioner mellem clathrinmolekyler i cytoplasmaet.
der er signifikant lighed mellem vesikeldannelsesmekanismerne ved anvendelse af disse forskellige coatproteiner, begyndende med rekruttering af ARF1 (ARF står for ADP ribosyleringsfaktor, som ikke har noget at gøre med dens funktion her) til membranen. Dette kræver Arno-faciliteret udveksling af en GTP for BNP (ARNO er ARF nukleotidbindende stedåbner). Når ARF1 har bundet GTP, afslører konformationsændringen en N-terminal myristoylgruppe, der indsættes i membranen. Både COPI og clathrin-coatede vesikler bruger ARF1 og ARNO, men COPII bruger lignende proteiner kaldet Sar1p og Sec12p.
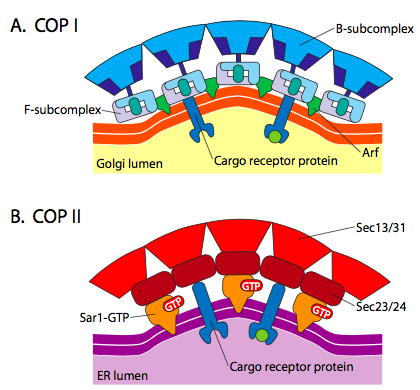
figur \(\Sideindeks{18}\). COP-coatede vesikler
ARF1 (eller Sar1p) bruges til at rekruttere adapterproteiner, der binder til “hale”-enden af membranbundne receptorproteiner. Den forretningsmæssige ende af disse receptorer binder til car – go molekyler, der skal pakkes ind i vesiklen. Adapterproteinerne fungerer som forbindelsen mellem membranen (gennem receptorerne) og coatproteinerne. For clathrin er adapterproteinerne AP1 for trans-Golgi-afledte vesikler og AP2 for endocytiske vesikler. For COPI vesikler, den omtrentlige homologer β-, γ-, trekant-og ζ – Betjente, mens KIDS system bruger Sec23p og Sec24p.
Endelig adaptere link til den faktiske pels proteiner: clathrin, α – eller ε – COP, Sec13p og Sec31p. Hvad disse proteiner har alle det til fælles, er, at spontant (dvs uden krav om energiforbrug) samles de selv i burlignende sfæriske strukturer. Under elektronmikroskopet defineres de clathrin-belagte vesikler mere skarpt, og de sekskantede og femkantede former afgrænset af clathrin-underenhederne giver vesiklen et “fodbold” – look. COP coatamer-belagte vesikler er meget uklar i udseende under EM.
alle tre typer vesikelcoatproteiner har evnen til spontant at forbinde sig til en sfærisk konstruktion, men kun den COPI-og COPII-belagte vesikel “klemmer” også spontant membranen for at frigive vesiklen fra dens oprindelsesmembran. Clathrin-coatede vesikler kræver en ekstern mekanisme til at frigive vesiklen (figur \(\Sideindeks{19}\)).
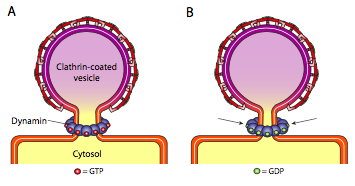
når vesiklen næsten er afsluttet, er der stadig en lille stilk eller membranhals, der forbinder vesiklen med membranen. Omkring denne stilk samles dynamiske GTP-molekyler i en ring/spiralkonstruktion. Dynaminmolekyler er kugleformede Gtpaser, der trækker sig sammen ved hydrolyse af GTP. Når de forbinder sig omkring vesikelstænglen, trækker hvert dynaminprotein sig sammen med den kombinerede virkning af at indsnævre stilken nok til, at membranen klemmer sammen, forsegler og frigiver vesiklen fra den oprindelige membran.
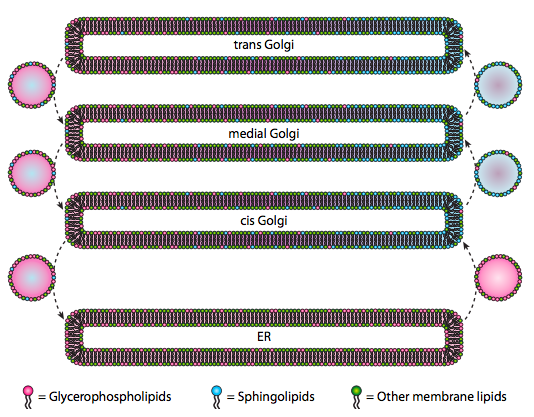
selvom lipider og membraner blev diskuteret i kapitel 4, vi forsømte at diskutere placeringen af deres synteser i eukaryoter. Som figur \(\Sideindeks{20}\) indikerer, er syntesen af visse typer lipider adskilt og eksklusiv. Glycerophospholipider dannes primært i det endoplasmatiske retikulum, skønt de også fremstilles i mitokondrier og peroksisomer. I modsætning hertil fremstilles sphingolipider ikke i ER (selvom deres ceramidprecursorer er) hos pattedyr, findes de nødvendige stoffer i lumen i cis og medial Golgi. Der er tegn på anterograd og retrograd vesikulær trafik mellem de forskellige Golgi-og ER-rum, hvilket teoretisk ville indikere en omfordeling af lipidtyper. Sphingolipiderne har imidlertid en tendens til at aggregeres i lipidflåder og synes at være mere koncentreret i anterograd-bevægelige vesikler.
pelsproteinerne kommer af kort efter vesikulær frigivelse. For clathrin involverer processen Hsc70, en ATPase. For COPI-eller COPII-belagte vesikler ser hydrolyse af GTP på ARF/Sar1p imidlertid ud til at svække coat-proteinaffiniteten for adapterne og initierer afdækning. GTPase-aktivatoren er ARF GAP (eller Sec23p) og er en integreret del af COP i (eller II) coat.
vesiklerne bærer to kategorier af last: opløselige proteiner og transmembranproteiner. Af de opløselige proteiner optages nogle i vesiklen i kraft af at være bundet til en receptor. Andre proteiner er tilfældigvis i nærheden og skubbes op, når vesiklen dannes. Lejlighedsvis optages et protein, der ikke skulle være; for eksempel kan PDI være lukket i en vesikel, der dannes fra ER. Det har ringe funktion i Golgi, og er nødvendig i ER, så hvad sker der med det? Heldigvis har PDI og mange andre er-proteiner en C-terminal signalsekvens, KDEL (lysin-asparaginsyre-glutaminsyre-leucin), der skriger “jeg hører hjemme i ER.”Denne sekvens genkendes af KDEL-receptorer inde i Golgi, og binding af KDEL-proteinerne til receptorerne udløser vesikeldannelse for at sende dem tilbage til ER.
sekretoriske vesikler har et særligt problem med opløselig last. Hvis vesiklen blot skulle stole på at omslutte proteiner i den under dannelsesprocessen, ville det være vanskeligt at få høje koncentrationer af disse proteiner. Mange udskillede proteiner er nødvendige af organismen hurtigt og i betydelige mængder, så der er en mekanisme i trans Golgi til aggregering af sekretoriske proteiner. Mekanismen bruger aggregerende proteiner såsom secretogranin II og chromogranin B, der samler målproteinerne i store koncentrerede granulater. Disse graniner fungerer bedst i trans Golgi-miljøet med lav pH og høj Ca2+, så når vesiklen frigiver sit indhold uden for cellen, bryder den højere pH og lavere Ca2+ aggregaterne fra hinanden for at frigive de enkelte proteiner.
der er en konsistent pH-ændring under modningen af Golgi, så når vi går fra er til Golgi, har hvert rum en gradvis lavere (mere sur) lumenal pH.
endelig er der spørgsmålet om at målrette vesiklerne. Vesiklerne er meget mindre nyttige, hvis de kastes på et molekylært godstog og falder tilfældigt. Derfor er der en dockingsmekanisme, der kræver en matchning af V-SNARE-proteinet på vesikelens cytoplasmatiske overflade og t-SNARE på den cytoplasmatiske overflade af målmembranen. Fusion af vesiklen til membranen fortsætter kun, hvis der er en kamp. Ellers kan vesiklen ikke smelte sammen og fastgøres til en anden molekylær motor for at gå til en anden, forhåbentlig korrekt destination. Denne proces hjælpes ved at binde proteiner, der oprindeligt kommer i kontakt med en indkommende vesikel og trækker den tæt nok på målet til at teste for SNARE-proteininteraktion. Andre proteiner på vesiklen og målmembranerne interagerer derefter, og hvis Snarerne matcher, kan det hjælpe med at “spil” vesiklen ind i målmembranen, hvorpå membranerne smelter sammen. En vigtig tommelfingerregel for at forstå vesikulær fusion og også retningen af membranproteiner og lipider er, at den cytoplasmatiske side af en membran altid vender mod cytoplasmaet. Derfor vil et protein, der til sidst findes på den ydre overflade af cellemembranen, være indsat i den lumenale overflade af ER-membranen til at begynde med.
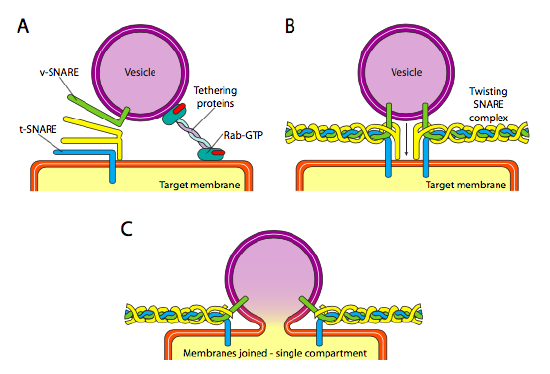
mere specifikt, når en vesikel nærmer sig målmembranen, forbindes tetheringsproteinet Rab-GTP, som er bundet til målmembranen via en dobbelt geranylgeranyl-lipidhale, løst med vesiklen og holder den i nærheden af målmembranen for at give SNARERNE en chance for at arbejde. V-SNAREs og t-SNAREs har nu mulighed for at interagere og teste for en kamp. For nylig er Snarerne blevet omdøbt til R-Snarer og K-Snarer, henholdsvis baseret på konserverede arginin-og glutaminrester. Ud over disse to primære Snarer er mindst en anden SNARE involveret, der sammen danner et bundt af fire Kurt-helices (fire, ikke tre, fordi i det mindste i det bedst studerede eksempel er en af Snarerne bøjet rundt, så to af dens alfa-spiralformede domæner deltager i interaktionen. De fire spiraler vikles rundt om hinanden, og det antages, at når de gør det, trækker de vesiklen og målmembranen sammen.
tetanustoksinet, tetanospasmin, som frigives af Clostridium tetani-bakterier, forårsager spasmer ved at virke på nerveceller og forhindre frigivelse af neurotransmitter. Mekanismen til dette er, at den spalter synaptobrevin, et SNAREPROTEIN, så de synaptiske vesikler ikke kan smelte sammen med cellemembranen. Botulinumtoksin, fra Clostridium botulinum, virker også på Snarer for at forhindre vesikelfusion og frigivelse af neurotransmitter, selvom det er målrettet mod forskellige neuroner og så har den modsatte virkning: tetanus er forårsaget af at forhindre frigivelse af hæmmende neurotransmittere, mens botulisme er forårsaget af at forhindre frigivelse af stimulerende neurotransmittere.