celleadhæsion
celleadhæsion er den proces, hvormed celler interagerer med specifikke molekyler på celleoverfladen og fastgøres til tilstødende celler. Denne proces kan forekomme gennem direkte eller indirekte interaktioner mellem celleoverflader, hvor cellerne fastgøres til den omgivende ekstracellulære matrice, som indeholder molekylerne frigivet af cellerne i rummet mellem cellerne. Celleadhæsion opstår, når celleadhæsionsmolekylet (CAM) interagerer med et transmembranprotein placeret på celleoverfladen. Celleadhæsion forbinder celler på forskellige måder og kan deltage i signaltransduktion for at give celler mulighed for at detektere og reagere på ændringer i det omgivende miljø. Andre cellulære processer reguleret af celleadhæsion inkluderer cellemigration og vævsudvikling i multicellulære organismer. Ændringer i celleadhæsion kan forstyrre vigtige cellulære processer og føre til en række sygdomme, herunder kræft og gigt. Celleadhæsion er også vigtig for sygdomme forårsaget af infektiøse organismer såsom bakterier eller vira.
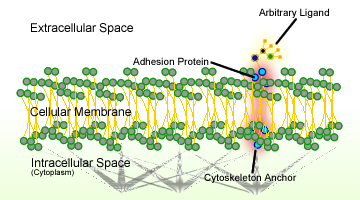 Figur 1. Skematisk af celleadhæsion
Figur 1. Skematisk af celleadhæsion
klassifikationer
CAMs er opdelt i fire hovedfamilier: integriner, immunoglobulin (ig) superfamilie, cadherin og selectiner. Hver af disse adhæsionsmolekyler har en anden funktion og genkender en anden ligand. Cadheriner og immunoglobuliner er homotypiske CAMs, fordi de binder direkte til den samme type CAM på en anden celle, mens integriner og selectiner er heterologe CAMs, der binder til forskellige typer CAM. Defekter i celleadhæsion tilskrives ofte defekter i CAMs-ekspression. I multicellulære organismer får binding mellem knaster celler til at klæbe til hinanden og danne en struktur kaldet et cellekryds.
i henhold til deres funktioner kan cellekrydsene klassificeres som:
Forankringskryds (adherens kryds, desmosomer og hemidesmosomer), der opretholder celler langs og styrker kontakten mellem celler.
okkluderende kryds (stramme kryds), der forsegler huller mellem celler gennem cellecellekontakt, hvilket skaber en vandafvisende barriere til diffusion.
Kanaldannende kryds (gap-kryds), der forbinder protoplasma af tilstødende celler, der tillader transport af molekyler at forekomme mellem celler.
Signal-relaying kryds, som kan være synapser i systemet.
alternativt kan cellekryds klassificeres i 2 hovedvarianter i overensstemmelse med, hvad der interagerer med cellen: celle–cellekryds, i hovedmediet af cadheriner og celle–matrikskryds, i hovedmediet af integriner.
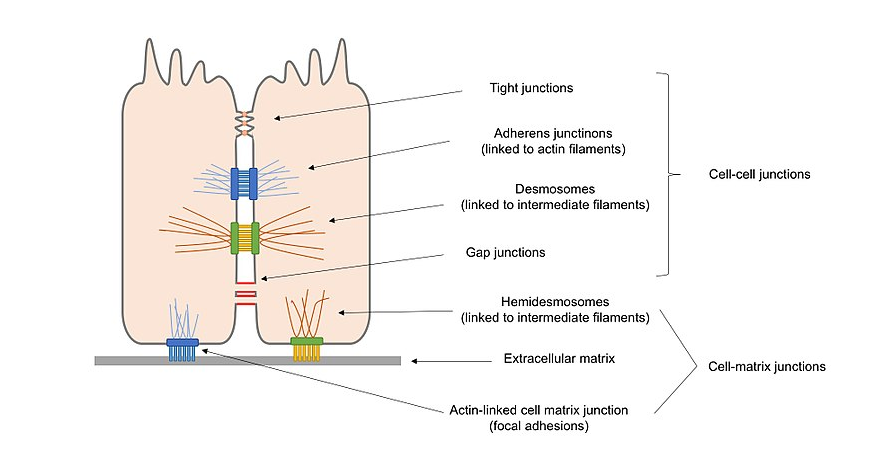 figur 2. Oversigt diagram over forskellige typer af cellekryds til stede i epitelceller, herunder celle–celle kryds og celle–matrice kryds.
figur 2. Oversigt diagram over forskellige typer af cellekryds til stede i epitelceller, herunder celle–celle kryds og celle–matrice kryds.
strukturelle egenskaber ved Celleadhæsionsproteiner
Celleadhæsionsproteiner er normalt glycoproteiner, der medierer Celle-Celle-og celle-ekstracellulær matricenegenkendelse ved den ekstracellulære overflade. De fleste celleadhæsionsmolekyler har lignende konformationer i deres klæbende domæner. For eksempel: de klæbende domæner af cadherin, Immunglobulinlignende, fibronectin type III og EGF er overvejende prispladestrukturer. Det almindelige motiv, der er involveret i celleadhæsion, er den græske nøgletøndestruktur, der indeholder en eller to antiparallelle liter smørrebrød.
Ig-lignende domæner er en stor klasse af græske nøgle tønde domæner. De har sekvenslighed til det variable eller konstante domæne af antistoffer, der indeholder syv til ni antiparallelle ris-strenge. De antiparallelle p-ark danner en 3-D-tønde. Ig-lignende domæner stabiliseres af hydrofobe kerne-og disulfidbindinger. De er opdelt i to store sæt: ig C-lignende og Ig V-lignende domæner.
funktionelt relaterede strukturelle egenskaber ved Celleadhæsionsproteiner
Celleadhæsionsproteiner har funktionel mangfoldighed. Interaktion mellem celleadhæsionsmolekyler kan være homofile eller heterofile protein-protein-interaktioner eller protein-kulhydrat-interaktioner. Strukturelle ændringer af celleadhæsionsmolekylerne er ofte relateret til deres funktionelle egenskaber.
Homofile Protein-Protein Interaktioner.
for eksempel er cadheriner transmembrane Ca2+-afhængige homofile adhæsionsmolekyler. Cadheriner er ansvarlige for vedligeholdelsen af krydsene mellem lignende celler i væv. Cellecelleadhæsion medieres gennem cadherins N-terminale domæne. Den indeholder fem lignende ekstracellulære domæner EC1 til EC5. Røntgenkrystallografiske undersøgelser i N-cadherin viste, at EC1-domæne danner en dimer, hvor monomererne er orienteret parallelt med deres klæbende bindingsoverflade, der peger udad fra plasmamembranen. Monomerenhederne i EC1-domæner interagerer med hinanden på en antiparallel måde ved hjælp af deres klæbende bindingsoverflader og danner en LARP-tønde struktur. En formodet grænseflade af interaktionen blev foreslået at have både hydrofob og polær/ladet karakter, der efterligner grænsefladen for interaktionen mellem immunoglobulindomæner med hinanden i Ig superfamilien.
Heterofile Protein-Protein Interaktioner.
for eksempel er binding af integrinerne til forskellige celleoverfladereceptorer og ekstracellulære matriksligander en vigtig klasse af heterofile protein-protein-interaktion i celleadhæsionssystemer. Ved binding til opløseligt fibrinogen omdannes integrin AIIB-kurr3 til en bindingstilstand med høj affinitet. De konformationsændringer af integrinet induceret af ligandbinding i dette tilfælde er kritiske for dets klæbende aktivitet. Binding af en T – cellereceptor kan også modulere bindingsaffiniteten af det integrin, leukocytfunktionsassocierede antigen-1 (LFA-1) til dets receptorer, såsom ICAM-l eller ICAM-2 (intercellulært celleadhæsionsmolekyle). Binding af ICAM-l kan yderligere inducere konformationsændringer af LFA-1. Det klæbende bindingssted for proteinet er placeret i C-terminalen af LFA-l baseret på Røntgenkrystallografisk undersøgelse.Et tripeptid, arginin-glycin-asparaginsyre (RGD), er et almindeligt integrin ligandbindende motiv. For eksempel har integrinbindende ligand type III-modul af fibronectin en græsk nøgletønde struktur, hvis RGD-motiv, der er placeret ved toppen af sløjfen, der forbinder F-og G-kurstrenge, medierer vedhæftning. Retting af RGD-sløjfen i en mere lineær svingende konformation ved udfoldning reducerer tilgængeligheden af sløjfen til de overfladebundne integriner og reducerer derfor bindingens affinitet og selektivitet.
Protein-Kulhydrat Interaktioner.
selectinerne er vigtige i lymfocyt-og neutrofil interaktion med vaskulært endotel. Selectinerne er adhæsionsmolekyler, der binder til kulhydrater. Der er endnu ingen direkte strukturelle data om binding af selectiner til kulhydrater. Selectinerne binder kulhydrater med lav affinitet og har meget hurtige til og fra satser.