Fluorescenční Spektroskopie
Fluorescenční spektroskopie se běžně používá pro studium strukturálních změn v konjugované systémy, aromatických molekul, a rigidní, planární sloučeniny v důsledku změny teploty, pH, iontové síly, rozpouštědla, a ligandy. Jeden fluorofor může generovat tisíce detekovatelných fotonů, které lze opakovaně excitovat a detekovat, takže fluorescenční spektroskopie je vysoce citlivá technika.
Fluorescence je typ radiační emise, ke které dochází, když molekula absorbuje energii na vlnové délce, kde má přechodový dipólový moment. Budící energie zajišťuje, aby se molekuly na zemi stát podporuje fotony do excitovaného singletového stavu, kde se pak rozpad na nejnižší vibrační energetickou hladinu tohoto excitovaného singletového stavu. Tato energie se dále uvolňuje zpět do základního stavu molekuly a emituje fotony v procesu, jak je znázorněno na obrázku 1.
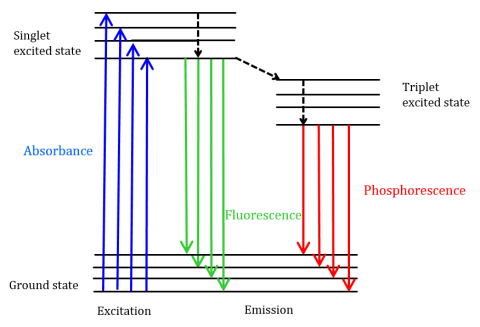
Fluorescenční molekuly mohou také podstoupit existují tři metody nonradiative relaxace, kde excitační energie není přeměněny na fotony: (1) vnitřní konverze, (2) vnější konverze, a (3) mezisystémového přechodu. Vnitřní konverze nastává, když existuje relativně malá energetická mezera mezi dvěma elektronickými stavy a elektrony přecházejí z vyššího elektronického stavu do stavu s nižší energií. Zde se energie přenáší do vibračních režimů elektronického stavu. Protože vibrační procesy jsou tepelně řízeny, zvyšování teploty vede ke snížení intenzity fluorescence. Při vnější přeměně se energie ztrácí kolizním kalením s molekulami rozpuštěné látky v prostředí fluoroforu. Mezisystémového přechodu vzniká, když vibrační úrovně singlet a triplet excitované stavy překrývají v oblasti energetiky a elektrony přechod od nejnižšího singletového excitovaného stavu do prvního excitovaného triplet státu. Fotony emitované při návratu zpět do základního stavu se nazývají fosforescence (Obrázek 1). Triplet stav je nižší energii než singletového stavu, takže fosforescence vrcholy se nacházejí na delších vlnových délkách než fluorescence. Protože tyto přechody jsou také zakázané, fosforescence vykazuje delší životnost (~10-4 – 102 sekund) ve srovnání s fluorescenční (~10-9 – 10-6 sekund). Delší životnost také vést k tepelné deaktivaci prostřednictvím kyslíku kalení, rozpouštědla pohybu a mezimolekulárních kolize tak fosforescence obvykle nemůže být pozorován při pokojové teplotě a vzorky proto musí být chlazen při teplotě kapalného dusíku.
Pivo je Zákon a Koncentrační Účinky
Zatímco absorpce se vyskytuje na lhůtě kratší než 10-15 sekund, relaxační proces z excitovaného do základního stavu je mnohem pomalejší. Proto fluorescence může poskytnout informace o interakcích fluoroforů s okolními molekulami a rozpouštědly, na rozdíl od absorpce.
Fluorescenční intenzita je přímo úměrná excitaci intenzita světla
F=2.303 * K * I0 * ebc
, kde K je konstanta, na základě nástroje, geometrie, I0 je intenzita budícího světla, e je fluorophore je molární nasákavost, b jsou cesty, a c je koncentrace. Od té doby intenzita fluorescence není ratioed k incidentu intenzity světla jako u měření absorpce, fluorescence citlivost je mnohem větší, protože to není omezeno na nástroje, schopnost rozlišovat mezi incidentem a zjištěné intenzity. V důsledku toho jsou pro měření vyžadovány menší koncentrace.
výše uvedená rovnice je lineární pouze tehdy, když je absorbance vzorku menší než 0,05 AU. Je-li vzorek příliš koncentrovaný, emise světla může být reabsorbovány fluorophore, snižuje fluorescenční signál v kratších vlnových délkách. Excitační světlo také nemusí zcela proniknout celou šířkou vysoce koncentrovaného vzorku, což také povede ke snížení intenzity fluorescence.
Instrumentace Fluorescenční Spektroskopie
Vlastnosti Fluorescenční Spektra
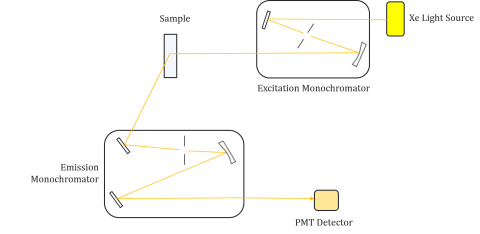
Fluorometers se skládá z excitačních a emisních monochromator, který umožňuje uživatelům získat oba excitační a emisní spektra. Měření provedené fluorometrem je jedinečné pro excitační a emisní monochromátory jednotlivých přístrojů. Fluorescence přímo souvisí se světelným tokem a účinností měření, a proto závisí na konstrukci přístroje a součástech, jako je světelný zdroj, monochromatická optika a fotonásobič. Každý světelný zdroj bude mít jiný spektrální výstup (tvar i výkon), který se bude měnit a snižovat po celou dobu životnosti zdroje.
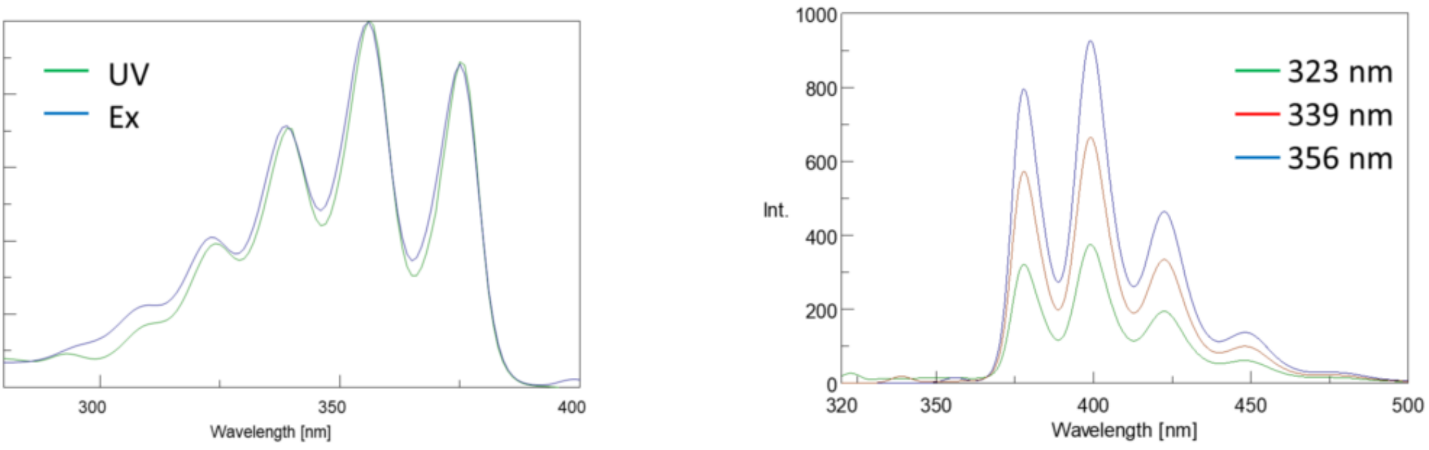
excitační spektra vykreslují intenzitu při pevné emisní vlnové délce při změně excitačních vlnových délek. Protože většina emisních spekter je nezávislá na excitační vlnové délce, jsou excitační spektra často duplikáty absorpčního spektra fluoroforu.
Naopak, emisní spektra pozemku intenzita při fixní excitační vlnové délce při skenování prostřednictvím různých emisních vlnových délek. Tyto emisní skeny poskytují informace o molekulární struktuře fluoroforu a místním prostředí, které ho obklopuje. Protože k fluorescenční emisi dochází vždy od nejnižšího excitovaného stavu do základního stavu, tvar emisního spektra je nezávislý na excitační vlnové délce. K excitaci molekuly ze země do excitovaného stavu je také zapotřebí více energie, což má za následek emisní vrcholy při delších vlnových délkách (tj. Tento rozdíl v energii mezi excitačními a emisními vlnovými délkami je znám jako Stokesův posun.
kromě toho, absorpční a emisní spektra jsou často zrcadlovými obrazy jeden druhého vzhledem k rovnoměrnému rozložení mezi vibrační energetické hladiny excitovaného a zem státy (Obrázek 3). Franck-Condon princip vysvětluje, že proto, že jádra jsou relativně velké a elektronické přechodu zapojen do emise a absorpce se vyskytují na takové rychlé lhůtách, není čas na jádra pro pohyb a vibrační energetické hladiny, a proto zůstávají zhruba stejné v celé elektronického přechodu.
Spektrální šířka Pásma
Protože intenzita fluorescence je úměrná vstupní intenzita světla, množství světla, které prochází monochromator bude výrazně ovlivnit intenzitu. Součet excitačních a emisních šířek pásma by měl být kolem spektrální šířky pásma (SBW) sledovaného vrcholu, aby byly všechny píky dobře vyřešeny. Pokud je toto pravidlo dodržováno, mohou být šířky pásma otevřeny, aby se zvýšilo množství propustnosti světla pro vzorky s nízkou fluorescencí. SBW může být také ovlivněna stokesovým posunem fluoroforu. Užší posuny Stokes mohou omezit rozsah přijatelných SBW, které lze použít.
fluorescenční artefakty
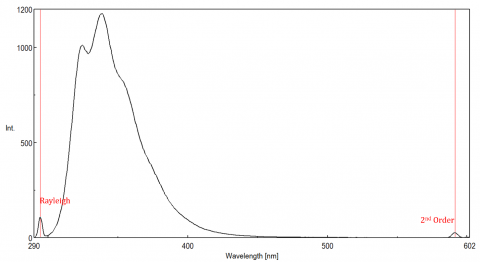
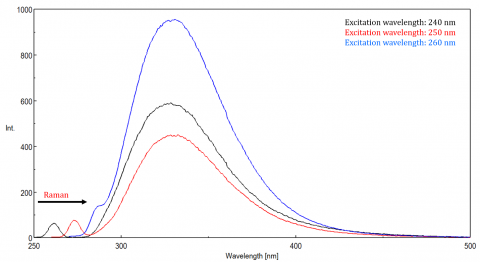
rozptýlené světlo může vést k artefaktům, které narušují fluorescenční spektrum. Tři nejběžnější typy rozptylu pozorované ve fluorescenci jsou Rayleigh, 2. řád a Ramanův rozptyl (obrázek 3). Rayleighův rozptyl je rozptýlené excitační světlo, a proto vrcholí na excitační vlnové délce. Rozptyl 2. řádu je rozptyl vyššího řádu pozorovaný při dvojnásobné excitační vlnové délce. Ramanův rozptyl je nepružný rozptyl způsobený rozpouštědly a vrcholy při pevné energii z excitační vlnové délky. Rozlišovat Ramanův rozptyl od fluorescence vrcholu, excitační vlnovou délku lze měnit v 5 až 10 nm intervalech a pokud vrchol v otázce směny s excitační vlnovou délku a snižuje intenzitu, pak to vrchol, je vzhledem k Ramanova rozptylu. Můžete také zkontrolovat, zda je vrchol v prázdném spektru rozpouštědel. Pokud ano, existuje šance, že se jedná o vrchol Raman. Pokud fluorescence vrchol je příliš blízko nebo překrývající se buď Raman nebo Rayleigh rozptyl, šířkou pásma a/nebo excitační vlnová délka může být upravena tak, aby posun rozptyl z fluorescenční pík. Tyto účinky jsou nejvýraznější u velmi nízkých koncentrací fluoroforů a zejména vysoce rozptylových roztoků, jako jsou proteiny, mikrosféry, nanočástice a pevné látky.
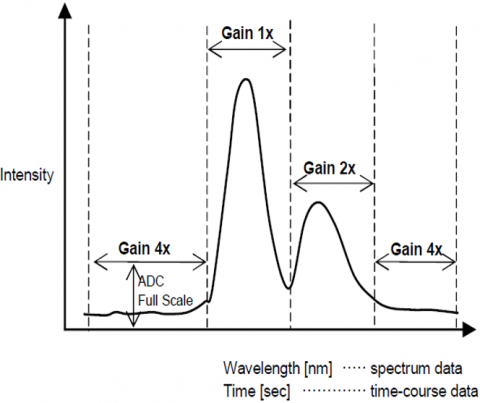
dynamický rozsah
funkce automatického řízení zisku automaticky upravuje zisk signálu z detektoru na základě intenzity fluorescence. To optimalizuje signál / šum po celé naskenované rozsah pro spektrální nebo časový průběh měření tak, že vrcholy s různou intenzitou, jsou automaticky upraveny, aby se zlepšila S/N a zajistit přesnost výsledku.
Automatické Řízení Citlivosti Systému (SCS)
Automatické Řízení Citlivosti Systému(SCS) rozšiřuje dynamický rozsah detekován fluorescenční signál tím, že automaticky nastavení detektor napětí podle fluorescenční intenzity. To umožňuje měření pevné vlnové délky nebo kvantitativní analýzy sub-pikomolárních až mikromolárních koncentrací bez ruční změny přístroje.

obrázek 5. Kalibrační křivka fluoresceinových roztoků od 5 x 10-13 do 1,5 x 10-6 M pomocí funkce auto-SCS.
Applications of Fluorescence Spectroscopy
Anizotropie
anizotropie Fluorescence je pozorována, když fluorophore vyzařuje světlo různých intenzit v závislosti na osy polarizace a je popsán následující rovnicí
r=Irv-GIvh/Irv+2GIvh
kde je intenzita emisí paralelně k buzení letadlo a je emisní intenzity kolmé k excitaci letadlo. G se nazývá G-faktor nebo Přístrojový mřížkový faktor a odpovídá za polarizační závislost emisního monochromátoru.
všechny fluorofory mají přechodové momenty, které se vyskytují podél specifických směrů podél molekulární osy. , Když je vystavena polarizované světlo, náhodně orientované fluorophores, které mají jejich vstřebávání přechod okamžiky orientována na úhlu dopadajícího světla budou nadšeni a to excitovaného stavu populace je částečně orientovaný. Jako molekula se vrací z excitovaného stavu zpět do jeho základního stavu, náboj elektronu je šířen a změny v orientaci dipólového momenty efekt excitačních a emisních polarizace. Například, když fluorescence, je emitován, než se molekula otáčí, fluorescenční světlo bude silně polarizované ve směru excitační světlo je polarizace. Pokud je světlo emitováno po rotaci molekuly zcela náhodným směrem, fluorescence již nebude polarizována.
při měření fluorescenční anizotropie ovlivní molekulární pohyb následující faktory: (1) molekulární Velikost, (2) viskozita prostředí molekuly a (3) pevnost a stupně volnosti vázané molekuly. Měření anizotropie určují průměrný úhlový posun fluoroforu, ke kterému dochází mezi absorpcí a emisí fotonu. Úhlové posunutí je závislé na rychlosti a rozsahu rotační difúze během životnosti excitovaného stavu. Když fluorophore je neomezený a nechá se volně otáčet před re-emituje foton, rychlost difúze je obecně rychlejší než míra emisí a anizotropie je zhruba rovna nule. Rotační difúze mění směr přechodového momentu, který depolarizuje emise. Čím je fluorofor omezenější, tím větší bude hodnota anizotropie, protože snížení flexibility sníží celkovou rychlost rotace.
PRAŽEC
Fluorescenční rezonanční přenos energie (FRET) je mechanismus, jimiž se řídí přenos energie mezi dvěma sousedními molekulami. Dárce, zpočátku ve svém excitovaném stavu, může přenášet energii na akceptorovou molekulu prostřednictvím neradiativní elektronové rezonance.
pražec je monitorován spektrofluorometrem, který měří fluorescenci/kalení akceptoru nebo excitovaného dárce. Účinnost pražce závisí na následujících faktorech: vzdálenost mezi dárcem a akceptorem, spektrální překrytí mezi dárcem a akceptorem a zarovnání jejich dipólových momentů. Účinnost je nepřímo úměrná šesté síle vzdálenosti mezi dárcem a akceptorem, což činí techniku extrémně citlivou na malé změny vzdálenosti. Když je oblast překrytí fluorescenčního spektra dárce a absorpční spektrum akceptoru větší, účinnost pražce je vyšší. Účinnost pražce je také na maximu, když jsou dva dipólové momenty navzájem rovnoběžné nebo antiparalelní, a nedochází k přenosu energie, když jsou dipólové momenty navzájem kolmé. Typicky, když je vzdálenost mezi dárcem a akceptorem1 a 10 nm, dochází k pražci.
Kvantový Výtěžek a Spektrální Korekce
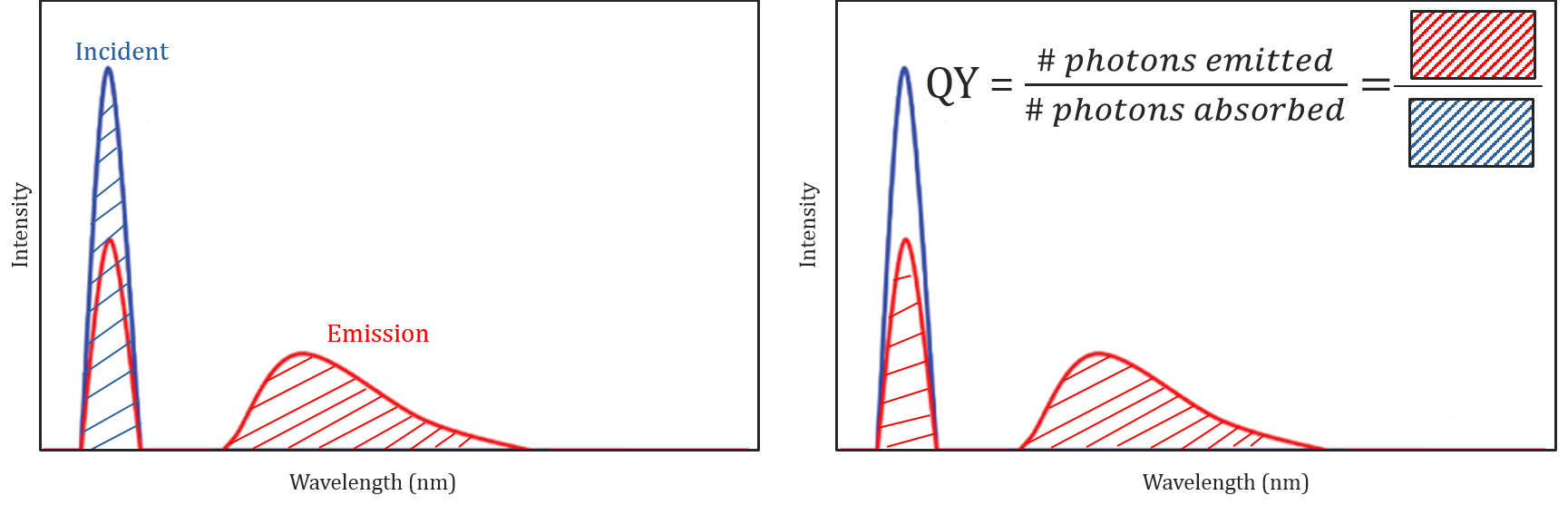
Různé molekulární a podmínky životního prostředí nejen vliv, zda molekula bude fluoreskují nebo ne, ale může také určit intenzitu nebo kvantový výtěžek emitované fluorescenční záření. Molekula je účinnost fluoreskují je popsán její kvantový výtěžek a je definován jako poměr počtu fotonů absorbována do počtu fotonů emitovaných vzorkem.
v některých případech je nutné stanovit přesné spektrální měření. To se provádí pomocí odkazů na známé kalibrované materiály. Použité kalibrované zdroje jsou kontrolovány na absolutní spektrální výkon na známém přístroji a je dodáno referenční spektrum pro korekci jednotlivých přístrojů dodaných zákazníkovi. Aby spektrální korekce fungovala efektivně, musí být provedena při každém parametru přístroje a kombinacích šířky pásma, takže spektrální Korekce při spektrální šířce pásma 5 nm nemůže být použita pro měření pomocí SBW 10 nm. To platí pro polohu polarizátorů, pokud jsou používány, stejně jako pro použití filtrů vyššího řádu. Je třeba provést Spektrální Korekce pro každou kombinaci spektrální pásma mají být použity zákazníkem, pro zahrnutí nebo vyloučení vyššího řádu filtru výběr, a pro pozice polarizátory, pokud je namontován. Excitace vzorku a emisní vlnové délky určí, jaké řešení / zdroj světla se používá pro kalibraci.
Blízké Infračervené
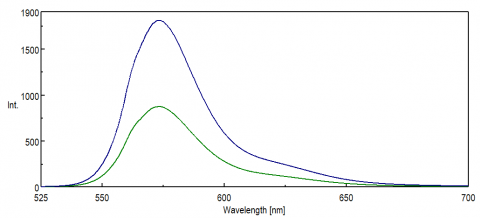
Pro aplikace snímání NIR oblasti spektra, spektrální odezva na PMT detektoru je rozhodující pro získání údajů. Na červeném konci viditelné oblasti, do NIR, kvantová účinnost PMT významně klesá, což má za následek malou nebo žádnou intenzitu signálu během měření vzorku. FRET experimenty a Nir barviva a sondy jsou často sledovány na vlnových délkách nad 500 nm a v mnoha případech mají malé signály, dokonce i pro tak citlivou techniku, jako je fluorescence. Obrázek 8 znázorňuje rozdíl v intenzitě fluorescence rhodaminu B za použití standardního PMT ve srovnání s PMT, který je citlivější na vlnové délky na červeném konci spektra.
Doplňková Technika:
Kruhového Dichroismu Spektroskopie
Kruhového dichroismu spektroskopie (CD) je základní analytická technika používaná pro analýzu chirality u molekul přes jejich optické aktivity. CD lze aplikovat na širokou škálu molekulárních struktur, ale ve vědecké komunitě našel přízeň pro objasnění makromolekulární struktury, zejména proteinů a nukleových kyselin.