Además del procesamiento de proteínas, la Sala de Emergencias y Golgi también se encargan de algunos tipos de transporte de proteínas. Las vesículas (burbujas ligadas a la membrana, esencialmente) se desprenden de la sala de Emergencias, Golgi y otros orgánulos membranosos, llevando consigo cualquier molécula soluble que estuviera dentro del fluido que estaba encerrado, así como cualquier molécula incrustada en esa sección de membrana. Estas vesículas luego se montan en un motor molecular como la cinesina o la miosina, y viajan a lo largo del citoesqueleto hasta que atracan en el destino apropiado y se fusionan con la membrana u orgánulo objetivo. En general, las vesículas se mueven desde la sala de emergencias para el cis de Golgi, de la cei a la media de Golgi, de la media de la trans de Golgi, y de la trans de Golgi a la membrana plasmática o en los otros compartimientos. Aunque la mayor parte del movimiento es en esta dirección, también hay vesículas que se mueven de regreso desde el Golgi a la sala de emergencias, llevando proteínas que se suponía que permanecerían en la sala de Emergencias (p. ej. PDI) y se recogieron accidentalmente dentro de una vesícula.
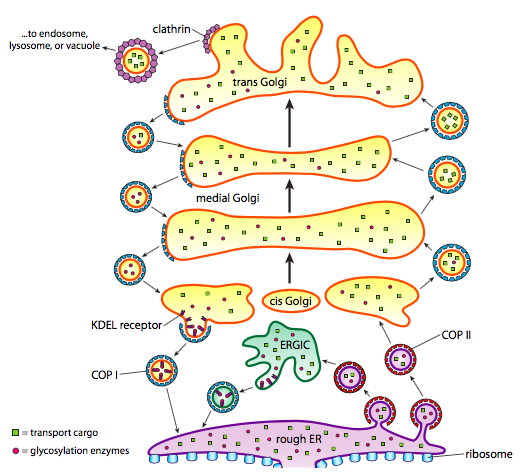
La formación de vesículas depende de las proteínas de la capa que, en condiciones adecuadas, se ensamblan en jaulas esféricas. Cuando se asocian con proteínas transmembranas, también pueden tirar de la membrana adjunta en forma esférica. Los principales tipos de proteínas de la capa utilizadas en la formación de vesículas son COPII, COPI y clatrina.
Las proteínas de capa de copio forman las vesículas que se mueven de ER a Golgi. Las proteínas de capa de copia se utilizan entre las partes del aparato de Golgi, así como para formar vesículas que van desde el Golgi hasta la sala de emergencias. Finalmente, la clatrina se utiliza para formar vesículas que salen del Golgi para la membrana plasmática, así como para vesículas formadas a partir de la membrana plasmática para la endocitosis.
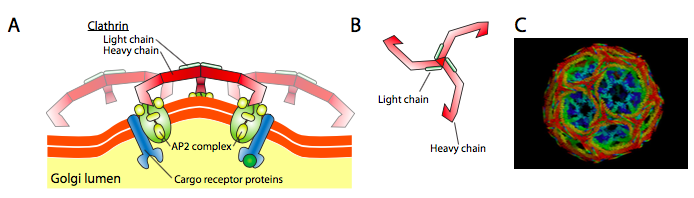
Clatrina (Figura \(\pageIndex{17}\)) es la mejor descrita de las tres, y las capas vesiculares están hechas de arreglos de triskeliones de clatrina (del griego, que significa de tres patas). Cada triskelion está compuesto por tres cadenas pesadas unidas en el extremo C, y tres cadenas ligeras, una asociada con cada cadena pesada. Las pesadas cadenas de diferentes triskelions interactúan a lo largo de sus pesadas «patas» de cadena para crear una construcción muy resistente. Las cadenas ligeras son innecesarias para la formación de vesículas, y se cree que ayudan a prevenir las interacciones accidentales de las moléculas de clatrina en el citoplasma.
Existe una similitud significativa entre los mecanismos de formación de vesículas que utilizan estas proteínas de capa diferentes, comenzando con el reclutamiento de ARF1 (ARF significa factor de ribosilación ADP, que no tiene nada que ver con su función aquí) a la membrana. Esto requiere el intercambio facilitado por ARNO de un GTP por GDP (ARNO es un abridor del sitio de unión de nucleótidos ARF). Una vez que ARF1 se ha unido al GTP, el cambio conformacional revela un grupo miristoílo N-terminal que se inserta en la membrana. Tanto las vesículas recubiertas de COPI como de clatrina usan ARF1 y ARNO, pero COPII usa proteínas similares llamadas Sar1p y Sec12p.
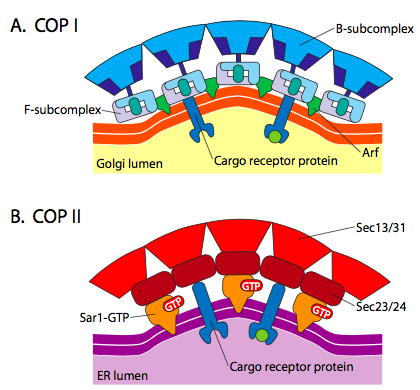
Figura \(\Índice de página{18}\). Vesículas recubiertas de COP
El ARF1 (o Sar1p) se utiliza para reclutar proteínas adaptadoras que se unen al extremo «cola» de las proteínas receptoras unidas a la membrana. El extremo comercial de estos receptores se une a las moléculas car – go que deben empaquetarse en la vesícula. Las proteínas adaptadoras actúan como el enlace entre la membrana (a través de los receptores) y las proteínas de la capa. Para la clatrina, las proteínas adaptadoras son AP1 para las vesículas derivadas de trans-Golgi y AP2 para las vesículas endocíticas. Para las vesículas COPI, los homólogos aproximados son los β-, γ-, δ-y ζ – COP, mientras que el sistema COPII utiliza Sec23p y Sec24p.
Finalmente, los adaptadores se unen a las proteínas de la capa real: clatrina, α – o ε – COP, Sec13p y Sec31p. Lo que todas estas proteínas tienen en común es que espontáneamente (p.ej. sin ningún requisito de gasto de energía), se autoensamblan en estructuras esféricas en forma de jaula. Bajo el microscopio electrónico, las vesículas recubiertas de clatrina están más definidas y las formas hexagonales y pentagonales delimitadas por las subunidades de clatrina le dan a la vesícula un aspecto de «pelota de fútbol». Las vesículas recubiertas de coatámero de POLI son mucho más borrosas en apariencia debajo del EM.
Los tres tipos de proteínas de cubierta vesicular tienen la capacidad de asociarse espontáneamente en una construcción esférica, pero solo la vesícula recubierta de COPI y COPII también «pellizca» espontáneamente la membrana para liberar la vesícula de su membrana original. Las vesículas recubiertas de clatrina requieren un mecanismo externo para liberarlas (Figura \(\pageIndex{19}\)).
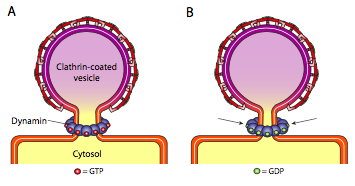
Una vez que la vesícula casi se ha completado, todavía hay un pequeño tallo o cuello de membrana que conecta la vesícula a la membrana. Alrededor de este tallo, las moléculas dinámicas de GTP se agregan en una construcción de anillo/espiral. Las moléculas de dinamina son GTPasas globulares que se contraen por hidrólisis de GTP. Cuando se asocian alrededor del tallo de la vesícula, cada proteína dinamina se contrae, con el efecto combinado de estrechar el tallo lo suficiente como para que la membrana se pellizque, sellando y liberando la vesícula de la membrana original.
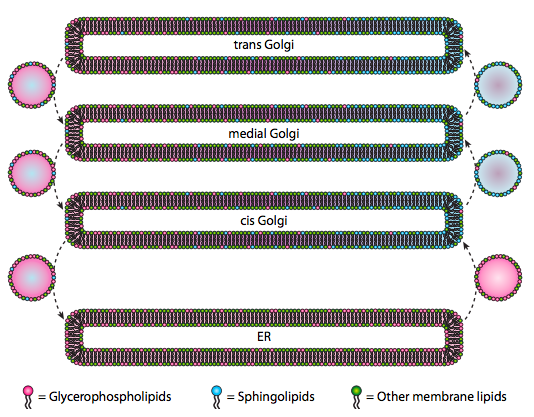
Aunque los lípidos y las membranas se discutieron en el capítulo 4, descuidamos discutir la ubicación de sus síntesis en eucariotas. Como indica la figura \(\pageIndex{20}\), la síntesis de ciertos tipos de lípidos es segregada y exclusiva. Los glicerofosfolípidos se forman principalmente en el retículo endoplásmico, aunque también se producen en las mitocondrias y los peroxisomas. En contraste, los esfingolípidos no se producen en la sala de emergencias (aunque sus precursores de ceramida sí lo son) en los mamíferos, las enzimas necesarias se encuentran en el lumen del cis y en el Golgi medial. Hay evidencia de tráfico vesicular anterógrado y retrógrado entre los diversos compartimentos Golgi y ER, lo que teóricamente indicaría una redistribución de los tipos de lípidos. Sin embargo, los esfingolípidos tienden a agregarse en balsas lipídicas y parecen estar más concentrados en vesículas en movimiento anterógrado.
Las proteínas de la capa se desprenden poco después de la liberación vesicular. Para la clatrina, el proceso involucra Hsc70, una ATPasa. Sin embargo, para las vesículas recubiertas de COPI o COPII, la hidrólisis del GTP en ARF/Sar1p parece debilitar la afinidad de la proteína de la capa para los adaptadores e inicia el descapotado. El activador de GTPasa es ARF GAP (o Sec23p) y es una parte integral de la capa COP I (o II).
Las vesículas llevan dos categorías de carga: proteínas solubles y proteínas transmembranas. De las proteínas solubles, algunas se absorben en la vesícula en virtud de estar unidas a un receptor. Otras proteínas simplemente se encuentran en las cercanías y se recogen a medida que se forma la vesícula. Ocasionalmente, se toma una proteína que no se suponía que debía ser; por ejemplo, la PDI puede estar encerrada en una vesícula que se forma desde la sala de Emergencias. Tiene poca función en el Golgi, y se necesita en urgencias, así que, ¿qué le pasa? Afortunadamente, la PDI y muchas otras proteínas ER tienen una secuencia de señal C-terminal, KDEL (Lisina-Ácido Aspártico-Ácido Glutámico-Leucina), que grita «Pertenezco a la Sala de Emergencias.»Esta secuencia es reconocida por los receptores KDEL dentro del Golgi, y la unión de las proteínas KDEL a los receptores desencadena la formación de vesículas para enviarlas de vuelta a la sala de emergencias.
Las vesículas secretoras tienen un problema especial con la carga soluble. Si la vesícula dependiera simplemente de encerrar proteínas dentro de ella durante el proceso de formación, sería difícil obtener altas concentraciones de esas proteínas. El organismo necesita muchas proteínas secretadas rápidamente y en cantidades significativas, por lo que existe un mecanismo en el trans Golgi para agregar proteínas secretoras. El mecanismo utiliza proteínas agregantes como la secretogranina II y la cromogranina B que reúnen las proteínas diana en grandes gránulos concentrados. Estas graninas funcionan mejor en el entorno trans Golgi de pH bajo y Ca2 + alto, por lo que cuando la vesícula libera su contenido fuera de la célula, el pH más alto y el Ca2+ más bajo separan los agregados para liberar las proteínas individuales.
Hay un cambio de pH consistente durante la maduración del Golgi, de modo que a medida que pasamos de ER a Golgi, cada compartimento tiene un pH lumenal progresivamente más bajo (más ácido).
Finalmente, está la cuestión de apuntar a las vesículas. Las vesículas son mucho menos útiles si se lanzan en un tren de carga molecular y se dejan al azar. Por lo tanto, hay un mecanismo de acoplamiento que requiere una coincidencia de la proteína v-SNARE en la superficie citoplasmática de la vesícula y la t-SNARE en la superficie citoplasmática de la membrana objetivo. La fusión de la vesícula a la membrana solo se produce si hay una coincidencia. De lo contrario, la vesícula no puede fusionarse, y se unirá a otro motor molecular para dirigirse a otro destino, con suerte correcto. Este proceso es ayudado por proteínas atadoras que inicialmente hacen contacto con una vesícula entrante y la acercan lo suficiente al objetivo para probar la interacción de la proteína SNARE. Otras proteínas en la vesícula y las membranas objetivo interactúan y, si las trampas coinciden, pueden ayudar a» cabestrar » la vesícula en la membrana objetivo, con lo cual las membranas se fusionan. Una regla general importante para entender la fusión vesicular y también la direccionalidad de las proteínas de membrana y los lípidos, es que el lado que mira hacia el citoplasma de una membrana siempre estará mirando hacia el citoplasma. Por lo tanto, una proteína que finalmente se encuentra en la superficie externa de la membrana celular se habrá insertado en la superficie lumenal de la membrana ER para comenzar.
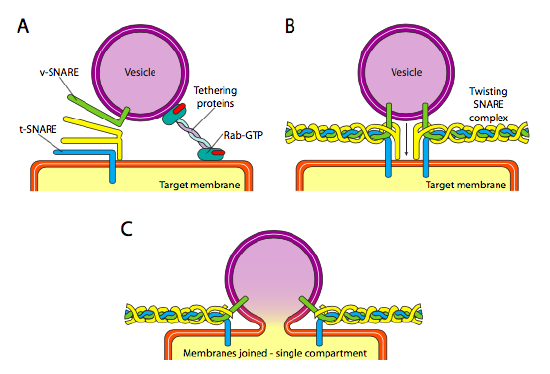
Más específicamente, a medida que una vesícula se acerca a la membrana objetivo, la proteína atadora Rab-GTP, que está unida a la membrana objetivo a través de una cola lipídica de geranilgeranilo doble, se asocia vagamente con la vesícula y la mantiene cerca de la membrana objetivo para dar a las TRAMPAS la oportunidad de funcionar. Las v-SNAREs y t-SNAREs ahora tienen la oportunidad de interactuar y probar para un partido. Recientemente, las trampas han sido renombradas como R-SNAREs y Q-SNAREs, respectivamente, basadas en residuos conservados de arginina y glutamina. Además de estas dos trampas primarias, al menos otra TRAMPA está involucrada, formando un conjunto de cuatro hélices α (cuatro, no tres, porque al menos en el ejemplo mejor estudiado, una de las trampas está doblada para que dos de sus dominios alfa helicoidales participen en la interacción. Las cuatro hélices se envuelven una alrededor de la otra y se cree que al hacerlo, juntan la vesícula y la membrana objetivo.
La toxina tetánica, la tetanoespasmina, que es liberada por la bacteria Clostridium tetani, causa espasmos al actuar sobre las células nerviosas y prevenir la liberación de neurotransmisores. El mecanismo para esto es que escinde la sinaptobrevina, una proteína de LAZO, de modo que las vesículas sinápticas no pueden fusionarse con la membrana celular. La toxina botulínica, de Clostridium botulinum, también actúa sobre las trampas para evitar la fusión de vesículas y la liberación de neurotransmisores, aunque se dirige a diferentes neuronas y, por lo tanto, tiene el efecto contrario: el tétanos es causado por la prevención de la liberación de neurotransmisores inhibitorios, mientras que el botulismo es causado por la prevención de la liberación de neurotransmisores excitatorios.