Reacción: Hidratación de Alquinos
Al igual que con los alquenos,la hidratación (adición de agua) a los alquinos requiere un ácido fuerte, generalmente ácido sulfúrico, y es facilitada por el sulfato mercúrico. Sin embargo, a diferencia de las adiciones a los enlaces dobles que dan productos de alcohol, la adición de agua a los alquinos da productos cetónicos ( excepto el acetileno que produce acetaldehído ). La explicación de esta desviación se encuentra en la tautomerización de enol-ceto, ilustrada por la siguiente ecuación. El producto inicial de la adición de agua a un alquino es un enol (un compuesto que tiene un sustituyente hidroxilo unido a un doble enlace), y esto se reordena inmediatamente al ceto tautómero más estable.
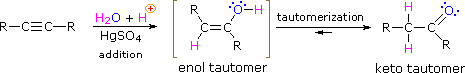
Los tautómeros se definen como isómeros constitucionales rápidamente interconvertidos, generalmente distinguidos por una ubicación de enlace diferente para un átomo de hidrógeno lábil (coloreado de rojo aquí) y un enlace doble ubicado de manera diferente. El equilibrio entre los tenómeros no solo es rápido en condiciones normales, sino que a menudo favorece fuertemente a uno de los isómeros ( la acetona, por ejemplo, es un 99,999% de tenómero ceto ). Incluso en tales equilibrios unilaterales, la evidencia de la presencia del tensor menor proviene del comportamiento químico del compuesto. Los equilibrios tautoméricos son catalizados por trazas de ácidos o bases que generalmente están presentes en la mayoría de las muestras químicas. Los tres ejemplos que se muestran a continuación ilustran estas reacciones para diferentes sustituciones del triple enlace. El paso de tautomerización se indica con una flecha roja. Para los alquinos terminales, la adición de agua sigue la regla de Markovnikov, como en el segundo ejemplo a continuación, y el producto final es una metilcetona ( excepto el acetileno, que se muestra en el primer ejemplo ). Para los alquinos internos ( el enlace triple está dentro de una cadena más larga), la adición de agua no es regioselectiva. Si el enlace triple no está situado simétricamente ( es decir, si R & R’ en la tercera ecuación no son iguales ) se formarán dos cetonas isoméricas.
HC≡CH + H2O + HgSO4 & H2SO4 –> –> H3C-CH=O
RC≡CH + H2O + HgSO4 & H2SO4 –> –> RC(=O)CH3
RC≡CR’ + H2O + HgSO4 & H2SO4 –> –> RCH2-C(=O)R’ + RC(=O)-CH2R’
Con la adición de agua, alquinos pueden estar hidratado para formar enols que espontáneamente tautomerize a cetonas. La reacción es catalizada por iones de mercurio. Sigue la Regla de Markovnikov: Los alquinos terminales dan cetonas metílicas
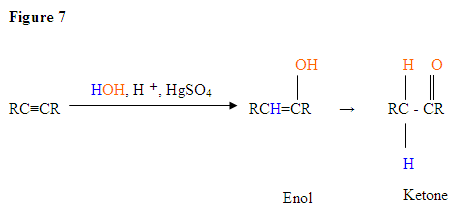
- El primer paso es una reacción ácido / base en la que los electrones π del enlace triple actúan como una base de Lewis y atacan al protón, por lo que protinizan el carbono con la mayor cantidad de sustituyentes de hidrógeno.
- El segundo paso es el ataque de la molécula de agua nucleófila sobre el carbocatión electrofílico, que crea un ion oxonio.
- A continuación, desprotonas por una base, generando un alcohol llamado enol, que luego se tautomeriza en una cetona.
- El tautomerismo es un desplazamiento simultáneo de protones y doble enlace, que va de la forma enol a la forma isómera ceto como se muestra arriba en la Figura 7.
Ahora veamos algunas Reacciones de Hidratación.
La hidratación del alquino terminal produce cetonas metílicas
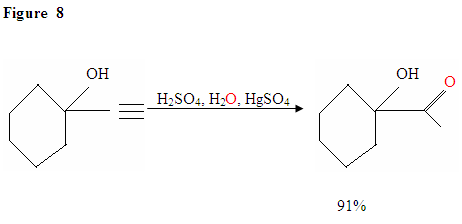
Tal como se describe en la Figura 7, los electrones π atacarán a un protón, formando un carbocatión, que luego es atacado por las moléculas de agua nucleofílicas. Después de la desprotación, generamos un enol, que luego se tautomeriza en la forma de cetona mostrada.
Hidratación del alquino
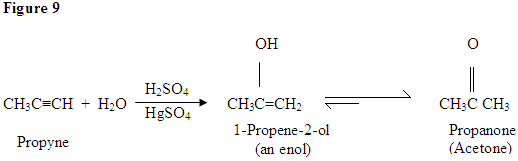
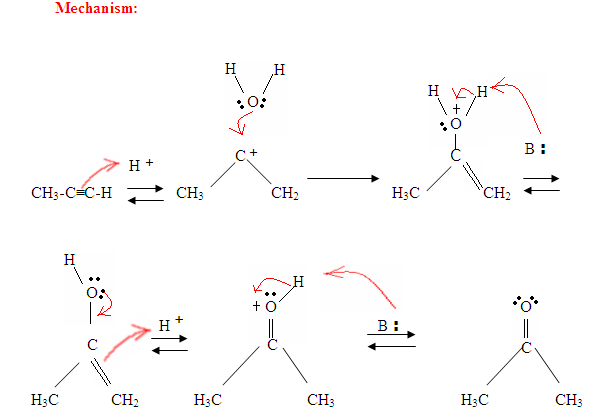
Como se puede ver aquí, los electrones π del enlace triple están atacando al protón, que forma un enlace covalente en el carbono con la mayor cantidad de sustituyentes de hidrógeno. Una vez que el hidrógeno está unido, tienes un carbocatión, que es atacado por la molécula de agua. Ahora tienes una carga positiva en el oxígeno que resulta en una base que entra y desprotinea la molécula. Una vez desprotrinado, tienes un enol, que luego se tautomeriza.
El tautomerismo se muestra aquí cuando el protón es atacado por el doble enlace π electrones formando un enlace covalente entre el carbono y el hidrógeno en el carbono menos sustituido. Los electrones del oxígeno terminan moviéndose hacia el carbono, formando un doble enlace con el carbono y dándose una carga positiva, que luego es atacada por la base. La base desprotinata el oxígeno dando como resultado el producto final más estable en equilibrio, que es una cetona.
Ejercicio \(\Índice de página{1}\)
- Dibuje la estructura del producto que se forma cuando cada una de las sustancias a continuación se trata con H2O/H2SO4 en presencia de HgSO4.
- $\ce{\sf{CH3-CH2-C#C-H}}$
-
- Dibuje la estructura de la forma ceto del compuesto que se muestra a continuación. ¿Qué forma esperarías que fuera la más estable?
Respuesta
Respuestas:
La forma ceto debe ser el más estable.
Preguntas
P9.4.1
Lo alquino tendría que empezar para obtener los siguientes productos, en una reacción de oxidación? Ten en cuenta la resonancia.

P9.4.2
Proponer un esquema de reacción para el compuesto siguiente a partir del alquino y mostrando los reactivos e intermedios requeridos.

Soluciones
S9.4.1

S9.4.2
