Introducción
La acción enzimática de la fosfodiesterasa tipo 5 (PDE5) es el mecanismo principal para la inactivación del GMPc, el mediador aguas abajo del agente vasodilatador óxido nítrico (NO) (Lugnier, 2006).
En el curso de la disfunción eréctil (DE), el deterioro de la producción de NO de los vasos cavernosos endoteliales puede superarse farmacológicamente mediante el uso de inhibidores de la PDE5 (PDE5i), con el fin de prolongar la semivida de GMPc y mejorar la función vasodilatadora residual (Hawksworth y Burnett, 2015). Varias moléculas con actividad inhibitoria sobre la PDE5 han sido proyectadas y lanzadas al mercado, mostrando un inicio y duración de efecto diferentes. Actualmente, la PDE5i es el fármaco de primera elección utilizado para el tratamiento de la disfunción eréctil (Mehrotra et al., 2007).
A pesar de una eficacia reconocida en casi el 80% de los pacientes no seleccionados con disfunción eréctil (Eardley et al., 2010; Hatzimouratidis et al., 2010; Porst et al., 2013), se ha notificado recientemente un notable abandono del tratamiento con PDE5i. En términos cuantitativos, se ha notificado una tasa media de interrupción del tratamiento del 4% al mes, con un abandono total del tratamiento en el 50% de los casos anualmente (Carvalheira et al., 2012; Corona et al., 2016). Entre las principales razones dadas por los pacientes para justificar el abandono de la terapia, la falta de eficacia y los efectos secundarios se refieren como los más prevalentes (Corona et al., 2016). Se pueden distinguir dos tipos de efectos secundarios: los estrictamente relacionados con la inhibición de la PDE5, como el dolor de cabeza, el rubor y la dispepsia, y los asociados a la actividad inhibitoria residual de los medicamentos sobre otras EDP, como la vasodilatación y la taquicardia (PDE1), los trastornos visuales (PDE6) y el dolor de espalda (PDE11) (Bischoff, 2004; Gupta et al., 2005). Dado que la aparición de efectos secundarios aumenta con los niveles séricos y el tiempo de exposición al medicamento (Gupta et al., 2005; Taylor et al., 2009), el perfil de seguridad/eficacia de un fármaco puede mejorarse alternativamente a través de un enfoque farmacocinético mediante el diseño de una nueva formulación de fármaco (Mehrotra et al., 2007). Este enfoque se ha aplicado con éxito a la PDE5i en el caso de vardenafilo. De hecho, esta molécula sufre de una biodisponibilidad relativamente baja (∼15%, Center for Drug Evaluation and Research, 2003). En comparación con el comprimido recubierto con película (FCT), la formulación original para la administración clásica per os, la formulación de comprimidos bucodispersables (ODT) para Vardenafilo aumentó significativamente la biodisponibilidad de los fármacos al favorecer la absorción sublingual, una vía reconocida como menos afectada por el metabolismo de primer paso (Heinig et al., 2011).
El sildenafilo (Sild) fue el primer inhibidor selectivo de la PDE5 aprobado para el tratamiento de la disfunción eréctil (Boolell et al., 1996). Es una molécula relativamente lipofílica y, después de la administración oral, la concentración plasmática máxima se alcanza en un tiempo que varía de 0,5 a 2 h. Sild muestra una biodisponibilidad oral relativamente baja (38-41%), principalmente debido al extenso metabolismo intestinal y de primer paso (Gupta et al., 2005). A pesar de la larga presencia en el mercado, el desarrollo de nuevas formulaciones de medicamentos no ha seguido adelante, hasta el reciente lanzamiento en el mercado italiano de una nueva formulación: la película bucodispersable (ODF). De hecho, el ODF fue aprobado como una forma bioequivalente de FCT (Leoni et al., 2013). Sin embargo, las formulaciones de desintegración oral pueden representar sistemas adecuados para favorecer la absorción trans-mucosa, y en particular sub-lingual (Kathpalia y Gupte, 2013).
En este estudio, evaluamos la farmacocinética de Sild asociada a la administración sublingual de ODF u ODT, en comparación con la FCT como formulación original por sg. Para ello, se investigó el perfil de liberación / permeabilidad de las diferentes formulaciones de Sild mediante sistemas in vitro desarrollados específicamente para evaluar la absorción trans-mucosa de fármacos. Además, se cuantificaron los perfiles séricos de la farmacocinética de la DSI después de la administración de TCA per os, TDO sublingual y FDO en pacientes con DE.
Materiales y métodos
Productos químicos y Formulaciones de medicamentos
Solución de sales de equilibrio de Hank pH 7,4 (HBSS), solución de HEPES, bencanilida y citrato de Sild se compraron a Sigma–Aldrich (Milán, Italia). Para evitar cualquier resultado de confusión derivado del uso de productos bioequivalentes alternativos disponibles en el mercado, se utilizaron los siguientes productos: Viagra ® FCT (Pfizer, Milán, Italia), Viagra ORO® ODT (Pfizer) y Rabestrom® ODF (IBSA, Lodi, Italia). Se prescribieron medicamentos a los pacientes durante la evaluación ambulatoria para su uso privado. Para las pruebas in vitro y la evaluación in vivo de la farmacocinética (ver a continuación), los medicamentos fueron comprados específicamente por el personal involucrado en el estudio en las instalaciones de la farmacia local y luego manipulados/almacenados en condiciones óptimas.
Prueba de Desagregación
Las pruebas de desagregación in vitro se realizaron de acuerdo con la Farmacopea Europea (2016) utilizando el Medidor de Desintegración de Comprimidos (Sotax DT 2, Figura Suplementaria S1A), utilizando agua como fluido de inmersión a 37 ± 0,5°C. El tiempo de desagregación se verificó en la desintegración completa de la forma de dosificación. La desintegración completa se define como el estado en el que cualquier residuo de la unidad que quede en la pantalla del aparato de ensayo o que se adhiera a la superficie inferior de los discos es una masa blanda sin núcleo palpablemente firme. Las pruebas se realizaron por triplicado y los resultados se notificaron como valor medio ± desviación estándar.
Prueba de disolución
Se realizaron pruebas de disolución de fármacos in vitro de acuerdo con la Farmacopea Europea . Las pruebas de disolución se realizaron con un aparato de paletas, velocidad de paletas de 50 rpm, y se utilizó HBSS pH 7,4 como volumen medio de disolución (900 ml a 37 ± 0,5 ° C).
Durante las pruebas de liberación, 2 ml de muestra de medio de disolución, a 0, 2, 4, 6, 10, 20, 30, y 40 min, se eliminó y filtró a través de un filtro de ésteres de celulosa de 0,45 µm y, por lo tanto, se diluyó. Posteriormente, se realizó la cuantificación de Sild mediante cromatografía líquida de alto rendimiento (HPLC)-UV. El volumen eliminado se reemplazó cada vez con medio fresco. Las pruebas se realizaron por triplicado y los resultados se notificaron como valor medio ± desviación estándar. Se normalizaron los datos sobre el contenido farmacológico de la formulación.
Prueba de Permeación Trans-mucosa
El perfil de permeación Trans-mucosa de Sild se evaluó in vitro utilizando un dispositivo específico de acuerdo con Delvadia et al. (2012) debidamente modificado. En resumen, el dispositivo consistía en un sistema de difusión vertical caracterizado por cámaras donante–receptoras separadas por una membrana desechable de acetato de celulosa (poro de 0,45 µm). La célula donante contenía 1,5 ml de HBSS, mientras que la cámara receptora formaba parte de un circuito cerrado de recirculación de 30 ml, incluidos los volúmenes de tubo y depósito. El muestreo se realizó desde el depósito de la cámara receptora en los intervalos de tiempo de 0, 5, 10, 20, 30, y 40 minutos y se sustituye por un volumen equivalente de HBSS fresco. Las muestras se analizaron mediante HPLC-UV para determinar el contenido de fármaco(Fejős et al., 2014). Los datos se normalizaron con la concentración de Sild permeada más alta observada para el citrato de Sild puro. Las pruebas se realizaron por triplicado y los resultados se notificaron como valor medio ± desviación estándar.
Estudio farmacocinético en Pacientes con DE Psicogénicos Voluntarios
El estudio se realizó en la Unidad de Andrología y Medicina Reproductiva (Hospital Universitario de Padua, Italia), entre mayo y septiembre de 2017, de acuerdo con la Declaración de Helsinki bajo la aprobación del Comité de Ética del Hospital Universitario de Padua (protocolo número 3982/AO/16 y modificaciones sucesivas). Para evitar resultados confusos, se inscribieron sujetos con disfunción eréctil psicógena porque la menor incidencia de trastornos orgánicos se asocia a la disfunción eréctil (Ludwig y Phillips, 2014).
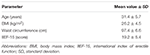
El tamaño de la muestra se calculó para obtener un tamaño de efecto de al menos 0,5 con una potencia estadística de 0,8 y un nivel de significación de 0,05 para una comparación de tres grupos (ver calculadora de potencia – ANOVA independiente unidireccional). Veinte pacientes (edad media 31,4 ± 5,7 años) se inscribieron consecutivamente tras la emisión del consentimiento informado firmado. Los pacientes asistieron a una evaluación ambulatoria que informó la incapacidad constante de obtener y mantener una erección para tener relaciones sexuales satisfactorias durante los 6 meses anteriores o más. Se realizó una evaluación clínica posterior en todos los pacientes para determinar la ausencia de enfermedades relacionadas con la disfunción eréctil, como diabetes mellitus, hipertensión, trastorno neurológico y uso de antidepresivos. El diagnóstico de disfunción Eréctil psicógena fue confirmado por el cumplimiento de una puntuación de índice <26 en la administración del cuestionario Índice Internacional de Función Eréctil-15 (IIEF-15) (Lotti et al., 2016) y el mantenimiento de erecciones espontáneas nocturnas, evaluadas por Tumescencia Nocturna del Pene y Monitoreo de Rigidez a través del Sistema de Evaluación de Rigidez RigiScan Plus (Dacomed, Estados Unidos) durante dos noches consecutivas como se describió anteriormente (Muñoz et al., 1993; Caretta et al., 2005). Los criterios de exclusión fueron el diagnóstico de neoplasias malignas, niveles plasmáticos anormales de hormonas (hormona luteinizante 8 UI/l, testosterona total 10,4 nmol/l, tirotropina 4,5 mUI/l, prolactina 20 ng/ml) y aumento del grosor íntima-media en los troncos supraórticos (0.9 mm) y/o arterias cavernosas (> 0,3 mm), evaluadas mediante ecografía Doppler Color como se describió anteriormente (Caretta et al., 2005, 2009).
Los pacientes acordaron adherirse a un ensayo abierto cruzado de tres vías de dosis única. El esquema de dosificación del fármaco se describe en la Figura 1. La dosis de Sild se eligió en 50 mg, de acuerdo con informes anteriores sobre el tratamiento de la disfunción eréctil psicógena (Banner y Anderson, 2007). Se pidió a los pacientes que no tomaran drogas ni alcohol durante 1 semana antes y durante el curso del estudio. Además, durante el día de la dosificación del medicamento, también se pidió a los pacientes que tomaran un desayuno sin grasa (sin leche u otro alimento con grasa) al menos 2 h antes de la prueba. La FCT, considerada como formulación de referencia, se administró clásicamente por sg tragando el comprimido oral con un vaso de agua. Para la ODT y la ODF, se instruyó a los pacientes que sostuvieran la formulación debajo de la lengua durante 15 minutos sin la suposición de agua, seguido de la deglución. Se recogieron muestras de sangre venosa en tubos estándar (Vacutainer, BD Biosciences, Milán, Italia) en 0, 5, 10, 15, 30, 60, 90, 120, y 240 minutos después de la administración del medicamento. Se realizó compensación mediante infusión continua de solución salina estéril. Después de la administración, los sujetos fueron alojados hasta completar la muestra de sangre. Se realizó una extracción de sangre adicional a las 24 h de la dosis por razones de control para determinar el aclaramiento completo del fármaco. Como períodos de lavado, se permitieron 7 días entre una dosis y la siguiente. Después de la extracción de sangre, el plasma se aisló inmediatamente y se almacenó a -80°C hasta su uso.
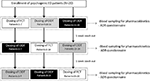
GRÁFICO 1 Esquema de dosificación y evaluaciones para la evaluación de parámetros farmacocinéticos en 20 pacientes con disfunción eréctil psicogénica (DE), subdivididos en tres grupos (respectivamente, Pacientes 1-7; Pacientes 8-14; y Pacientes 15-20). Cada grupo de pacientes recibió alternativamente por sg comprimidos recubiertos con película (FCT), comprimidos bucodispersables sublinguales (ODT) o película bucodispersable sublingual (ODF) con al menos 1 semana de lavado de cada dosis. Todas las formulaciones contenían 50 mg de sildenafilo (Sild).
Durante el alojamiento, también se pidió a los pacientes que registraran las reacciones adversas al medicamento (RAM) en una forma específicamente concebida, adaptada del formulario de notificación de RAM de la Agencia Italiana del Farmacéutico (AIFA1). Se dispone de una versión traducida del cuestionario como Material Complementario (véase la Hoja de Datos Complementaria S1). Se pidió a los pacientes que especificaran el tipo de reacción adversa, la intensidad global (en una escala de evaluación subjetiva de 1, muy débil, a 5, muy intensa), el momento de inicio y la duración global.
Cuantificación de Sildenafilo en Suero humano
Para la cuantificación de los niveles séricos de Sild, se añadieron 400 µl de muestra sérica de 500 µl de metanol suplementado con benzanilida de patrón interno (SI) (5 µg/ml). Posteriormente, se agregaron 5 ml de acetato de etilo a la mezcla, las muestras se vortearon para realizar la extracción líquido–líquido, las dos fases se separaron por centrifugación. La porción orgánica se evaporó en centrífuga al vacío a 40 ° C. El residuo obtenido se volvió a disolver con 200 µl de metanol y finalmente se utilizó para el análisis de cromatografía líquida de alta resolución-espectrometría de masas en tándem (HPLC-MS/MS).
El análisis de cromatografía líquida de alto rendimiento-MS/MS utilizó un sistema Agilent-Varian 1260 y el detector triple-cuádruple Agilent-Varian 320 MS.La separación cromatográfica se realizó en un fenómeno de columna C-18 Evo 3 × 100 y una fase móvil constituida por acetonitrilo con ácido fórmico al 0,1% en agua con un gradiente detallado en la Figura Suplementaria S2A. Se aplicó un modo de detección positivo para la transición 198 > 105 Da del SI, obtenido con una tensión capilar de 40 V y una energía de colisión de 16 V, mientras que 475 > 100 Da para Sild con una tensión capilar de 40 V y una energía de colisión de 22,5 V, respectivamente. Los cromatogramas representativos del SI y del Sild en muestras reales se indican en la figura suplementaria S2B.
Análisis estadístico
Los parámetros farmacocinéticos(FC), como la concentración sérica máxima (Cmax), el tiempo hasta la concentración sérica máxima (tmax) y el área bajo la curva (AUC) en diferentes momentos, se calcularon con rutinas específicas de aplicaciones con el software GraphPad (La Jolla, CA, Estados Unidos). El análisis estadístico de los datos se realizó con el programa SPSS 21.0 para Windows (SPSS, Chicago, IL, Estados Unidos). Se utilizó la prueba de Kolmogorov–Smirnov para verificar la normalidad de la distribución. Las variables que no mostraban una distribución normal se transformaron logarítmicamente. Se compararon las características basales de los pacientes, la PKs y los datos de experimentos in vitro con las pruebas t de Student no emparejadas con corrección de Bonferroni-Holm para comparaciones múltiples. Se realizó ANOVA de medidas repetidas para probar las diferencias en la liberación de fármacos y la concentración sérica de Sild. Se utilizó la prueba de Levene para comprobar la homogeneidad de la varianza entre los grupos. Si se violó el supuesto de homogeneidad de varianza, se realizó la prueba de Welch y se informó el valor de P respectivo. La proporción de RAM se comparó con la prueba exacta de χ2. Valores de P < 0.05 fueron considerados estadísticamente significativos.
Resultados
Análisis in Vitro de Liberación / Permeabilidad de Sildenafilo de las Diferentes Formulaciones de medicamentos
La dinámica de liberación y permeabilidad de Sild de las tres formulaciones de medicamentos se investigó anteriormente in vitro (Figura 2). El tiempo para completar la desagregación de FCT, ODT y ODF se evaluó mediante una prueba estándar descrita en la Farmacopea Europea (2016; Figura 2A). El ODF mostró el mayor tiempo de desagregación en comparación con el FCT y el ODT (respectivamente, P = 0,017 y P = 0,008).
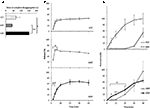
GRÁFICO 2 Evaluación in vitro de las propiedades biotecnológicas de FCT, ODT y andODFs que contienen 50 mg de Sild. Los resultados son representativos de tres experimentos independientes y se comunican como valores medios ± desviación estándar. A) Los resultados de la prueba de desagregación, indicando el tiempo (en segundos) hasta la desagregación completa de la formulación. Significación: ∗P < 0,05 y ∗∗P < 0,01 entre las formulaciones indicadas. B) Los resultados de la prueba de disolución, indicando la cantidad de Sild liberada por cada formulación como porcentaje de la dosis del medicamento. Significado: aP < 0,01 vs FCT; bP < 0.001 vs ODT. C) Los resultados del ensayo de permeabilidad (detallados en la sección «Materiales y métodos»), en los que se indica la cantidad de Sild impregnada a través de una membrana de acetato de celulosa, como porcentaje del valor más alto alcanzado con 50 mg de polvo de Sild puro (línea discontinua en el panel superior). Significado: ∗P < 0,05 vs ODT; ∗∗P < 0,01 vs ODT; aP < 0,01 vs FCT.
Para evaluar la influencia de esta evidencia en la liberación de fármaco de la formulación, se realizó una prueba de disolución estándar (Farmacopea Europea, 2016; Figura 2B). En comparación con la formulación de referencia FCT, la ODT mostró una liberación más rápida del fármaco cuya extensión máxima se alcanzó incluso después de solo 2 minutos desde el inicio de la prueba (P = 0,006 vs FCT). Por otro lado, el porcentaje de fármaco liberado de la FDD en los primeros 4 min del ensayo fue menor en comparación con FCT y ODT (respectivamente, P = 0,004 y P < 0,001). En particular, la ODF mostró una liberación más progresiva del fármaco en comparación con la FCT, alcanzando la extensión máxima después de 20 minutos desde el inicio de la prueba.
Sobre esta base, la permeación trans-mucosa de Sild de cada formulación se evaluó mediante un dispositivo desarrollado específicamente (Figura 2C). Para fines de referencia, el citrato puro de Sild, utilizado en un peso equivalente a 50 mg de Sild, se evaluó para la permeación trans-mucosa y mostró una difusión libre y rápida entre las dos cámaras. Se observó un perfil casi opuesto para FCT, mostrando una permeabilidad insignificante hasta 30 min desde el inicio de la prueba. Los perfiles de permeación de ODT y ODF mostraron un comportamiento intermedio en comparación con las dos condiciones previas. Dentro de los primeros 20 minutos del ensayo, el ODF mostró un grado de permeación significativamente mayor en comparación con el ODT (respectivamente, P = 0,033 a 5 minutos, P = 0,003 a 10 minutos y P = 0,041 a 20 minutos). A diferencia de FCT y ODT que se desagregaron completamente en la cámara donante, una masa residual de gelatina blanda de ODF persistió en la membrana de acetato de celulosa incluso al final del ensayo (Figura suplementaria S2C).
Farmacocinética diferencial de Sildenafilo
Veinte sujetos varones afectados por DE psicogénico aceptaron recibir alternativamente FCT, ODT u ODF, separados por una semana de lavado. Como se detalla en la sección «Materiales y métodos», la TCF se tragó clásicamente para permitir la administración clásica per os, mientras que la TDO y la FDO se mantuvieron debajo de la lengua durante 15 minutos para promover la vía sublingual. Las características clínicas de los pacientes se describen en la Tabla 1. En la Figura 3 se indican los niveles séricos de Sild correspondientes a las tres condiciones de dosificación. El perfil sérico farmacológico de las tres formulaciones presentaba una variabilidad considerable. En comparación con FCT, la TDO mostró un aumento temprano aparente de los niveles séricos de DSI; sin embargo, esta tendencia no fue estadísticamente significativa. Por otro lado, se observó un decaimiento más rápido de los niveles de Sild a los 120 y 240 min de la dosificación para la formulación de ODT (respectivamente, P = 0,044 y P = 0,024 vs.FCT).
CUADRO 1 Características clínicas de los participantes del estudio (N = 20).
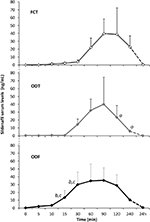
GRÁFICO 3 Evaluación in vivo de los niveles séricos de DSI, en 20 pacientes afectados por DE psicógena, que reciben alternativamente el FCT por sg, el ODT sublingual o el ODF sublingual, como se detalla en la sección «Materiales y métodos.»Los datos son presentados como valores medios ± desviación estándar de Significación: aP < 0,05 vs FCT; bP < 0,01 vs FCT; cP < 0,05 vs ODT.
El perfil sérico farmacológico de la formulación ODF mostró un aumento más rápido de los niveles de Sild en comparación con FCT (P = 0,001 y P = 0,003) y ODT (P = 0,048 y P = 0,041), respectivamente, a los 15 y 30 minutos de la dosificación. De acuerdo con su lento tiempo de desagregación in vitro (Figura 2B), la curva media de concentración–tiempo de ODF in vivo fue más suave que las de FCT y ODT (Figura 3).
Los parámetros farmacocinéticos de las tres formulaciones, obtenidos del análisis de los niveles séricos de Sild, se resumen en la Tabla 2. A pesar de que no se observaron diferencias significativas entre las tres formulaciones en términos de Cmax, tmax y AUC0-240 min, la ODF mostró el valor más bajo de Cmax (38,2 ± 23,7 ng/ml) y el tmax más corto (70,0 ± 24,5 min). En particular, el ODF mostró un valor significativamente mayor del AUC0-60 min en comparación con el FCT y el ODT (respectivamente, P = 0,005 y P = 0).043), lo que da lugar a un aumento de la biodisponibilidad relativa de Sild en la primera hora desde la administración de ODF a través de la vía sublingual.

CUADRO 2 Parámetros farmacocinéticos de las formulaciones de sildenafilo.
Reacciones adversas
Los resultados obtenidos del cuestionario autoadministrado sobre el tipo y las características de RAM experimentadas por los participantes del estudio se resumen en la Tabla 3. Entre las RAM conocidas notificadas para Sild (Taylor et al., 2009), los más frecuentemente registrados fueron dolor de cabeza, rubor y congestión nasal. Un paciente notificó dolor muscular de bajo grado (grado 1 en la escala de evaluación subjetiva) después de la administración de FCT. Ninguno de los pacientes informó alteración de la visión, taquicardia, debilidad o alteración de la audición.

CUADRO 3 Reacciones adversas registradas por los participantes del estudio (N = 20).
En comparación con FCT como formulación de referencia, la TDO mostró una prevalencia no variable de RAM. Sin embargo, la percepción personal de la intensidad del lavado fue significativamente menor (P = 0,031). Por otro lado, la ODF mostró una prevalencia reducida de cefalea en comparación con la FCT (P = 0,043). Además, la duración y la intensidad de la rubefacción y la congestión nasal se percibieron en niveles más bajos en comparación con la FCT (respectivamente, P = 0,011 y P = 0,015) y la ODT (respectivamente, P = 0,026 y P = 0,037).
Discusión
En este estudio, proporcionamos evidencia de que la vía sublingual de administración de Sild se asocia con un aumento de la biodisponibilidad temprana del fármaco y un perfil de tolerabilidad mejorado. Esta evidencia está respaldada por investigaciones in vitro, que muestran que la formulación de Sild se caracteriza por un mayor tiempo de desagregación, pero favoreció significativamente la absorción trans-mucosa, y evidencias in vivo.
Los inhibidores de la fosfodiesterasa son la primera opción terapéutica para el tratamiento de la disfunción eréctil; sin embargo, se reconoce que los efectos secundarios experimentados por los pacientes son la razón más prevalente para la interrupción de la terapia (Corona et al., 2016). La modificación de la farmacocinética mediante el diseño de una nueva formulación de medicamentos puede representar una estrategia atractiva para mejorar el perfil de seguridad/eficacia del medicamento en sí (Mehrotra et al., 2007). A este respecto, la expiración en 2013 de la patente del citrato de Sild en varios países europeos permitió la oportunidad de lanzar una serie de nuevas formulaciones de Sild. Cabe señalar que la mayoría de las formulaciones de Sild disponibles en el mercado hoy en día están aprobadas como formas bioequivalentes del FCT original (Leoni et al., 2013). Curiosamente, se han desarrollado formulaciones de desintegración oral, caracterizadas por una rápida desagregación en la boca del paciente sin la necesidad de tragar con agua (Goel et al., 2008). Estas nuevas formulaciones encuentran un mejor cumplimiento en aquellas poblaciones de pacientes con dificultad para tragar dosis sólidas convencionales, como niños, pacientes geriátricos y pacientes disfágicos. Además, al proporcionar una mayor disponibilidad de fármacos orales, las formulaciones de desintegración oral pueden representar sistemas valiosos para favorecer la absorción trans-mucosa, y en particular sub-lingual (Kathpalia y Gupte, 2013). Particularmente en Italia, dos formulaciones de desintegración oral de Sild están disponibles oficialmente en las instalaciones de farmacia: los ODT y los ODF.
En este estudio, nuestro objetivo fue evaluar las posibles variaciones farmacocinéticas, y el patrón correspondiente de RAM, que se derivan de favorecer la absorción trans-mucosa de Sild a través de la administración sub-lingual de las dos formulaciones de desintegración oral disponibles del fármaco. Los resultados se compararon con la formulación original de Sild, es decir, el FCTs. Curiosamente, encontramos una correlación estricta, tanto in vitro como in vitro, entre las propiedades biotecnológicas y los PK de las diferentes formulaciones. En particular, a pesar de una dosis de fármaco igual (50 mg) y una tasa de liberación de fármaco ligeramente reducida en la prueba de disolución, la ODF se caracterizó por un mayor tiempo hasta la desagregación y una mayor tasa de permeación en el modelo trans-mucoso, por un lado, y por un aumento de la biodisponibilidad del fármaco en la primera hora desde la dosificación, por otro. Entonces podríamos plantear la hipótesis de que la absorción de Sild sub-lingual se ve favorecida por un contacto prolongado entre el fármaco y la mucosa. De hecho, este fenómeno se persigue generalmente para las drogas trans-mucosas orales, donde se recomienda el uso de polímeros mucoadhesivos para asegurar un período prolongado de contacto entre la formulación y la mucosa oral (Lam et al., 2014), en particular de aquellos fármacos, como Sild, afectados por una baja solubilidad en agua (Zayed et al., 2012; Sun et al., 2014). Estos resultados preliminares también sugieren una posible mejora de la eficacia clínica de esta clase de fármacos en comparación con las formulaciones originales. Se requieren más estudios para aclarar estos aspectos.
La evidencia más llamativa del presente estudio es una reducción significativa de las RAM de la administración sub-lingual de la FDO, en comparación con la TDC y la TCF administradas a la misma dosis, lo que a su vez puede resultar en un aumento de la adhesión de los pacientes. Esta evidencia puede interpretarse a la luz del principio de que la incidencia de un efecto secundario del fármaco aumenta al aumentar los niveles séricos y el tiempo de exposición al fármaco en sí (Gupta et al., 2005; Taylor et al., 2009). A pesar de una biodisponibilidad global no variable en comparación con las otras formulaciones analizadas, la administración sub-lingual de ODF mostró un valor más bajo de Cmax y un tmax más corto, lo que resultó en una proporción significativamente mayor de biodisponibilidad de Sild en la primera hora desde la administración. Por lo tanto, podríamos especular que la administración sub-lingual de ODF combina una absorción eficiente del fármaco con el logro de niveles séricos medios más bajos de Sild y un consecuente menor riesgo de RAMs. Sin embargo, reconocemos que el bajo tamaño de la muestra es el principal inconveniente del estudio. Se requiere una investigación adicional en cohortes más grandes y con diferentes dosis para confirmar este problema.
En conclusión, en este estudio reportamos que la administración sublingual de FDD Sild mejora el perfil de tolerabilidad del fármaco a través de la probable participación de una farmacocinética modificada en comparación con los TCF del generador. Aunque la ODF no se concibió originalmente para estos fines, representa una estrategia atractiva para mejorar el cumplimiento de la terapia por parte del paciente. Estamos desarrollando más estudios comparativos para evaluar la eficacia clínica en pacientes con disfunción eréctil psicogénica y orgánica.
Contribuciones de los autores
LDT y CF coordinaron el estudio y redactaron el manuscrito. El MDRP evaluó e inscribió a los pacientes. EF realizó análisis in vitro. El SDA realizó el análisis sérico. RP realizó la comparación farmacocinética. RP, NR y AG revisaron críticamente y finalizaron el manuscrito.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Agradecimientos
Agradecemos al Dr. Alberto Barosso, al Dr. Giuseppe Maggioni y al Dr. Dimitri Portale por el asesoramiento a los pacientes, a la Dra. Flavia Rosano y a la Dra. Alice Passadore por el manejo de los pacientes, y a todo el personal de la Unidad de Andrología y Medicina Reproductiva.
Material suplementario
El Material Suplementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
FIGURA S1 / Imágenes representativas del Probador de Desintegración de Tabletas (A) y del Aparato de Disolución (B) utilizados para la prueba de desagregación y la prueba de disolución, respectivamente.
FIGURA S2 / A) Detalles del gradiente de fase móvil utilizado para el análisis de cromatografía líquida de alta resolución-espectrometría de masas en tándem (HPLC-MS/MS) de los niveles séricos de sildenafilo (Sild). Se notifican cromatogramas representativos y espectros de masa de ambos Sild en la benzanilida estándar interna en muestras reales (B). C) Imagen representativa de una película bucodispersable residual (resaltada por una línea discontinua), que persiste después del ensayo de permeabilidad en el dispositivo utilizado para estimar in vitro la absorción transmucosa a través de una membrana de acetato de celulosa.
HOJA DE DATOS S1 | Cuestionario sobre reacciones adversas a medicamentos.
Nota al pie
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L., and Anderson, R. U. (2007). Sildenafil integrado y terapia sexual cognitivo-conductual para la disfunción eréctil psicógena: un estudio piloto. J. Sexo. Mediterráneo. 4, 1117–1125. doi: 10.1111 / j. 1743-6109. 2007. 00535.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Bischoff, E. (2004). Potencia, selectividad y consecuencias de la no selectividad de la inhibición de la PDE. Int. J. Impot. Res. Suppl. 1, S11-S14. doi: 10.1038 / sj.ijir.3901208
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Boolell, M., Allen, M. J., Ballard, S.A., Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Sildenafilo: un inhibidor de fosfodiesterasa cíclico tipo 5 específico para GMP activo por vía oral para el tratamiento de la disfunción eréctil del pene. Int. J. Impot. Res. 8, 47 a 52.
Resumen de PubMed | Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). Reanudación de erecciones espontáneas en pacientes seleccionados afectados por disfunción eréctil y diversos grados de alteración de la pared carotídea: papel de tadalafilo. EUR. Urol. 48, 326–331. doi: 10.1016 / j.eururo.2005.01.013
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A., and Foresta, C. (2009). Grosor íntima-media de la arteria cavernosa: un nuevo parámetro en el diagnóstico de la disfunción eréctil vascular. J. Sexo. Mediterráneo. 6, 1117–1126. doi: 10.1111 / j. 1743-6109. 2008. 01112.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Carvalheira, A. A., Pereira, N. M., Maroco, J., and Forjaz, V. (2012). Abandono en el tratamiento de la disfunción eréctil con PDE5: un estudio sobre predictores y un análisis cualitativo de las razones de la interrupción. J. Sexo. Mediterráneo. 9, 2361–2369. doi: 10.1111 / j. 1743-6109. 2012. 02787.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Center for Drug Evaluation and Research (2003). NDA 021400 Comprimidos de Levitra (clorhidrato de Vardenafilo) : Revisión de Farmacología Clínica / Biofarmacéutica. Rockville, Md: Departamento de Salud y Servicios Humanos. Silver Spring, MD: Administración de Alimentos y Medicamentos.
Google Scholar
Corona, G., Rastrelli, G., Burri, A., Serra, E., Gianfrilli, D., Mannucci, E., et al. (2016). Abandono de inhibidores de la fosfodiesterasa de tipo 5 de primera generación: una revisión exhaustiva y meta-análisis. Andrología 4, 1002-1009. doi: 10.1111 / andr.12255
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Delvadia, P. R., Barr, W. H., and Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Dirección Europea de Calidad de los Medicamentos & Asistencia Sanitaria (EDQM), 9a Edn. Estrasburgo: Consejo de Europa.
Google Scholar
Fejős, I., Neumajer, G., Béni, S., and Jankovics, P. (2014). Análisis cualitativo y cuantitativo de inhibidores de la PDE-5 en medicamentos falsificados y suplementos dietéticos por HPLC-UV utilizando sildenafil como única referencia. J. Pharm. Biomed. Anal. 98, 327–333. doi: 10.1016 / j. jpba.2014.06.010
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Goel, H., Rai, P., Rana, V., and Tiwary, A. K. (2008). Sistemas de desintegración oral: innovaciones en formulación y tecnología. Pat reciente. Entrega de Drogas. Formul. 2, 258–274. doi: 10.2174/187221108786241660
Texto completo de CrossRef | Google Scholar
Gupta, M., Kovar, A., and Meibohm, B. (2005). Farmacocinética clínica de los inhibidores de la fosfodiesterasa-5 para la disfunción eréctil. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Asociación Europea de Urología. Directrices sobre disfunción sexual masculina: disfunción eréctil y eyaculación precoz. EUR. Urol. 57, 804–814. doi: 10.1016 / j.eururo.2010.02.020
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Hawksworth, D. J., and Burnett, A. L. (2015). Tratamiento farmacoterapéutico de la disfunción eréctil. Clin. Pharmacol. Allí. 98, 602–610. doi: 10.1002 / cpt.261
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Heinig, R., Weimann, B., Dietrich, H., and Böttcher, M. F. (2011). Farmacocinética de una nueva formulación de comprimidos bucodispersables de vardenafilo: resultados de tres ensayos clínicos. Clin. Investig de Drogas. 31, 27–41. doi: 10.2165/11584950-000000000-00000
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Kathpalia, H., y Gupte, A. (2013). An introduction to fast dissolving oral thin film delivery systems: a review (en inglés). Curr. Entrega de Drogas. 10, 667–684. doi: 10.2174/156720181006131125150249
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Lam, J. K., Xu, Y., Worsley, A., and Wong, I. C. (2014). Administración oral de medicamentos transmucosos para uso pediátrico. Drogas Avanzadas Deliv. Apo. 73, 50-62. doi: 10.1016 / j.addr.2013.08.011
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B., and Rodrigues, B. (2013). Sildenafil: dos décadas de beneficios o riesgos? Hombre mayor de 16, 85-91 años. doi: 10.3109 / 13685538.2013.801952
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). El deterioro de la calidad del semen se asocia con disfunción sexual de acuerdo con su gravedad. Zumbido. Reproche. 31, 2668–2680. doi: 10.1093/humrep / dew246
Resumen de PubMed / Texto completo de CrossRef / Google Scholar
Ludwig, W., y Phillips, M. (2014). Causas orgánicas de disfunción eréctil en hombres menores de 40 años. Urol. Int. 92, 1–6. doi: 10.1159/000354931
Resumen de PubMed | Texto completo de CrossRef / Google Scholar
Lugnier, C. (2006). Superfamilia de nucleótidos fosfodiesterasas cíclicas (PDE): una nueva diana para el desarrollo de agentes terapéuticos específicos. Pharmacol. Allí. 109, 366–398. doi: 10.1016 / j. pharmthera.2005.07.003
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Mehrotra, N., Gupta, M., Kovar, A., and Meibohm, B. (2007). The role of pharmacokinetics and pharmacodynamics in phosphodiesterase-5 inhibitor therapy. Int. J. Impot. Res. 19, 253 a 264. doi: 10.1038 / sj.ijir.3901522
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Muñoz, M., Bancroft, J., y Marshall, I. (1993). El rendimiento del Rigiscan en la medición de la tumescencia y rigidez del pene. Int. J. Impot. Res. 5, 69 a 76.
Google Scholar
Porst, H., Burnett, A., Brock, G., Ghanem, H., Giuliano, F., Glina, S., et al. (2013). El Comité de Normas del ISSM para la Medicina Sexual. Tratamiento conservador (médico y mecánico) de la disfunción eréctil. J. Sexo. Mediterráneo. 10, 130–171. doi: 10.1111 / jsm.12023
Resumen de PubMed | Texto Completo de CrossRef / Google Scholar
Sun, D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Absorción oral mejorada y efecto terapéutico de la acetilpuerarina a base de nanoemulsiones de succinato de D-α-tocoferil polietilenglicol 1000. Int. J. Nanomedicine 9, 3413-3423. doi: 10.2147 / IJN.S63777
Resumen de PubMed / Texto Completo de CrossRef / Google Scholar
Taylor, J., Baldo, O. B., Storey, A., Cartledge, J., and Eardley, I. (2009). Diferencias en la duración de los efectos secundarios y los niveles de molestias relacionados entre los inhibidores de la fosfodiesterasa tipo 5. BJU Int. 103, 1392–1395. doi: 10.1111 / j. 1464-410X. 2008. 08328.x
Resumen de PubMed / Texto Completo de CrossRef | Google Scholar
Zayed, R., Kamel, A. O., Shukr, M., and El-Shamy, A. H. (2012). Estudio comparativo in vitro e in vivo de dispersiones sólidas comprimidas directamente y comprimidos sublinguales liofilizados de citrato de sildenafilo para el tratamiento de la hipertensión arterial pulmonar. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar