La adición de una fracción de carbohidratos a una molécula de proteína se conoce como glicosilación de proteínas. Es una modificación post-traslacional común para moléculas de proteínas involucradas en la formación de membranas celulares. Durante este proceso, la unión de unidades de monosacáridos a las cadenas de aminoácidos prepara el escenario para una serie de reacciones enzimáticas que conducen a la formación de glicoproteínas (oligosacáridos unidos n y o que se encuentran en una entidad proteica). En total, se supone que 16 enzimas conocidas median en esta reacción. Una glicoproteína típica tiene al menos 41 enlaces que involucran 8 aminoácidos y 13 unidades de monosacáridos diferentes e incluye los enlaces glicofosfatidilinositol (GPI) y fosfoglicosilo. La glicosilación de proteínas ayuda a plegar adecuadamente las proteínas, a la estabilidad y a la adhesión de célula a célula que comúnmente necesitan las células del sistema inmunitario. Los principales sitios de glicosilación de proteínas en el cuerpo son ER, cuerpo de Golgi, núcleo y el líquido celular.
La glicosilación de proteínas se puede clasificar en dos tipos principales:
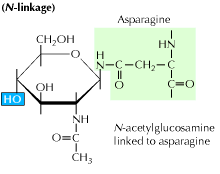 a) glicosilación N-ligada: Comienza con la adición de un precursor de 14 azúcares a un aminoácido asparagina. Contiene moléculas de glucosa, manosa y n-acetilglucosamina. Esta entidad se transfiere entonces al lumen ER. El oligosaccharyl transferasa, enzima une la cadena de oligosacáridos a la asparagina, que se produce en el tripéptido secuencia Asn-X-Ser o Asn-X-Thr. X puede ser cualquier aminoácido que no sea Prolina. La secuencia de proteína unida a oligosacáridos ahora se pliega correctamente y ahora se trasloca al cuerpo de Golgi, donde se elimina el residuo de manosa.
a) glicosilación N-ligada: Comienza con la adición de un precursor de 14 azúcares a un aminoácido asparagina. Contiene moléculas de glucosa, manosa y n-acetilglucosamina. Esta entidad se transfiere entonces al lumen ER. El oligosaccharyl transferasa, enzima une la cadena de oligosacáridos a la asparagina, que se produce en el tripéptido secuencia Asn-X-Ser o Asn-X-Thr. X puede ser cualquier aminoácido que no sea Prolina. La secuencia de proteína unida a oligosacáridos ahora se pliega correctamente y ahora se trasloca al cuerpo de Golgi, donde se elimina el residuo de manosa.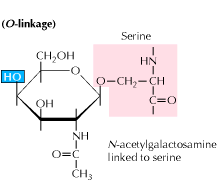
b) Glicosilación ligada a O: La glicosilación comienza con una adición mediada por enzimas de N-acetil-galactosamina seguida de otros carbohidratos a residuos de serina o treonina. Los estudios revelan que la glicosilación ligada a O ocurre en una etapa posterior en el procesamiento de proteínas.