Adhesión celular
La adhesión celular es el proceso por el cual las células interactúan con moléculas específicas en la superficie celular y se adhieren a células adyacentes. Este proceso puede ocurrir a través de interacciones directas o indirectas entre superficies celulares, donde las células se adhieren a la matriz extracelular circundante, que contiene las moléculas liberadas por las células en el espacio entre las células. La adhesión celular ocurre cuando la molécula de adhesión celular (CAM) interactúa con una proteína transmembrana ubicada en la superficie celular. La adhesión celular enlaza a las células de diferentes maneras y puede participar en la transducción de señales para permitir que las células detecten y respondan a los cambios en el entorno circundante. Otros procesos celulares regulados por la adhesión celular incluyen la migración celular y el desarrollo de tejidos en organismos multicelulares. Los cambios en la adhesión celular pueden interrumpir procesos celulares importantes y conducir a una variedad de enfermedades, incluyendo cáncer y artritis. La adhesión celular también es esencial para enfermedades causadas por organismos infecciosos como bacterias o virus.
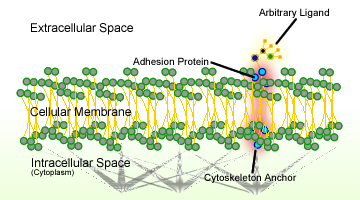 Figura 1. Esquema de adhesión celular
Figura 1. Esquema de adhesión celular
Clasificaciones
Las CAM se dividen en cuatro familias principales: integrinas, superfamilia de inmunoglobulina (Ig), cadherina y selectinas. Cada una de estas moléculas de adhesión tiene una función diferente y reconoce un ligando diferente. Las cadherinas y las inmunoglobulinas son LEVAS homotípicas porque se unen directamente al mismo tipo de CAM en otra célula, mientras que las integrinas y selectinas son levas heterólogas que se unen a diferentes tipos de CAM. Los defectos en la adhesión celular a menudo se atribuyen a defectos en la expresión de CAMs. En los organismos multicelulares, la unión entre CAMs hace que las células se adhieran entre sí y formen una estructura llamada unión celular.
De acuerdo con sus funciones, las uniones celulares se pueden clasificar como:
Uniones de anclaje (adhieren uniones, desmosomas y hemidesmosomas), que mantienen las células a lo largo y fortalecen el contacto entre las células.
Uniones de oclusión (uniones estrechas), que sellan los espacios entre las células a través del contacto celular–celular, creando una barrera resistente al agua para la difusión.
Uniones formadoras de canales (uniones gap), que unen protoplasma de células adyacentes permitiendo el transporte de moléculas entre células.
Uniones de transmisión de señales, que podrían ser sinapsis dentro del sistema.
Alternativamente, las uniones celulares se pueden clasificar en 2 variedades principales de acuerdo con lo que interactúa con la célula: uniones célula–célula, en la mediada principal por cadherinas, y uniones célula–matriz, en la mediada principal por integrinas.
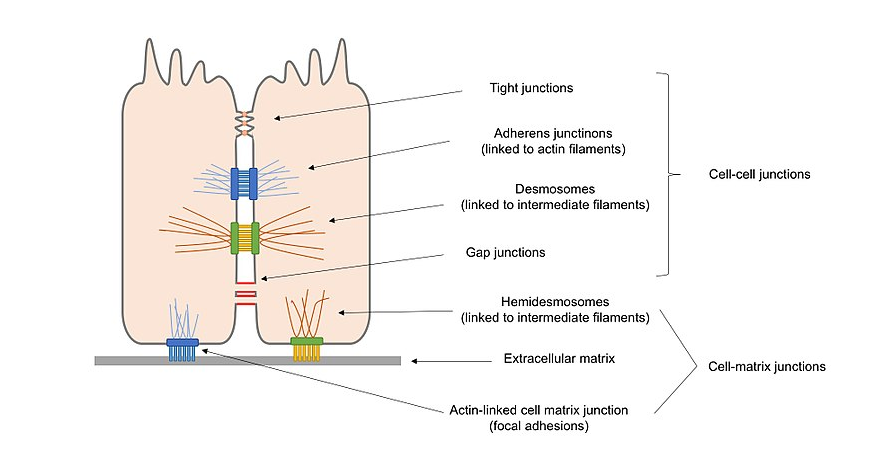 Figura 2. Diagrama general de los diferentes tipos de uniones celulares presentes en las células epiteliales, incluidas las uniones célula–célula y las uniones célula–matriz.
Figura 2. Diagrama general de los diferentes tipos de uniones celulares presentes en las células epiteliales, incluidas las uniones célula–célula y las uniones célula–matriz.
Características estructurales de las proteínas de adhesión celular
Las proteínas de adhesión celular son generalmente glicoproteínas que median el reconocimiento de la matriz extracelular celular y celular en la superficie extracelular. La mayoría de las moléculas de adhesión celular tienen conformaciones similares en sus dominios adhesivos. Por ejemplo: los dominios adhesivos de cadherina, inmunoglobulina, fibronectina tipo III y EGF son predominantemente estructuras de lámina β. El motivo común involucrado en la adhesión celular es la estructura de barril de llave griega que contiene uno o dos sándwiches β anti-paralelos.
Los dominios similares a Ig son una clase importante de dominios de barril de claves griegas. Tienen similitudes de secuencia con el dominio variable o constante de anticuerpos que contienen de siete a nueve hebras β antiparalelas. Las láminas P antiparalelas forman un barril β 3D. Los dominios similares a Ig se estabilizan mediante enlaces hidrofóbicos de núcleo y disulfuro. Se dividen en dos conjuntos principales: dominios Ig similares a C e Ig similares a V.
Características Estructurales Funcionalmente Relacionadas de las Proteínas de Adhesión Celular
Las proteínas de adhesión celular tienen diversidad funcional. La interacción de las moléculas de adhesión celular podría ser interacciones proteína-proteína homofílicas o heterofílicas o interacciones proteína-carbohidrato. Los cambios estructurales de las moléculas de adhesión celular a menudo están relacionados con sus propiedades funcionales.
Interacciones Proteína-Proteína Homofílicas.
Por ejemplo, las cadherinas son moléculas de adhesión homofílica dependientes de Ca2+transmembrana. Las cadherinas son responsables del mantenimiento de las uniones entre células similares en los tejidos. La adhesión célula-célula está mediada por el dominio N-terminal de las cadherinas. Contiene cinco dominios extracelulares similares EC1 a EC5. Estudios cristalográficos de rayos X en N-cadherina mostraron que el dominio EC1 forma un dímero, en el que los monómeros están orientados en paralelo con su superficie de unión adhesiva apuntando hacia afuera desde la membrana plasmática. Las unidades monoméricas de los dominios EC1 interactúan entre sí de manera antiparalela, utilizando sus superficies de unión adhesiva y formando una estructura de barril β. Se sugirió que una interfaz putativa de la interacción tenía un carácter hidrofóbico y polar / cargado que imitaba la interfaz de la interacción de los dominios de inmunoglobulina entre sí en la superfamilia Ig.
Interacciones Heterofílicas Proteína-Proteína.
Por ejemplo, la unión de las integrinas a varios receptores de superficie celular y ligandos de matriz extracelular es una clase importante de interacción proteína-proteína heterofílica en los sistemas de adhesión celular. Al unirse al fibrinógeno soluble, la integrina aIIbß3 se convierte en un estado de unión de alta afinidad. Los cambios conformacionales de la integrina inducidos por la unión de ligandos en este caso son críticos para su actividad adhesiva. La unión de un receptor de células T también puede modular la afinidad de unión de la integrina, el antígeno-1 asociado a la función leucocitaria (LFA-1), a sus receptores como ICAM-l o ICAM-2 (molécula de adhesión de células intercelulares). La unión de ICAM-l puede inducir cambios conformacionales de LFA-1. El sitio de unión adhesiva de la proteína se encuentra en el terminal C de LFA-l según un estudio cristalográfico de rayos X.Un tripéptido, ácido arginina-glicina-aspártico (RGD), es un motivo común de unión de ligandos de integrina. Por ejemplo, el módulo de ligando de unión a integrinas tipo III de fibronectina tiene una estructura de barril de llave griega, cuyo motivo RGD, ubicado en el ápice del bucle que conecta las hebras F y G β, media la adhesión. El enderezamiento del bucle RGD en una conformación fluctuante más lineal al desplegarse reduce la accesibilidad del bucle a las integrinas unidas a la superficie y, por lo tanto, disminuye la afinidad y selectividad de la unión.
Interacciones entre Proteínas y Carbohidratos.
Las selectinas son importantes en la interacción de linfocitos y neutrófilos con el endotelio vascular. Las selectinas son moléculas de adhesión que se unen a los carbohidratos. Todavía no hay datos estructurales directos sobre la unión de selectinas a carbohidratos. Las selectinas se unen a los carbohidratos con baja afinidad y tienen tasas de encendido y apagado muy rápidas.