Introducción
Los tejidos, las células y las estructuras más pequeñas dentro de las células (orgánulos) son en su mayoría agua y, por lo tanto, transparentes. Las imágenes de pequeñas bolsas transparentes de agua dan como resultado imágenes que no contienen mucha información, y en la microscopía, es vital tener algún tipo de contraste o mancha que dé color a las áreas de la muestra y las haga mucho más fáciles de ver. Además, ¿qué pasa si solo desea obtener imágenes de algunas de las estructuras más pequeñas dentro de una célula, como un núcleo o una membrana celular? Colorear toda la celda haría imposible localizar las áreas que le interesan.
La fluorescencia resuelve ambos problemas de contraste y localización. La fluorescencia es donde un objeto emitirá luz después de absorber la luz. Muchos objetos diferentes exhiben fluorescencia, como minerales (la palabra fluorescencia que proviene del mineral fluorita), peces de aguas profundas (la más famosa es la medusa Aequorea victoria, de la que se descubrió la proteína fluorescente verde (GFP)), plantas, productos químicos y muchos más.
Las moléculas fluorescentes (conocidas como fluoróforos) se utilizan para etiquetar muestras, y hay fluoróforos disponibles que emiten luz en prácticamente cualquier color. En un microscopio fluorescente, una muestra se etiqueta con un fluoróforo, y luego se usa una luz brillante (luz de excitación) para iluminar la muestra, que emite fluorescencia (luz de emisión). De esta manera, las muestras son altamente contrastadas con el fondo negro, ya que el fluoróforo emite una luz de color brillante. Al localizar estos fluoróforos en el área de interés, se puede tomar una imagen clara de cualquier parte de una célula, lo que hace que la microscopía de fluorescencia sea una herramienta poderosa para las ciencias de la vida.
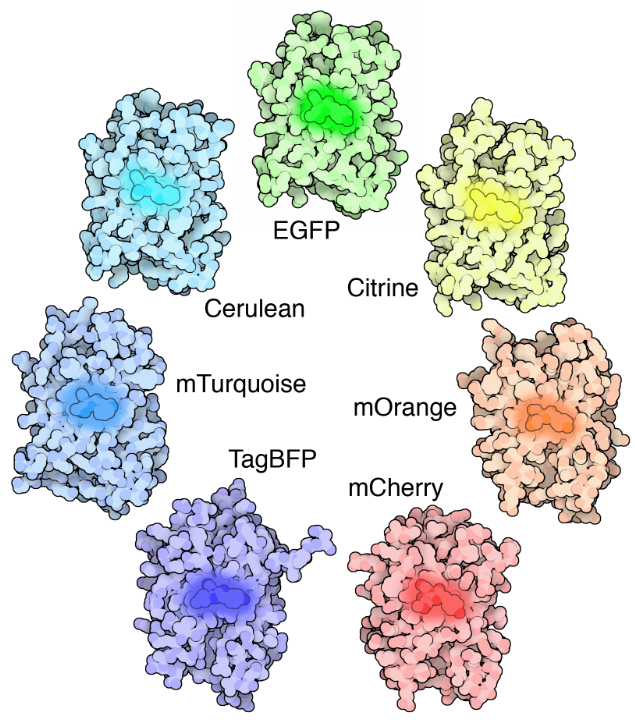
Imagen de campo claro vs fluorescencia
En la microscopía de campo claro, la muestra se ilumina con luz blanca transmitida. Esto crea una iluminación uniforme de la muestra bajo el microscopio para observar muestras altamente contrastadas, teñidas o pigmentadas naturalmente. Sin embargo, el campo claro no es suficiente para distinguir entre células transparentes/translúcidas, sin manchas o estructuras celulares para estudiar procesos de interés.
La microscopía de fluorescencia se basa en el uso de fluoróforos, moléculas que emiten luz de una longitud de onda visible específica cuando se exponen a luz de una longitud de onda diferente. Cuando estos fluoróforos están vinculados a una estructura de interés, los fotones emitidos desde el fluoróforo se puede utilizar para visualizar esta estructura de interés. El beneficio de la microscopía de fluorescencia es que las estructuras objetivo se iluminan mientras que las áreas no deseadas de la muestra tienen poca o ninguna fluorescencia, lo que permite una orientación e imágenes fáciles.
Por qué las moléculas Fluorescen
El origen de la fluorescencia son los electrones que se mueven libremente alrededor del fluoróforo activo y liberan energía absorbida, como se ve en la Fig.2.
Antes de la excitación, los electrones se encuentran en el estado de energía más bajo disponible para ellos, el estado fundamental (S0). Cuando un electrón es golpeado con un fotón de un cierto rango de energía, el electrón absorbe la energía del fotón y salta a un estado de energía superior (S1, S2 o S3). Para volver al estado fundamental (S0), el electrón libera la energía adicional como la emisión de un fotón. La energía de este fotón es menor que la energía de excitación, por lo que tiene una longitud de onda más larga. Esta es la razón por la que la luz de emisión tiene una longitud de onda más larga que la luz de excitación y puede aparecer como un color diferente.
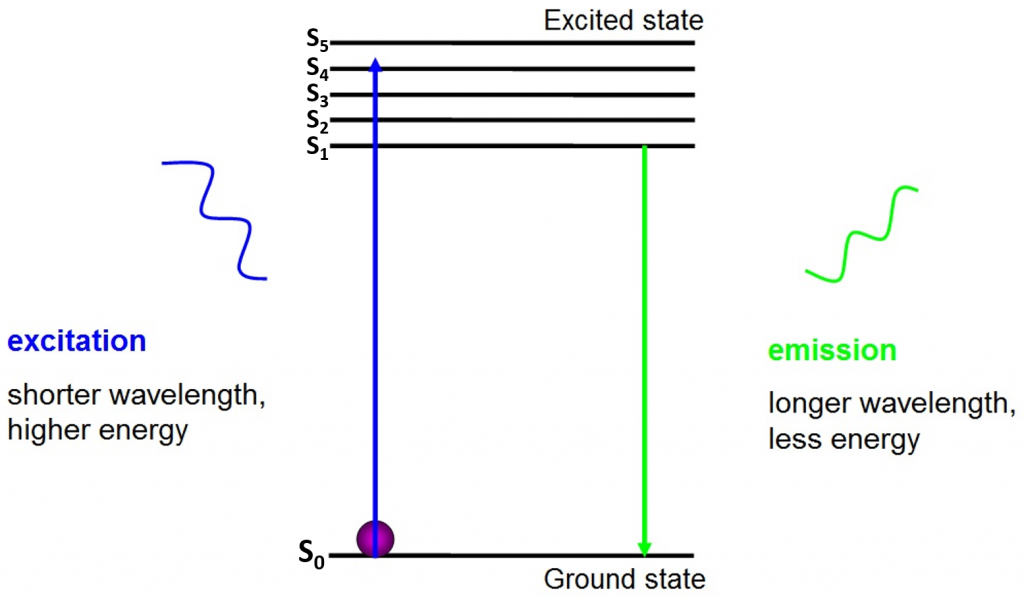
El fotón emitido generalmente se encuentra en el espectro visible y se puede ver bajo un microscopio si hay suficientes fluoróforos excitados. La longitud de onda del fotón liberado es específica para cada fluoróforo y esta previsibilidad permite obtener imágenes de fluorescencia fácilmente.
Factores de intensidad de fluorescencia
Mientras que los fluoróforos pueden emitir fluorescencia de una longitud de onda predecible, también es importante saber qué factores controlan la intensidad de fluorescencia. Sin una emisión de luz lo suficientemente intensa, la fluorescencia no será detectable con un microscopio.
Rendimiento cuántico
El rendimiento cuántico (ϕ) de un fluoróforo es la relación entre el número de fotones liberados y el número de fotones absorbidos. El rendimiento cuántico a menudo se expresa como un valor de 0-1, que 1 es 100% de eficiencia de conversión de fotones. También es importante tener en cuenta que cada fluoróforo tiene un pH, resistencia iónica y temperatura únicos para una eficiencia de fluorescencia óptima.
Coeficiente de extinción
Cada fluoróforo tiene una capacidad diferente para absorber fotones, incluso si están dentro de un rango de longitud de onda apropiado para excitarlo. Si un fluoróforo se expone a un fotón que coincida adecuadamente con su longitud de onda de excitación, la probabilidad de que un fotón sea absorbido es una característica medible y se conoce como coeficiente de extinción (ε).
El rendimiento cuántico y el coeficiente de extinción de un fluoróforo a menudo se muestran juntos para describir cuán brillante se muestra el fluoróforo en entornos experimentales.
Vida útil de la fluorescencia
Cuando un electrón fluoróforo absorbe un fotón, no libera inmediatamente un fotón de longitud de onda más larga. Se sabe que la liberación de cierta energía entre estados de energía excitados toma diferentes períodos de tiempo. La cantidad de tiempo que un electrón pasa en el estado excitado antes de liberar un fotón y regresar al estado fundamental es una medida de su vida útil de fluorescencia. La vida útil de cada fluoróforo es única y se puede medir experimentalmente. Cuando se usan tintes fluorescentes experimentalmente, es útil para su vida útil, especialmente para aplicaciones que requieren alta velocidad, como las neuronas de imágenes de calcio.
Intensidad de longitud de onda de excitación
La mayoría de las configuraciones de microscopía fluorescente incluyen una fuente de luz que se puede ajustar para emitir el rango de longitud de onda deseado. Muchas fuentes de luz fluorescente también se pueden ajustar para la intensidad de excitación para aumentar el número de fotones que se mueven a través de la trayectoria de la luz. En una muestra con etiqueta fluorescente que está expuesta a su longitud de onda de excitación, todos los fluoróforos no se activarán al mismo tiempo. Al aumentar la intensidad de excitación y el número de fotones que llegan a la muestra, hay una mayor probabilidad de que se exciten más fluoróforos.
Fotoestabilidad
La fotoestabilidad es la capacidad de una molécula u organismo para resistir el daño. En la microscopía de fluorescencia, los fluoróforos eventualmente dejarán de absorber los fotones que se aproximan y pasarán a un estado oscuro permanente. A medida que un organismo reúne más fluoróforos en el estado oscuro, la apariencia del blanco etiquetado se reduce, y se dice que la muestra es fotoblanqueada. En la microscopía de fluorescencia, a menudo se toman medidas para reducir la cantidad de fotoblanqueo que se experimenta durante la experimentación. Algunas medidas incluyen una reducción en la intensidad de la luz que interactúa con la muestra y el uso de tintes fluorescentes especializados que no permanecen activos durante tanto tiempo como otros tintes.
Microscopía de fluorescencia
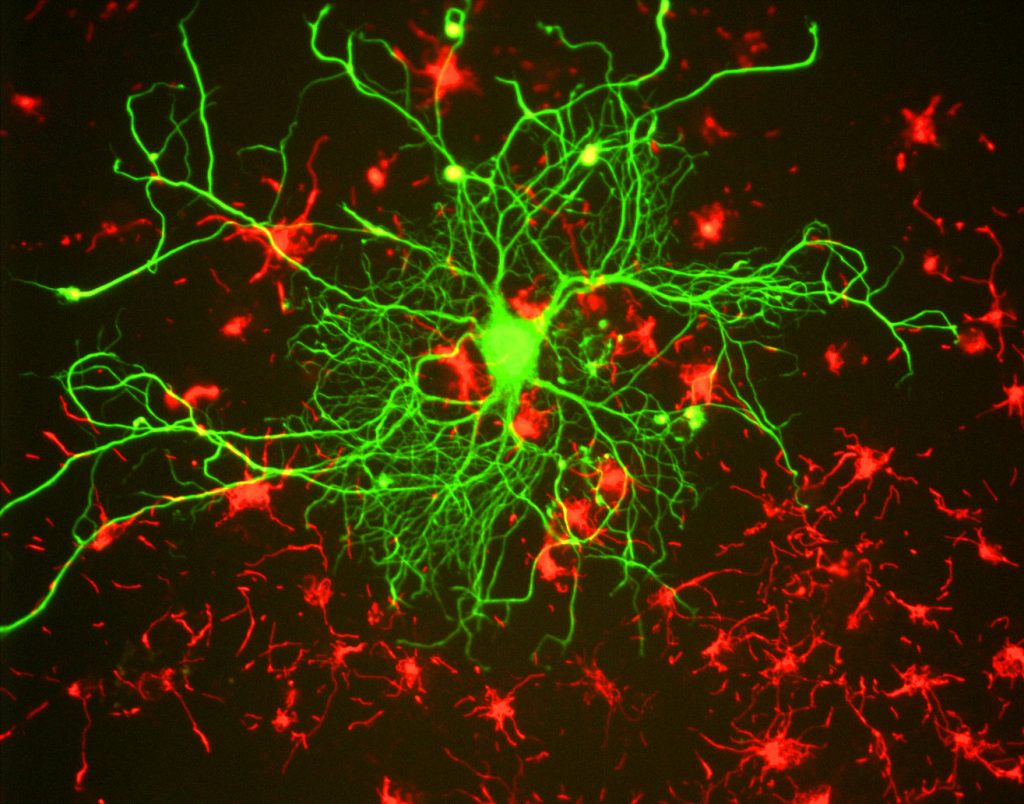
Para los investigadores, el principal beneficio de la fluorescencia es la capacidad de usar microscopía de fluorescencia, donde las muestras se etiquetan/tiñen con una sustancia fluorescente, como un tinte, un anticuerpo o una proteína, lo que permite que las imágenes tengan contraste. Al apuntar a estas etiquetas fluorescentes, los investigadores pueden seleccionar lo que quieren ver. Esto se demuestra en la Fig.3, donde una neurona se puede ver claramente entre los astrocitos, ya que están etiquetados con marcadores fluorescentes de diferentes colores.
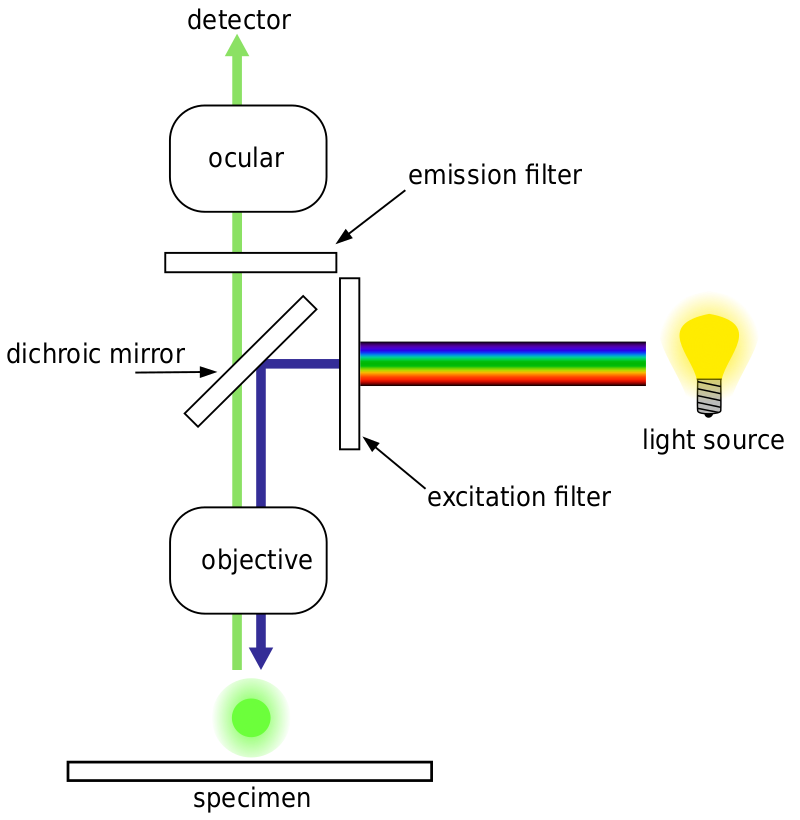
En general, para la microscopía de fluorescencia, una muestra se etiqueta con marcadores fluorescentes (típicamente específicos para ciertas partes de la muestra). La muestra se ilumina con la longitud de onda de excitación específica para el fluoróforo, y la fluorescencia de emisión resultante es recibida por el detector, generalmente una cámara científica sensible.
La mayoría de los microscopios de fluorescencia son microscopios de epifluorescencia, donde la excitación y la emisión se realizan a través de la misma trayectoria de luz. Tanto la iluminación de excitación como la fluorescencia emitida pasan a través del objetivo del microscopio y, por lo general, se filtran para detectar la fluorescencia. Esta configuración se muestra en la Fig.4.
Autofluorescencia
Algunas estructuras, organismos biológicos y muestras de microscopía general pueden exhibir fluorescencia de forma natural, conocida como autofluorescencia. Esto es diferente de la fluorescencia de las muestras etiquetadas, pero a menudo comparte longitudes de onda similares, lo que significa que las muestras de microscopía de autofluorescencia pueden ocultar la fluorescencia añadida artificialmente e interferir con la detección, reduciendo la señal. Es importante saber si sus muestras exhiben autofluorescencia, ya que esto afectará cualquier imagen de fluorescencia realizada a menos que se utilicen longitudes de onda específicas para evitarlo.
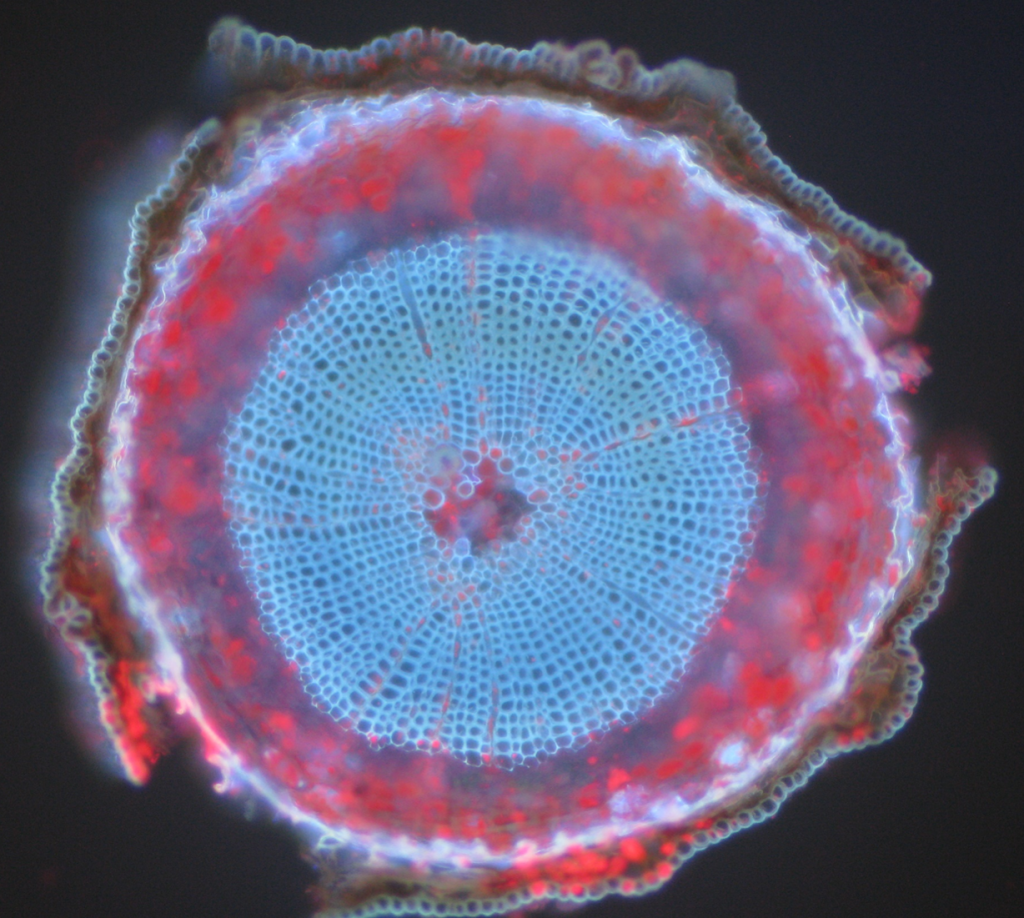
Ejemplos comunes de objetos autofluorescentes son las mitocondrias, los lisosomas, el colágeno y algunos aminoácidos como el triptófano, la tirosina y la fenilalanina. En particular, la autofluorescencia es común en las plantas debido a su uso de clorofila y otras moléculas fluorescentes como las ligninas y los carotenos. Higo.5 muestra los diferentes colores de autofluorescencia de una muestra de pino silvestre sin etiquetar.
Resumen
Desde la introducción del primer tinte fluorescente, la microscopía de fluorescencia ha sido una herramienta muy utilizada para visualizar células y estructuras celulares con mayor especificidad que las técnicas tradicionales de microscopía de campo claro. Los investigadores pueden manipular la estructura, las propiedades ópticas y la sonda de los experimentos de influencia de interés para obtener datos relevantes. Esta flexibilidad ha permitido incluir la microscopía de fluorescencia en muchos experimentos de ciencias de la vida.
Dependiendo del tipo de muestra y fluoróforo, se debe seleccionar cuidadosamente una cámara científica para obtener los mejores resultados de obtención de imágenes.
- Microscopía óptica. (2009) Nature Milestones. MacMillan Publishers Limited, 6-22.
- Lavis, L. D., & Raines, R. T. (2008). Ideas Brillantes para Biología Química. ACS Chemical Biology, 3 (3): 142-155.
- Liu, Y., Lilly, D. (2017) Estructuras cristalinas si los fluoróforos de Cianina se apilan en el extremo del ARN de doble Cadena. Biophysical Journal, 113, (11): 2236-2343.
- Berezin, M. Y., Achilefu, S. (2010). Mediciones de Vida Útil de Fluorescencia e Imágenes Biológicas. Chemical Reviews, 110 (5): 2641-2684.
- Stockert, J., Blázquez-Castro, A. (2017) Microscopía de fluorescencia en Ciencias de la vida. Sharjah, Emiratos Árabes Unidos. Bentham Science Publishers.
- Berezin, M. Y., & Achilefu, S. (2010). Mediciones de Vida Útil de Fluorescencia e Imágenes Biológicas. Chemical Reviews, 110 (5): 2641-2684.
- Denk, W., Strickler, J., Webb, W. (1990). Microscopía de Fluorescencia de Escaneo Láser de Dos Fotones. Ciencia. 248, (1951): 73-76.
- So, P. (2002). Microscopía de Luz de Fluorescencia de Dos Fotones. Grupo Editorial Macmillan.
- Schermelleh, L., Heinztmann, R., and Leonardt, H. (2010). A Guide to Super-Resolution Fluorescence Microscopy (en inglés). The Journal of Cell Biology 190 (2): 165-175.
- Betzig, E., Patterson, G. H., Soutrat, R., Lindwasser, O. W., Olenych, S., Bonifacino, J. S., Davidson, M. W., LippincottSchwartz, J., Hess, H. F. (2006) Imaging intracelular fluorescent proteins at nanometer resolution. Ciencia. 313(5793): 1642-5
- Rust, M. J., Bates, M. & Zhuang, X. (2006) Sub-difraction-limit imaging by stocastic optical reconstruction microscopy (STORM). Métodos Nat. 2, (10):793-5.
- Rego, E., Shao, L., Macklin, J. Winoto, L., Johansson, G., Kamps-Hughes, N., Davidson, M., and Gustasson, M. (2010) PNAS. 109 (3): e135-a143.
- Jungmann, R., Avendaño, M. S., Woehrstein, J. B., Dai, M., Shih, W. M. & Yin, P. (2014) Imágenes de superresolución celular 3D multiplexadas con PINTURA de ADN y PINTURA de intercambio. Métodos Nat. 11(3): 313-318
- Jiang, X., Wang, L., Carroll, S., Chen, J., Wang, M., and Wang, J. (2018) Challenges and Opportunities for Small Molecule Fluorescent Probes in Redox Biology Applications. Antioxidants & Redox Signaling. Mary Ann Liebert, Inc.