INTRODUCCIÓN
Los stent s liberadores de fármacos (SLF) se asocian con tasas significativamente más bajas de revascularización de la lesión diana en comparación con los stent s metálicos (SC). Sin embargo, la terapia antiagregante plaquetaria doble (TAPD) a largo plazo es invariablemente necesaria para evitar la trombosis tardía del stent relacionada con el retraso en la cicatrización, lo que impide el uso frecuente de SLF en pacientes con alto riesgo de hemorragia. Durante muchos años, las directrices han recomendado un período de al menos 12 meses de TAPD basado en el rendimiento de los SFA de primera generación.1 Recientemente, las guías europeas han recomendado 6 meses de TAPD para pacientes estables (nivel de evidencia B).2 Los ensayos y registros de SFA de nueva generación han demostrado tasas de trombosis más bajas en comparación con los SFA de primera generación o incluso los SM.3-7 Un análisis retrospectivo de estudios de SFA de nueva generación informó que la interrupción temprana o la interrupción del TAPD más allá de 1 a 3 meses después del implante no parecía aumentar el riesgo de riesgo.8,9
Varios ensayos compararon distintas duraciones del TAPD (3-6 meses frente a 12-24 meses).10-16 Análisis individuales y un conjunto de 4 de estos ensayos han demostrado que los regímenes de TAPD a corto plazo muestran tasas similares de acontecimientos isquémicos y, al mismo tiempo, disminuyen la incidencia de acontecimientos hemorrágicos.10-17
Sin embargo, algunas advertencias limitan la aplicabilidad generalizada de estos ensayos, incluido el diseño retrospectivo de los análisis y los sesgos asociados, algunos con tamaños de muestra pequeños, adhesión limitada a los protocolos y el uso frecuente de DES obsoletos. Por ejemplo, la versión de la zotarolimus-eluting stent utilizado en estos ensayos se sabe que presentan un grado relativamente elevado de pérdida luminal tardía, ganándose una reputación como un stent cuyo comportamiento está en algún lugar entre un BMS y la nueva generación de DES. Estos ensayos también incluyeron BMS y DES de primera generación.
Presentamos un registro prospectivo multicéntrico destinado a evaluar la seguridad de un enfoque de TAPD de 6 meses en pacientes que recibieron un SFA de no primera generación en comparación con los resultados de una serie emparejada de pacientes que recibieron TAPD de 12 meses.
MÉTODOS
El registro multicéntrico prospectivo ESTROFA-DAPT involucra a 18 centros de toda España. Este análisis forma parte de la Red de Proyectos y Estudios ESTROFA y ha contado con el apoyo del Grupo de Trabajo Español de Cardiología Intervencionista de la Sociedad Española de Cardiología. En cada centro, a los pacientes se les prescribió TAPD con ácido acetilsalicílico y clopidogrel durante 6 meses después del implante del SFA de acuerdo con los siguientes criterios:
- •
Una indicación clínica para intervención percutánea con un SFA de no primera generación en cualquiera de los siguientes entornos clínicos: a) isquemia silenciosa; b) angina estable; c) angina inestable sin elevación de troponina; d) pacientes con infarto de miocardio sin elevación del segmento ST o con elevación del segmento ST sin un riesgo hemorrágico bajo estimado en TAPD a largo plazo, pero que aún se consideran candidatos para el tratamiento con SFA (es decir, pacientes > 75 años, aquellos con antecedentes de úlcera péptica sin hemorragia, insuficiencia renal crónica moderada a grave o enfermedad hepática moderada, y aquellos con cirugía no cardiaca electiva > 6 meses).
- •
En cuanto al procedimiento, se excluyeron las lesiones coronarias del tronco izquierdo, así como las bifurcaciones tratadas con 2 stents o los pacientes que requerían más de 3 stents. También se excluyeron los pacientes con antecedentes de trombosis tardía del SFA.
La decisión de seleccionar estos criterios de inclusión se basó en las siguientes preocupaciones de seguridad: a) El uso de TAPD durante 12 meses después de un síndrome coronario agudo (SCA) está respaldado por evidencia y se recomienda en varias guías clínicas y documentos de consenso.1,2,18-21 Solo se pudieron incluir pacientes con SCA de bajo riesgo y cierto riesgo hemorrágico. b) El estudio tenía un protocolo de seguridad, por lo que se excluyó la inclusión de pacientes con mayor riesgo de trombosis de stent ( 3 stent, bifurcaciones con técnicas de 2 stent y trombosis tardía previa con SFA) y aquellos con alto riesgo de muerte por evento trombótico (stent en arteria principal izquierda).
De hecho, estos subgrupos (SCA, lesiones múltiples y lesiones complejas) mostraron una tendencia a obtener más beneficios después de un período de TAPD más largo frente a los subgrupos con angina estable o lesiones únicas en el ensayo PRODIGY.10
Todos los datos clínicos, angiográficos y de procedimiento basales se notificaron en una base de datos común diseñada específicamente para este estudio. También se presentó información sobre el seguimiento clínico, y estos datos se actualizaron regularmente durante las revisiones de registros y bases de datos de hospitales, así como a través del contacto con los pacientes. Se requirió la verificación del TAPD para el período de TAPD ≤ 6 meses y se confirmó a través del contacto con el paciente. La adjudicación final del evento se llevó a cabo en el centro de coordinación (Hospital Universitario Marqués de Valdecilla) por 2 investigadores ciegos (Doctores De la Torre y García Camarero).
Para comparar esta cohorte con la cohorte de TAPD a 12 meses, revisamos la base de datos del estudio ESTROFA-2, ya publicada en 201022. Se trataba de un registro multicéntrico prospectivo diseñado para evaluar la incidencia de trombosis tras el implante de SFA de segunda generación, que incluía 4768 pacientes; de ellos, 4.354 fueron tratados con TAPD durante 12 meses. Utilizando ambas bases de datos del registro (ESTROFA-TAPD y ESTROFA-2), se realizó un análisis de puntuación de propensión para obtener 2 cohortes comparables de pacientes tratados con TAPD de 6 o 12 meses de duración.
Estos 2 registros, aunque se realizaron en diferentes períodos de tiempo, se construyeron utilizando una metodología similar. El equipo de dirección y coordinación fue el mismo y los formularios de registro clínico basados en la web compartían el mismo formato; la mayoría de los centros activos en ESTROFA-DAPT también reclutaron pacientes en ESTROFA-2 (13 de los 18 centros). Por último, los principales investigadores que participaron en el análisis de las dos bases de datos del registro fueron los mismos. La adjudicación de eventos se llevó a cabo con definiciones de eventos preestablecidas y se solicitó información adicional según fuera necesario para lograr la adjudicación final adecuada.
Variables y Definiciones
La variable principal del estudio fue la supervivencia sin complicaciones a 12 meses (muerte cardíaca, infarto de miocardio, revascularización y hemorragia mayor) en ambos grupos de tratamiento con TAPD. Las variables secundarias incluyeron muerte por cualquier causa, muerte cardíaca, infarto de miocardio no mortal, revascularización coronaria, trombosis definitiva del stent, trombosis definitiva o probable del stent, trombosis definitiva o probable del stent en el período de 6 a 12 meses después de la intervención coronaria percutánea índice y episodios hemorrágicos mayores.
Las definiciones específicas de acontecimientos adversos cardiovasculares mayores fueron las siguientes. El infarto de miocardio se definió como un aumento típico y una caída gradual (troponina), o como un aumento y una caída más rápidos (creatincinasa-MB) de los marcadores bioquímicos compatibles con necrosis miocárdica en asociación con al menos 1 de los siguientes: síntomas isquémicos, el desarrollo de ondas Q patológicas en el electrocardiograma, cambios en el electrocardiograma que indican isquemia (elevación del segmento ST o depresión) o resultados patológicos compatibles con infarto agudo de miocardio. Se definió revascularización como cualquier tipo de revascularización coronaria percutánea o quirúrgica clínicamente indicada. La trombosis definitiva o probable del stent se consideró de acuerdo con las definiciones del Consorcio de Investigación Académica.Se clasificaron 23 episodios hemorrágicos de acuerdo con los criterios del consorcio de investigación académica de hemorragias (BARC).24
Análisis estadístico
Con base en datos previos de ESTROFA-2 en el subgrupo de este registro con un perfil similar al incluido en ESTROFA-TAPD, se asumió una tasa de variable primaria de 6,5 a 7,0% para ambos grupos. Por lo tanto, con una potencia del 80% y un error tipo I de 1 cara del 5%, un tamaño de muestra de 1200 pacientes en cada grupo demostraría no inferioridad entre los 2 grupos para el criterio de valoración primario con un margen fijo de no inferioridad del 2,5%, que está de acuerdo con los márgenes de no inferioridad utilizados en ensayos contemporáneos de SLF y en un ensayo que compara diferentes períodos de TAPD.13 Si el límite superior del intervalo de confianza del 95% de la diferencia en el tratamiento (TAPD a corto frente a largo plazo) fue inferior a 2.5%, se rechazaría la hipótesis nula, lo que significaría que el grupo a corto plazo no era inferior al grupo a largo plazo con respecto a la variable principal a los 12 meses.
Las variables continuas se presentan como media ± desviación estándar. Las variables categóricas se expresan en porcentajes. Las variables continuas se compararon con la prueba de la t de Student si seguían una distribución normal y con las pruebas de Wilcoxon cuando no lo hacían (evaluación del tipo de distribución mediante la prueba de Kolmogorov-Smirnov). Las variables categóricas se compararon con la prueba de chi cuadrado o la prueba exacta de Fischer, según fuera necesario. Se obtuvieron curvas de Kaplan-Meier para la supervivencia libre de eventos para cada grupo o subgrupo considerado en el análisis y se compararon mediante la prueba de rango logarítmico. Se realizaron pruebas de interacción para identificar subgrupos con diferentes riesgos de trombosis de stent en los 2 períodos diferentes de TAPD.
Se realizaron dos acciones para seleccionar series comparables de pacientes de estos 2 registros. En primer lugar, se aplicaron los criterios de exclusión de ESTROFA-TAPD a la base de datos ESTROFA-2, por lo que se excluyó del análisis a los pacientes con lesiones coronarias del tronco izquierdo tratadas, bifurcaciones tratadas con 2 stents, pacientes con más de 3 stents implantados y aquellos con antecedentes de trombosis tardía del SFA. En segundo lugar, realizamos un proceso de emparejamiento de puntuación de propensión. Todas las variables enumeradas en las Tablas 1 y 2 se introdujeron como covariables para obtener las puntuaciones de propensión. El diálogo personalizado «psmatching» se utilizó junto con SPSS versión 19. El programa «psmatching» realiza todos los análisis en R a través del plugin SPSS R (versión 2.10.1). Este procedimiento constó de 3 etapas: a) Las puntuaciones de propensión se estimaron mediante regresión logística, en la que se utilizó como variable de desenlace la prescripción de un TAPD de 6 meses y todas las covariables como predictores. b) Se emparejó a los pacientes mediante el emparejamiento simple del vecino más cercano 1:1, que se basa en un algoritmo de emparejamiento «codicioso» que clasificó las observaciones en el grupo de TAPD de 6 meses por su puntuación de propensión estimada. Este algoritmo luego emparejó cada unidad secuencialmente con una unidad en el grupo de TAPD de 12 meses con la puntuación de propensión más cercana. Para excluir partidos malos, impusimos un calibrador de 0,2 de la desviación estándar del logit de la puntuación de propensión. No se tuvieron en cuenta las unidades fuera del área de apoyo común (definida como la región de la distribución de las puntuaciones de propensión estimadas en los grupos de TAPD de 6 y 12 meses para los que se observaron unidades en ambos grupos). Esto se hizo para mejorar el equilibrio de las covariables. c) Se realizó una serie de comprobaciones de adecuación del modelo para verificar si se logró un equilibrio adecuado de las covariables mediante el procedimiento de emparejamiento. Esto se hizo computando la medida de desequilibrio global y a través de la producción de 5 gráficas de diagnóstico: histogramas de las puntuaciones de propensión en ambos grupos antes y después del emparejamiento, un gráfico de puntos de las puntuaciones de propensión individuales de las unidades en el grupo de control y tratamiento, coincidentes o no, histogramas de las diferencias estandarizadas de todos los términos (covariables, términos cuadráticos, interacciones) antes y después del emparejamiento, un gráfico de puntos que muestra la magnitud de las diferencias estandarizadas antes y después del emparejamiento para cada covariable, y un gráfico lineal de las diferencias medias estandarizadas antes y después del emparejamiento. Se proporciona una prueba de chi cuadrado de desequilibrio general. Este estadístico de prueba, que está relacionado con el conocido estadístico T2 de Hotelling, evalúa simultáneamente si alguna variable o cualquier combinación lineal de variables está significativamente desequilibrada después de la coincidencia. La prueba examinó todas las covariables utilizadas para estimar la puntuación de propensión. Se calcularon diferencias estandarizadas para todas las covariables antes y después del emparejamiento para evaluar el equilibrio después del emparejamiento. Un estándar de diferencia
Características Clínicas en Grupos comparables
| 6-mes DAPT (n = 1286) | 12-mes DAPT (n = 1286) | P | ASD (%) | |
|---|---|---|---|---|
| Edad, años | 67.3 ± 11 | 67.1 ± 11 | .6 | 4.4 |
| las Hembras | 304 (23.5) | 300 (23.3) | .9 | 1.1 |
| Fumador | 270 (21.0) | 286 (22.2) | .5 | 4.3 |
| la Hipertensión | 849 (66) | 836 (65) | .6 | 3.5 |
| la Dislipidemia | 769 (59.8) | 751 (58.4) | .5 | 3.3 |
| la Diabetes mellitus | 526 (40.9) | 502 (39.0) | .3 | 5.7 |
| Deterioro de la función renal* | 103 (8.0) | 99 (7.7) | .8 | 1.8 |
| Anterior MI | 279 (21.7) | 270 (20.9) | .7 | 2.6 |
| Anterior PCI | 370 (28.8) | 355 (27.6) | .4 | 5.6 |
| Anterior CABG | 63 (4.9) | 71 (5.5) | .5 | 4.9 |
| la FEVI, % | 56 ± 12.5 | 56.2 ± 12.5 | .8 | 2.1 |
| la angina Estable | 591 (45.9) | 581 (45.1) | .7 | 2.5 |
| Angina inestable | 342 (26.6) | 351 (27.3) | .4 | 5.6 |
| Sin elevación del segmento ST MI | 140 (10.8) | 150 (11.6) | .3 | 6.7 |
| elevación del segmento ST MI | 54 (4.2) | 59 (4.6) | .5 | 4.2 |
| isquemia Silenciosa | 159 (12.3) | 145 (11.3) | .3 | 6.6 |
TEA: diferencia absoluta estandarizada; CABG: injerto de derivación de arteria coronaria; TAPD: terapia antiagregante plaquetaria dual; ICP: intervención coronaria percutánea; IAM: infarto de miocardio; FEVI: fracción de eyección del ventrículo izquierdo.
A menos que se indique lo contrario, los datos se expresan como No. (%) o media ± desviación estándar.
La insuficiencia renal se definió como creatinina sérica > 1,5 mg/dL.
de Procedimiento Características en Grupos comparables
| 6-mes DAPT (n = 1286) | 12-mes DAPT (n = 1286) | P | ASD (%) | |
|---|---|---|---|---|
| No. de los stents implantados | 1.17 ± 0.40 | 1.19 ± 0.40 | .2 | 7.2 |
| Stent de longitud, mm | 21.0 ± 8.0 | 21.2 ± 8.4 | .5 | 4.5 |
| diámetro del Stent, mm | 2.90 ± 0.40 | 2.91 ± 0.40 | .5 | 3.4 |
| In-stent restenosis | 96 (7.4) | 82 (6.3) | .3 | 6.7 |
| Bifurcation | 198 (15.4) | 217 (16.8) | .3 | 7.1 |
| Chronic total occlusions | 90 (7.0) | 72 (5.6) | .2 | 7.7 |
| LAD involvement | 602 (46.8) | 605 (47.0) | .9 | 0.9 |
| IVUS guidance | 71 (5.5) | 78 (6.0) | .6 | 3.5 |
| EES | 688 (53.5) | 646 (50.2) | .1 | 7.8 |
| Acetylsalicylic acid + clopidogrel | 1286 (100) | 1286 (100) | 1 | 0 |
ASD, absolute standardized difference; DAPT, dual antiplatelet therapy; EES, everolimus-eluting stent; IVUS, intravascular ultrasound; LAD, left anterior descending artery.
A menos que se indique lo contrario, los datos se expresan como No. ( % ) o media ± desviación estándar.
Un valor de P
RESULTADOS
Como se muestra en el diagrama de flujo del estudio (Figura 1), a partir de las cohortes originales de ESTROFA-2 y ESTROFA-TAPD y después de realizar el emparejamiento por puntuación de propensión, obtuvimos 2 grupos de 1268 pacientes cada uno: los grupos de TAPD de 6 meses y TAPD de 12 meses. Las características clínicas y de procedimiento de los 2 grupos se presentan en las Tablas 1 y 2. Se proporcionan las diferencias estandarizadas posteriores al emparejamiento estimadas para todas las covariables. Todos fueron
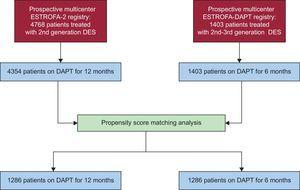
Diagrama de flujo del estudio. TAPD: terapia antiagregante plaquetaria dual; SFA: stents liberadores de fármacos.
en Cuanto DES de distribución, el más utilizado en la DES en ambos grupos fue el de everolimus-eluting stent (53.5% en los 6 meses de DAPT grupo vs 50.2% en 12 meses de DAPT grupo; P = .1). En 28 pacientes se utilizó el stent liberador de zotarolimus.el 8% del grupo DAPT de 6 meses frente al 49,8% del grupo de 12 meses, coincidiendo con las marcas Resolute® y Endeavor®, respectivamente. El stent liberador de biolimus se utilizó en el 12,7% del grupo de TAPD de 6 meses.
No se perdieron pacientes en el seguimiento y las tasas de adherencia al tratamiento fueron del 97% y del 95% en los grupos de TAPD de 6 y 12 meses, respectivamente. Esto significa que solo el 3% en el grupo de TAPD de 6 meses prolongó la terapia dual más allá de los 6 meses y solo el 5% en el grupo de TAPD de 12 meses prolongó la terapia dual más allá del primer año.
Los acontecimientos clínicos a los 12 meses de seguimiento se muestran en la Tabla 3. No se observaron diferencias significativas entre los grupos para la variable principal (cociente de riesgos instantáneos = 0,75; intervalo de confianza del 95%, 0,54-1,05 para TAPD de 6 meses frente a 12 meses) ni para ninguna de las variables consideradas, obteniendo un P = .001 por no inferioridad. No solo hubo una incidencia similar de eventos isquémicos en los grupos de TAPD de 6 y 12 meses, sino que también la incidencia de trombosis definitiva y definitiva o probable fue numéricamente menor en el grupo de 6 meses (Figuras 2 y 3). Los episodios hemorrágicos mayores fueron numéricamente más frecuentes en el grupo de TAPD a 12 meses, pero no difirieron significativamente en comparación con el grupo de TAPD a 6 meses. La incidencia de acontecimientos clínicos en el periodo de 6 a 12 meses se muestra en la Tabla 4 mientras los pacientes estaban sin TAPD/con TAPD en los grupos de TAPD de 6 y 12 meses, respectivamente. No se observaron diferencias entre los grupos en este período.
los Resultados a los 12 Meses de Seguimiento
| 6-mes DAPT (n = 1286) | 12-mes DAPT (n = 1286) | P | |
|---|---|---|---|
| el punto final Primario | |||
| muerte Cardiaca, infarto de miocardio, revascularización o BARC ≥ 3 sangrado | 65 (5.0) | 85 (6.6) | .09 |
| Variables secundarias | |||
| Muerte por cualquier causa | 21 (1.6) | 24 (1.9) | .4 |
| la muerte Cardiaca | 11 (0.9) | 13 (1.0) | .9 |
| infarto de Miocardio | 10 (0.85) | 13 (1.00) | .8 |
| la Revascularización | 41 (3.2) | 55 (4.3) | .1 |
| trombosis Definitiva | 3 (0.24) | 5 (0.40) | .5 |
| Definitiva y la probable trombosis | 6 (0.5) | 9 (0.7) | .4 |
| BARC ≥ 3 episodios hemorrágicos | 10 (0.8) | 18 (1.4) | .2 |
BARC: Bleeding Academic Research Consortium; TAPD: terapia antiagregante plaquetaria dual.
Los datos se expresan como No. (%).
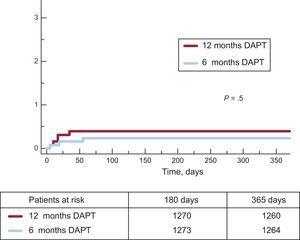
Incidencia acumulada de trombosis definitiva del stent en ambos grupos. DAPT: terapia antiagregante plaquetaria dual.
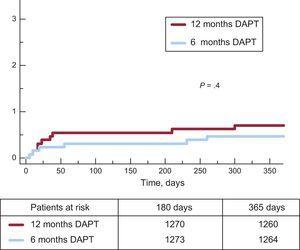
Incidencia acumulada de trombosis definitiva o probable del stent en ambos grupos. TAPD, doble terapia antiagregante plaquetaria.
los Resultados De 6 a 12 Meses
| 6-mes DAPT (n = 1272)* | 12-mes DAPT (n = 1270)* | P | |
|---|---|---|---|
| el punto final Primario | |||
| muerte Cardiaca, infarto de miocardio, revascularización o BARC ≥ 3 sangrado | 38 (2.9) | 54 (4.2) | .1 |
| Variables secundarias | |||
| Muerte por cualquier causa | 7 (0.55) | 8 (0.60) | .8 |
| la muerte Cardiaca | 3 (0.23) | 4 (0.31) | .8 |
| infarto de Miocardio | 3 (0.23) | 5 (0.40) | .8 |
| la Revascularización | 32 (2.5) | 44 (3.5) | .2 |
| trombosis Definitiva | 0 (0.0) | 0 (0.0) | |
| Definitiva y la probable trombosis | 2 (0.15) | 2 (0.15) | .9 |
| BARC ≥ 3 episodios hemorrágicos | 2 (0.15) | 5 (0.40) | .5 |
BARC: Bleeding Academic Research Consortium; TAPD: terapia antiagregante plaquetaria dual.
Los datos se expresan como No. (%).
Número de pacientes vivos a los 6 meses de seguimiento.
análisis de Subgrupos reveló que no hay ninguna interacción significativa. Cabe destacar que en el subgrupo de pacientes con o sin infarto de miocardio con elevación del segmento ST, que comprendía el 15% de los pacientes en el grupo de TAPD a 6 meses y el 16,2% en el grupo de TAPD a 12 meses, la variable principal se alcanzó en el 7,7% y el 8,1%, respectivamente (P = .8).
DISCUSIÓN
Los resultados de este estudio sugieren que, en pacientes seleccionados (que representan alrededor del 40% de los pacientes tratados con SFA), un régimen de TAPD de 6 meses parece ser tan seguro como un régimen de TAPD de 12 meses desde la perspectiva de las tasas de eventos isquémicos.
El uso de SLF reduce significativamente la necesidad de repetir la revascularización coronaria. Los SFA de nueva generación, en particular los stents liberadores de everolimus, están relacionados con reducciones en las tasas de trombosis en comparación con los SFA de primera generación, o incluso con el SM.3-7 Por lo tanto, una limitación importante para el uso de SLF reside en la necesidad de un régimen de TAPD a más largo plazo en comparación con el régimen de TAPD de 1 mes después del implante de SC. El TAPD a largo plazo se asocia con un mayor riesgo de sangrado y un mayor costo. Estas limitaciones explican por qué, en algunos entornos sin restricciones aparentes en el uso de SLF, hasta el 15% al 20% de los pacientes parecen no beneficiarse de los SLF, especialmente entre la población de edad avanzada.
En varios ensayos se comparó un período corto de 3 a 6 meses con un período más largo de 12 a 24 meses.10-16 Un análisis conjunto de los primeros 4 ensayos publicó evidencia de la ausencia de una diferencia significativa en los eventos isquémicos entre los períodos más cortos y más largos, pero la incidencia de sangrado fue mayor en el período más largo.17 Recientemente se han presentado tres ensayos adicionales que abordan períodos de TAPD cortos o largos.14-16 El ensayo DE SEGURIDAD14 comparó TAPD de 6 meses frente a 12 meses en 1.399 pacientes de bajo riesgo tratados con SFA de segunda generación en angina estable o inestable (se excluyó el infarto como indicación de intervención coronaria percutánea). No se observaron diferencias para ninguna de las variables clínicas a los 12 meses. La principal limitación fue el tamaño de la muestra, la baja adherencia al protocolo (el 34% de los pacientes asignados a 6 meses continuaron con TAPD después de 6 meses) y la inclusión de pacientes de bajo riesgo anatómico. En el ensayo ITALIC, 15 1894 pacientes con ausencia demostrada de resistencia al ácido acetilsalicílico fueron aleatorizados a TAPD de 6 meses frente a 24 meses después del implante de un Xience®. stent. No se encontraron diferencias en ninguno de los criterios de valoración clínicos, incluidas las complicaciones hemorrágicas. Por último,el ensayo ISAR-SAFE, 16 que aún no se ha publicado, estaba previsto reclutar a 6.000 pacientes, pero se interrumpió después de la inclusión de 4.000 pacientes. Se aleatorizaron a TAPD de 6 o 12 meses después del implante de SLF (89% de nueva generación). De nuevo, no se observaron diferencias en ninguna de las variables de eficacia o seguridad.
Sin embargo, estos estudios tienen algunas limitaciones. Siendo los ensayos clínicos, clínicas de la representatividad es limitado, el protocolo de adhesión fue inadecuada,10,14 la primera generación de DES fueron utilizados,10,11,16, así como de BMS,10 ácido acetilsalicílico resistencia fue preconfiguradas,15 y la primera versión de zotarolimus-stents liberadores de fármacos, con la pérdida luminal tardía cerca de BMS, fueron ampliamente, o incluso exclusivamente utilizados.10,12,13
El ensayo de TAPD grande 25 evaluó un periodo de TAPD superior a 12 meses después del implante del SFA. En ese estudio, los pacientes con un período sin incidentes de 12 meses después de la intervención coronaria percutánea se aleatorizaron a la interrupción del TAPD en ese momento o a un período prolongado de TAPD (hasta 30 meses). Se incluyeron pacientes tratados con SLF de primera y segunda generación. El periodo de TAPD más largo (30 meses) dio lugar a una disminución de los acontecimientos adversos cardíacos, pero a un aumento de las hemorragias en comparación con el periodo de 12 meses. Sin embargo, el tipo SLF alcanzó la interacción para el criterio de valoración (hazard ratio = 0,52 para el stent liberador de paclitaxel y hazard ratio = 0.89 para el stent liberador de everolimus con P = .048 para la interacción).
Los registros clínicos que evalúan el riesgo de trombosis tras la retirada temprana del TAPD también están limitados por su diseño retrospectivo.8,9 Son notables varios sesgos, ya que la retirada del tratamiento podría haberse decidido tras una cuidadosa consideración del riesgo de trombosis. Hay una falta de grandes registros prospectivos de la práctica del mundo real que evalúen períodos de TAPD más cortos.
Finalmente, una característica importante que limita la aplicabilidad de un régimen de TAPD a corto plazo es que los pacientes en el contexto de un evento coronario inestable (la mayoría de los pacientes sometidos a intervención coronaria percutánea en la actualidad) se benefician de un período de TAPD de 12 meses en comparación con un período de tratamiento de 1 mes.18,19 Sin embargo, no sabemos si este beneficio se mantiene cuando se compara un régimen de 12 meses con un régimen de 6 meses. Por lo tanto, el debate sigue abierto y se justifican ensayos prospectivos y/o registros diseñados adecuadamente que utilicen SFA de generación actual.
Siguiendo estas consideraciones, se buscó diseñar este registro prospectivo multicéntrico ESTROFA-TAPD que evaluara un régimen de TAPD de 6 meses. Los criterios de inclusión se seleccionaron para incluir principalmente a pacientes con enfermedad coronaria estable. En cuanto a los pacientes inestables, solo se incluyeron aquellos con angina inestable y sin aumento de marcadores cardíacos. También se incluyeron pacientes con infarto de miocardio con elevación del segmento ST o con infarto de miocardio sin elevación del segmento ST con un riesgo hemorrágico que no eliminaba necesariamente la necesidad de SLF en favor de una opción de SC. Hay disponibles varias puntuaciones de riesgo de hemorragia intrahospitalaria para su uso en pacientes con SCA, pero estos algoritmos no se diseñaron ni estandarizaron para predecir el riesgo de hemorragia en el contexto del TAPD a largo plazo. Por lo tanto, esta decisión se dejó a discreción de los investigadores para considerar el equilibrio entre reestenosis y riesgo de sangrado. En cuanto al procedimiento, se excluyeron los pacientes con stent para lesiones coronarias del tronco izquierdo, así como las bifurcaciones tratadas con una estrategia de 2 stent o los pacientes que requerían más de 3 stent, dado el riesgo considerablemente mayor de trombosis del stent en estos casos10.
Para poder comparar eficazmente los resultados de nuestra serie de cohortes de TAPD de 6 meses frente a 12 meses, utilizamos la cohorte de TAPD de 12 meses de la base de datos del estudio ESTROFA-2.22 Este registro publicado previamente incluyó 4.768 pacientes reclutados prospectivamente tratados con SLF de segunda generación y, entre ellos, 4.354 (91%) tratados con un régimen de TAPD de 12 meses de acuerdo con las directrices existentes en ese momento.
Se siguieron dos pasos para obtener series comparables de pacientes de estos registros. En primer lugar, se excluyó a los pacientes de ESTROFA-2 que presentaban criterios de exclusión de ESTROFA-TAPD (específicamente aquellos con lesiones coronarias del tronco izquierdo tratadas, bifurcaciones tratadas con 2 stents, pacientes con más de 3 stents implantados y aquellos con antecedentes de trombosis tardía del SFA). En segundo lugar, se llevó a cabo un proceso de emparejamiento de puntuación de propensión.
Finalmente, en el análisis de resultados se incluyeron 2 grupos comparables en todas las características clínicas y del procedimiento. En ambos registros solo se incluyeron SLF de no primera generación con una proporción similar de stents liberadores de everolimus. Sin embargo, el modelo de stent liberador de zotarolimus difería, con Endeavor® en TAPD a 12 meses (ESTROFA-2) y Resolute® en TAPD a 6 meses (ESTROFA-TAPD). El stent Endeavor®, la primera versión de los stent liberadores de zotarolimus, mostró una pérdida de luz tardía cercana a la de BMS (0,6 mm), mientras que el stent Resolute® mostró una pérdida de luz tardía de alrededor de 0,15 mm. De hecho, los ensayos RESET y OPTIMIZE no encontraron diferencia entre el TAPD de 3 y 12 meses con el uso del stent Endeavor®.12,13 Por lo tanto, este factor diferencial podría haber influido negativamente en los resultados en el grupo de TAPD a 6 meses, pero este no parece haber sido el caso. Por lo tanto, esta diferencia apoya los resultados del enfoque de TAPD de 6 meses.
Limitaciones
Una limitación importante de nuestro estudio es la falta de aleatorización. Los registros conllevan el problema del sesgo secundario a factores de confusión conocidos y desconocidos que no siempre se tienen en cuenta tras un ajuste estadístico cuidadoso con análisis coincidentes, como la puntuación de propensión.
Sin embargo, aunque los ensayos aleatorizados son el diseño más apropiado para comparar tratamientos, los registros siguen siendo una fuente importante de conocimiento e información, dadas las advertencias bien reconocidas de los ensayos aleatorizados, como los tamaños de muestra que limitan los costos, la inclusión restrictiva más allá de los criterios de exclusión, la investigación no independiente o la ausencia de un manejo y seguimiento de pacientes con «práctica real completa».
Una segunda limitación es el tamaño relativamente pequeño de la muestra de varios subgrupos, especialmente el subgrupo de SCA, lo que no permite extraer conclusiones firmes sobre la seguridad del TAPD a corto plazo en esos entornos. Otra limitación es la naturaleza de la selección de pacientes. Como se describe en los» Métodos», el estudio se basó principalmente en la seguridad. Los subgrupos con un beneficio demostrado siguientes 12 meses de DAPT (pacientes con SCA sin alto riesgo de sangrado)18,19 y aquellos con un mayor riesgo de trombosis y muestra una tendencia para beneficio de más DAPT en los ensayos, fueron sistemáticamente excluidos.10
Una consideración importante son los diferentes períodos de reclutamiento en ambos registros. Sin embargo, la influencia potencial de este intervalo de tiempo podría haberse atenuado por los siguientes factores: a) Solo se utilizaron SLF de nueva generación en ambos registros; b) Solo se incluyeron en el análisis los pacientes tratados con clopidogrel. En el registro más reciente de ESTROFA-DAPT, los pacientes no fueron tratados con nuevos antiagregantes plaquetarios por protocolo, según los criterios de inclusión (pacientes en condiciones clínicas estables o después de SCA, pero con riesgo de hemorragia moderadamente alto); c) La metodología de ambos registros fue bastante similar, como se mencionó anteriormente en la sección» Métodos».
CONCLUSIONES
Un periodo de TAPD de 6 meses tras el implante de SLF de nueva generación no parece ser inferior a un régimen de TAPD de 12 meses en los contextos clínico y angiográfico evaluados en este estudio multicéntrico.
FINANCIACIÓN
Este estudio ha sido financiado por el Grupo de Trabajo Español de Cardiología Intervencionista para Formularios Web de Reporte de Casos (IRC) de la Sociedad Española de Cardiología.
CONFLICTOS DE INTERESES
Ninguno declarado.