Fluoresenssispektroskopia
Fluoresenssispektroskopiaa käytetään rutiininomaisesti tutkittaessa konjugoitujen systeemien, aromaattisten molekyylien ja jäykkien tasomaisten yhdisteiden rakennemuutoksia, jotka johtuvat lämpötilan, pH: n, ionilujuuden, liuottimen ja ligandien muutoksista. Yksi fluorofori voi tuottaa tuhansia havaittavia fotoneja, joita voidaan toistuvasti virittää ja havaita, joten fluoresenssispektroskopia on erittäin herkkä tekniikka.
fluoresenssi on säteilypäästötyyppi, joka syntyy, kun molekyyli absorboi energiaa aallonpituudella, jossa sillä on siirtymämomentti. Molekyylille maanpäällisessä tilassa tarjottava eksitaatioenergia edistää fotonit virittyneeseen singlettitilaan, jossa ne sitten hajoavat tämän virittyneen singlettitilan alimmalle värähtelyenergiatasolle. Tämä energia rentoutuu edelleen takaisin molekyylin maatilaan ja lähettää fotoneja prosessissa, kuten kuvassa 1 esitetään.
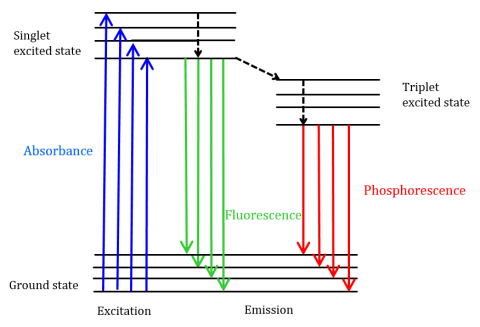
Fluoresoiville molekyyleille voidaan tehdä myös kolme nonradatiivista relaksaatiomenetelmää, joissa heräteenergiaa ei muuteta fotoneiksi: 1) sisäinen muunnos, 2) ulkoinen muunnos ja 3) intersystem crossing. Sisäinen muuntuminen tapahtuu, kun kahden elektronisen tilan välillä on suhteellisen pieni energiakuilu ja elektronit siirtyvät korkeammasta elektronisesta tilasta pienemmän energian tilaan. Tässä energia siirtyy elektronisen tilan värähtelytiloihin. Koska värähtelyprosessit ovat lämpövetoisia, lämpötilan nousu johtaa fluoresenssin voimakkuuden vähenemiseen. Ulkoisessa muuntamisessa energiaa menetetään solutiivisten molekyylien kanssa solumolekyylien avulla fluoroforin ympäristössä. Intersystem crossing syntyy, kun singletin ja tripletin viritettyjen tilojen värähtelytasot menevät päällekkäin energiassa ja elektronit siirtyvät alimmasta singletin viritetystä tilasta ensimmäiseen viritettyyn tripletin tilaan. Kun fotonit palaavat takaisin maan pinnalle, niitä kutsutaan fosforesenssiksi (Kuva 1). Triplettitilan energia on matalampi kuin singlettitilan, joten fosforesenssihuiput esiintyvät fluoresenssia pidemmillä aallonpituuksilla. Koska nämä siirtymät ovat myös kiellettyjä, fosforesenssin käyttöikä on pidempi (~10-4 – 102 sekuntia) verrattuna fluoresenssiin (~10-9-10-6 sekuntia). Pidempi elinikä johtaa myös termiseen deaktivointiin hapen sammuttamisen, liuottimien liikkeen ja molekyylien välisen törmäyksen kautta, joten fosforesenssia ei yleensä voida havaita huoneenlämmössä ja näytteet on siksi jäähdytettävä nestemäisen typen lämpötilassa.
oluen laki ja Konsentraatiovaikutukset
vaikka imeytyminen tapahtuu alle 10-15 sekunnin aikajänteellä, relaksaatioprosessi kiihtyneestä maahan on paljon hitaampaa. Siksi fluoresenssi voi antaa tietoa fluoriforien vuorovaikutuksista ympäröivien molekyylien ja liuottimien kanssa toisin kuin imeytyminen.
fluoresenssin intensiteetti on suoraan verrannollinen magnetointivalon intensiteettiin
F = 2.303 * K * I0 * ebc
missä K on vakio instrumenttigeometriaan perustuen, I0 on herätevalon voimakkuus, e on fluoriforeen mooliabsorboituvuus, b on polkuväli ja C on konsentraatio. Koska fluoresenssin intensiteettiä ei suhteuteta tapahtuman valon intensiteettiin, kuten absorptiomittauksissa, fluoresenssin herkkyys on paljon suurempi, koska instrumenttien kyky erottaa tapahtuman ja havaitut intensiteetit ei rajoita sitä. Näin ollen mittauksiin tarvitaan pienempiä pitoisuuksia.
yllä oleva yhtälö on lineaarinen vain, kun näytteen absorbanssi on alle 0, 05 AU. Jos näyte on liian konsentroitu, fluorofori voi absorboida emissiovalon uudelleen, jolloin fluoresenssisignaali vaimenee lyhyemmillä aallonpituuksilla. Magnetointivalo ei myöskään välttämättä läpäise täysin voimakkaasti tiivistetyn näytteen koko leveyttä, mikä johtaa myös fluoresenssin voimakkuuden vähenemiseen.
Fluoresenssispektroskopian
Fluoresenssispektrin ominaisuudet
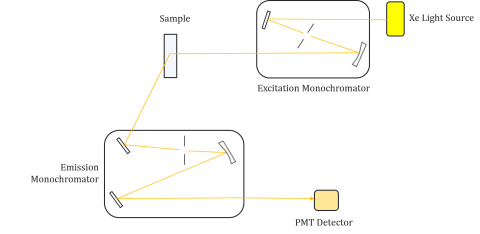
Fluorometrit koostuvat eksitaatiosta ja emissiokromaattorista, jonka avulla käyttäjät voivat saada sekä eksitaatiota että emissiospektrejä. Fluorometrin tekemä mittaus on yksilöllinen yksittäisen laitteen heräte-ja emissiomonokromaattoreille. Fluoresenssi liittyy suoraan valovirtaan ja mittaustehokkuuteen ja on siten riippuvainen laitteen rakenteesta ja komponenteista, kuten valonlähteestä, monokromaattioptiikasta ja fotomonistinputkesta. Jokaisella valonlähteellä on erilainen spektriteho (sekä muoto että teho), joka vaihtelee ja vähenee lähteen eliniän aikana.
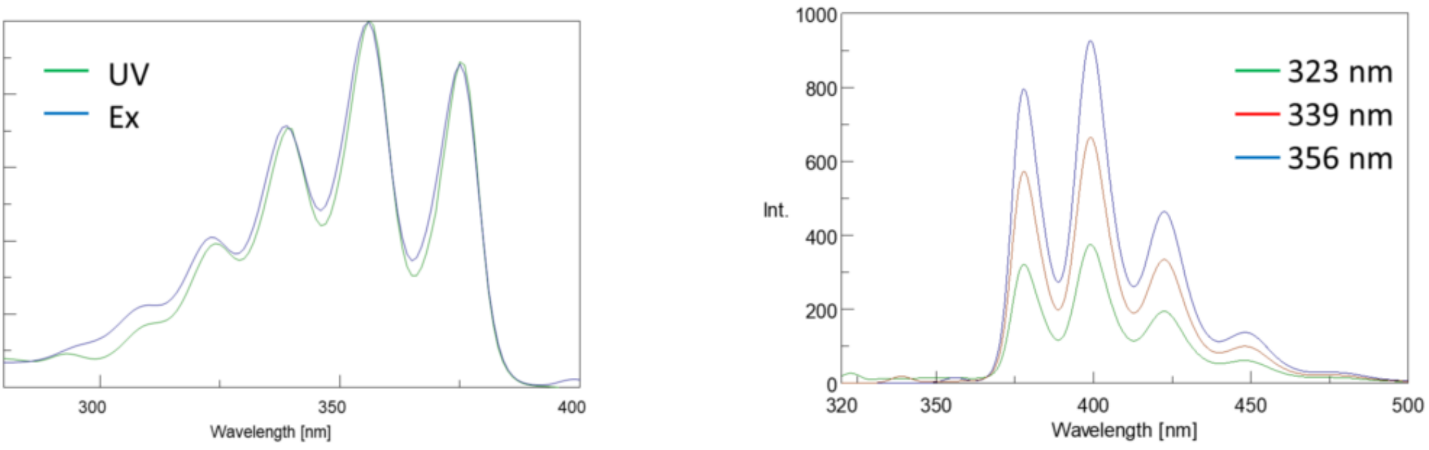
Magnetointispektrit kuvaavat intensiteettiä kiinteällä emissioaallonpituudella vaihtaen samalla magnetoinnin aallonpituuksia. Koska suurin osa emissiospektreistä on eksitaatioaallonpituudesta riippumattomia, eksitaatiospektreissä on usein päällekkäisyyksiä fluoroforin absorptiospektrin kanssa.
vastaavasti emissiospektri kuvaa intensiteettiä kiinteällä magnetointiaallonpituudella skannaten samalla emission vaihtelevaa aallonpituutta. Näiden päästökuvausten avulla saadaan tietoa fluorin molekyylirakenteesta ja sitä ympäröivästä paikallisesta ympäristöstä. Koska fluoresenssiemissiota tapahtuu aina alimmasta viritetystä tilasta maan tilaan, emissiospektrin muoto on riippumaton magnetoinnin aallonpituudesta. Tarvitaan myös enemmän energiaa, jotta molekyyli saadaan viritettyä maasta viritettyyn tilaan, jolloin emissiopiikit ovat pidemmillä aallonpituuksilla (eli pienemmillä energioilla) kuin vastaavat heräteaallonpituudet. Tämä magnetaation ja emission aallonpituuksien välinen energiaero tunnetaan Stokesin siirtona.
lisäksi absorptio-ja emissiospektrit ovat usein toistensa peilikuvia, koska jännitteen ja maanpinnan värähtelyenergiatasot jakautuvat tasan (kuva 3). Franck-Condon-periaate selittää, että koska ytimet ovat suhteellisen suuria ja emissioon ja absorptioon liittyvä elektroninen siirtyminen tapahtuu näin nopealla aikataululla, ytimien liikkumiselle ja värähtelyenergiatasoille ei ole aikaa ja siksi ne pysyvät suurin piirtein samoina koko elektronisiirtymän ajan.
spektrin kaistanleveys
koska fluoresenssin voimakkuus on verrannollinen tulovalon intensiteettiin, monokromaattorin läpi kulkevan valon määrä vaikuttaa voimakkuuteen suuresti. Heräte-ja päästökaistojen summan tulisi olla noin tarkkailtavan huipun spektrikaistanleveys (SBW), jotta kaikki huiput selviävät hyvin. Jos tätä nyrkkisääntöä noudatetaan, kaistanleveyksiä voidaan avata, jotta voidaan lisätä valon läpäisykykyä näytteille, joilla on alhainen fluoresenssi. SBW: hen voi vaikuttaa myös fluoroforin Stokesin siirtyminen. Kapeammat Stokes-siirrot voivat rajoittaa hyväksyttävien SBWs: iden valikoimaa, jota voidaan käyttää.
Fluoresenssiesineet
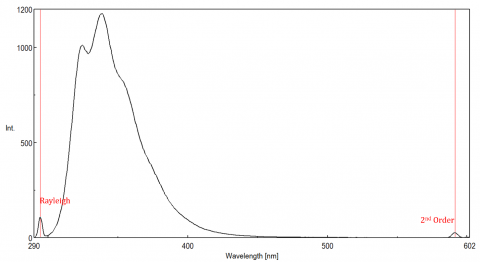
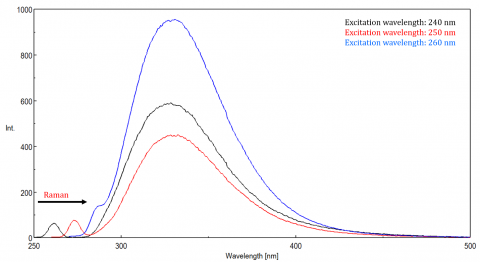
hajavalo voi synnyttää artefakteja, jotka vääristävät fluoresenssispektriä. Kolme yleisintä fluoresenssissa nähtävää sirontatyyppiä ovat Rayleigh, 2. kertaluku ja Raman-sironta (kuva 3). Rayleigh-sironta on siroteltua magnetointivaloa ja siten huiput magnetoinnin aallonpituudella. 2. kertaluvun sironta on korkeamman kertaluvun sironta, joka havaitaan kaksi kertaa magnetoinnin aallonpituudella. Raman sironta on inelastista sirontaa johtuen liuottimista ja huipuista kiinteällä energialla magnetoinnin aallonpituudelta. Jotta Raman-sironta voidaan erottaa fluoresenssihuipusta, magnetoinnin aallonpituutta voidaan vaihdella 5-10 nm: n välein, ja jos kyseinen huippu siirtyy magnetoinnin aallonpituuden mukana ja vähenee intensiteetiltään, niin tuo huippu johtuu Raman-sironnasta. Voit myös tarkistaa, onko piikki tyhjän liuottimen spektrissä. Jos on, on mahdollista, että se on Raman peak. Jos fluoresenssihuippu on liian lähellä tai päällekkäinen joko Raman-tai Rayleigh-sironnan kanssa, kaistanleveyksiä ja/tai magnetointiaallonpituutta voidaan säätää sironnan siirtämiseksi pois fluoresenssihuipusta. Nämä vaikutukset ovat näkyvimpiä hyvin alhaisilla fluoriforipitoisuuksilla ja erityisen voimakkaasti sirottavilla liuoksilla, kuten proteiineilla, mikrosfäärillä, nanohiukkasilla sekä kiinteillä aineilla.
dynaaminen alue
Automaattinen Vahvistuksenohjaustoiminto säätää automaattisesti ilmaisimen signaalin vahvistuksen fluoresenssin voimakkuuden perusteella. Tämä optimoi signaalin kohinaksi koko skannatun alueen spektri – tai ajankulkumittauksia varten siten, että eri voimakkuuksilla varustetut huiput säädetään automaattisesti S/N: n parantamiseksi ja tuloksen tarkkuuden varmistamiseksi.
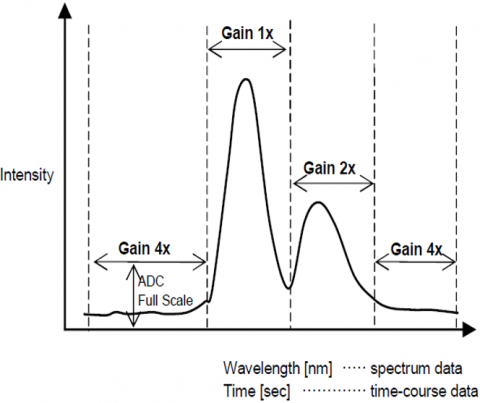
Automaattinen herkkyyden valvontajärjestelmä(SCS)
Automaattinen herkkyyden valvontajärjestelmä (SCS) laajentaa havaitun fluoresenssisignaalin dynaamista aluetta säätämällä automaattisesti ilmaisimen jännitettä fluoresenssin intensiteetin mukaan. Tämä mahdollistaa kiinteän aallonpituuden tai kvantitatiivisten analyysien mittaamisen subpikomolaarisista mikromolaarisiin pitoisuuksiin ilman, että laitetta muutetaan manuaalisesti.

kuva 5. Fluoreseiiniliuosten kalibrointikäyrä välillä 5·10-13-1,5·10-6 M käyttäen auto-SCS-toimintoa.
Fluoresenssispektroskopian
Anisotropian
fluoresenssin Anisotropiaa havaitaan, kun fluorofori säteilee valoa, jonka voimakkuus vaihtelee polarisaatioakselista riippuen, ja sitä kuvataan seuraavalla yhtälöllä
r=Ivv-GIvh/Ivv+2givh
missä on emission intensiteetti yhdensuuntainen herätetaso ja on emission intensiteetti kohtisuorassa herätetaso. G: tä kutsutaan G-tekijäksi tai instrumentin ritiläkertoimeksi ja se selittää emissiomonokromaattorin polarisaatioriippuvuuden.
kaikilla fluoriforeilla on siirtymämomentteja, jotka tapahtuvat tiettyihin suuntiin molekyyliakselin suuntaisesti. Kun altistetaan polarisoituneelle valolle, satunnaisesti suuntautuneet fluoriforit, joiden absorptiomomentit ovat suuntautuneet tapahtumavalon kulman ympäri, ovat innoissaan ja tämä jännittynyt tilapopulaatio on osittain suuntautunut. Kun molekyyli palaa viritetystä tilasta takaisin maatilaan, elektronin varaus jakautuu uudelleen ja dipolimomenttien orientaation muutos vaikuttaa eksitaatioon ja emissiopolarisaatioon. Esimerkiksi kun fluoresenssi emittoituu ennen kuin molekyyli pyörii, fluoresenssivalo polarisoituu voimakkaasti eksitaatiovalon polarisaatiosuuntaan. Jos valo säteilee molekyylin pyörimisen jälkeen täysin satunnaiseen suuntaan, fluoresenssi ei enää polarisoidu.
fluoresenssianisotropiaa mitattaessa seuraavat tekijät vaikuttavat molekyylin liikkeeseen: (1) molekyylikoko, (2) molekyylin ympäristön viskositeetti ja (3) sitoutuneen molekyylin lujuus ja vapausasteet. Anisotropiamittaukset määrittävät fluoriformin keskimääräisen kulmasiirtymän, joka tapahtuu fotonin absorption ja emission välillä. Kulmasiirtymä riippuu pyörimisnopeudesta ja-laajuudesta viritetyn tilan elinaikana. Kun fluorofori on rajoittamaton ja sen annetaan pyöriä vapaasti ennen fotonin uudelleen lähettämistä, diffuusionopeus on yleensä emissiota nopeampi ja anisotropia on suurin piirtein nolla. Rotaatiodiffuusio muuttuu siirtymämomentin suunnassa, joka depolarisoi emission. Mitä rajoitetumpi fluorofori on, sitä suurempi anisotropian arvo on, koska joustavuuden väheneminen vähentää kiertonopeutta.
FRET
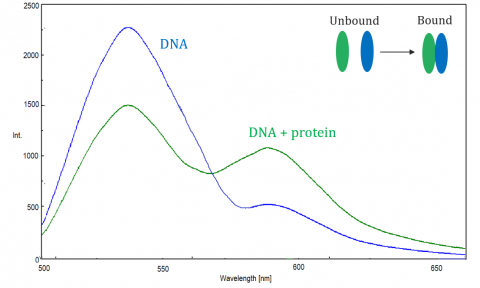
Fluoresenssiresonanssienergiansiirto (FRET) on mekanismi, joka säätelee energian siirtoa kahden viereisen molekyylin välillä. Luovuttaja, joka on aluksi virittyneessä tilassaan, voi siirtää energiaa vastaanottajamolekyylille ei-säteilevän elektroniresonanssin kautta.
otetta seurataan spektrofluorometrillä, joka mittaa acceptorin tai viritetyn luovuttajan fluoresenssia/sammutusta. Tuskailla tehokkuus riippuu seuraavista tekijöistä: luovuttajan ja vastaanottajan välinen etäisyys, luovuttajan ja vastaanottajan spektrinen päällekkäisyys ja niiden dipolimomenttien linjaus. Tehokkuus on kääntäen verrannollinen luovuttajan ja vastaanottajan välisen etäisyyden kuudenteen potenssiin, mikä tekee tekniikasta äärimmäisen herkän etäisyyden pienille muutoksille. Kun luovuttajan fluoresenssispektrin ja acceptorin absorptiospektrin päällekkäisalue on suurempi, tuskailla tehokkuus on suurempi. FRET-hyötysuhde on suurimmillaan myös silloin, kun kaksi dipolimomenttia ovat yhdensuuntaisia tai anti-yhdensuuntaisia keskenään, eikä energian siirtoa tapahdu, kun dipolimomentit ovat kohtisuorassa toisiinsa nähden. Tyypillisesti kun etäisyys luovuttajan ja hyväksyjä on betwen1 ja 10 nm, tuskailla tapahtuu.
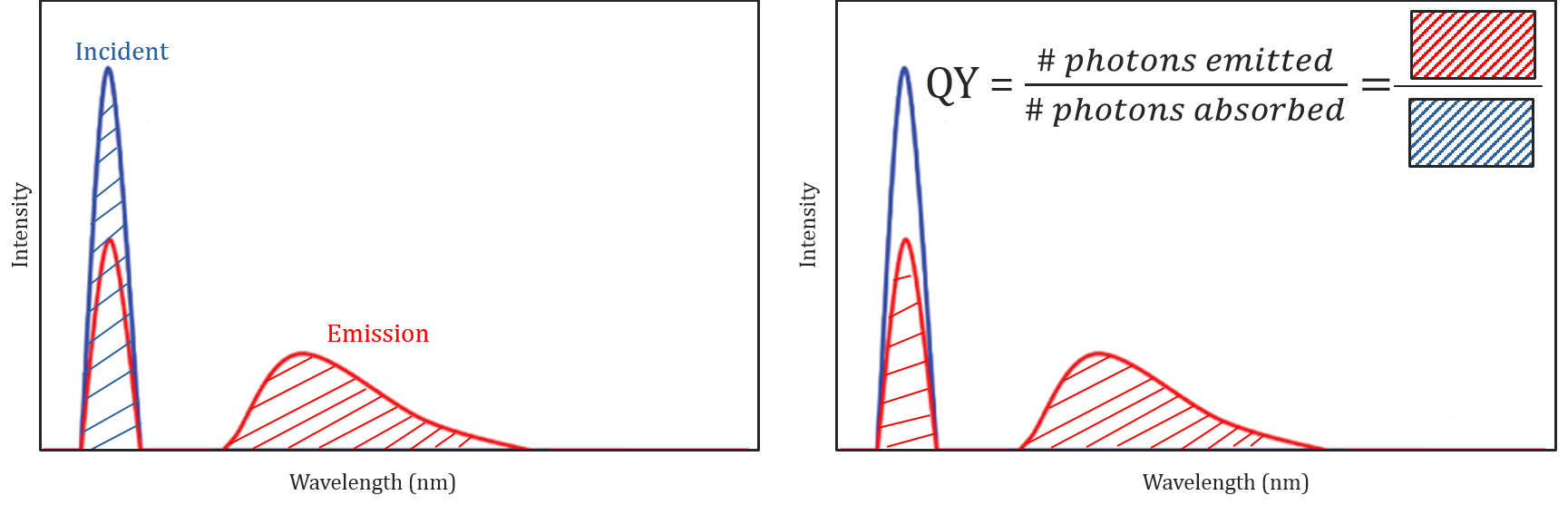
Kvanttisaanto ja Spektrikorjaus
erilaiset molekyyli-ja ympäristöolosuhteet eivät ainoastaan vaikuta siihen, fluoresoiko molekyyli vai ei, vaan ne voivat myös määrittää säteilevän fluoresenssisäteilyn intensiteetin tai kvanttisuoton. Molekyylin hyötysuhdetta fluoresenssiin kuvaa sen kvanttisaanto, ja se määritellään absorboituneiden fotonien määrän suhteena näytteen lähettämien fotonien määrään.
joissakin tapauksissa on tarpeen määrittää tarkka spektrimittaus. Tämä tehdään käyttämällä viittauksia tunnettuihin kalibroituihin materiaaleihin. Käytetyistä kalibroiduista lähteistä tarkistetaan absoluuttinen spektrilähtö tunnetussa instrumentissa ja toimitetaan referenssispektri asiakkaalle toimitetun yksittäisen laitteen korjaamiseksi. Jotta Spektrikorjaus toimisi tehokkaasti, se on tehtävä jokaisella mittausparametrilla ja kaistanleveysyhdistelmällä, joten Spektrikorjausta 5 nm: n spektrikaistanleveydellä ei voida soveltaa 10 nm: n SBW-mittaukseen. Tämä koskee polarisaattoreiden asentoa, jos niitä käytetään, sekä korkeamman kertaluvun suodattimien käyttöä. On tarpeen suorittaa Spektrikorjaus jokaiselle asiakkaan käyttämälle spektrilaajakaistojen yhdistelmälle, korkeamman kertaluvun suodattimen valinnan sisällyttämiseksi tai poissulkemiseksi sekä mahdollisten polarisaattoreiden asentojen osalta. Näytteen magnetointi ja emission aallonpituudet määrittävät, mitä liuosta/valonlähdettä käytetään kalibrointiin.
lähi-infrapuna
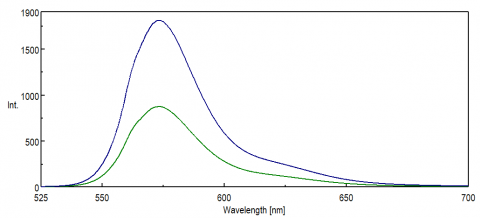
spektrin NIR-aluetta luotaavissa sovelluksissa PMT-detektorin spektrivaste on kriittinen tiedon saamiseksi. Näkyvän alueen punaisessa päässä, osaksi NIR, PMT: n kvanttihyötysuhde pienenee merkittävästi, mikä johtaa vain vähän tai ei lainkaan signaalin intensiteettiin näytemittausten aikana. FRET-kokeita ja NIR-väriaineita ja-koettimia seurataan usein yli 500 nm: n aallonpituuksilla, ja monissa tapauksissa niillä on pieniä signaaleja jopa niin herkälle tekniikalle kuin fluoresenssille. Kuvassa 8 havainnollistetaan rodamiini B: n fluoresenssin intensiteetin eroa käyttämällä standardia PMT verrattuna PMT: hen, joka on herkempi aallonpituuksille spektrin punaisessa päässä.
Täydentävä Tekniikka:
Circular Dikroism spectroscopy
Circular dikroism spectroscopy (CD) on oleellinen analyyttinen tekniikka, jota käytetään molekyylien siraalisuuden analysointiin niiden optisen aktiivisuuden kautta. CD: tä voidaan soveltaa monenlaisiin molekyylirakenteisiin, mutta se on saanut tiedeyhteisössä suosiota makromolekyylirakenteen, erityisesti proteiinien ja nukleiinihappojen, selvittämisessä.