a fehérjefeldolgozás mellett az ER és a Golgi gondoskodik a fehérje transzport bizonyos típusairól is. Vezikulák (membránhoz kötött buborékok, lényegében) csipet le az ER, Golgi, és más hártyás organellák, hordozó velük bármilyen oldható molekulák voltak benne a folyadék, amely zárt, valamint bármely molekula ágyazott, hogy a membrán része. Ezek a vezikulák ezután egy molekuláris motoron, például kinezinen vagy miozinon haladnak, és a citoszkeleton mentén haladnak, amíg a megfelelő rendeltetési helyre nem dokkolnak, és összeolvadnak a célmembránnal vagy organellával. Általában a vezikulák az ER-ből a cis Golgi-ba, a cis-ből a mediális Golgi-ba, a mediálisból a trans Golgi-ba, a trans Golgi-ból a plazmamembránba vagy más rekeszekbe mozognak. Bár a legtöbb mozgás ebben az irányban van, vannak olyan vezikulák is, amelyek a Golgi-ból az ER-be mozognak, olyan fehérjéket hordozva, amelyeknek az ER-ben kellett maradniuk (pl. PDI), és véletlenül egy vezikulumba kerültek.
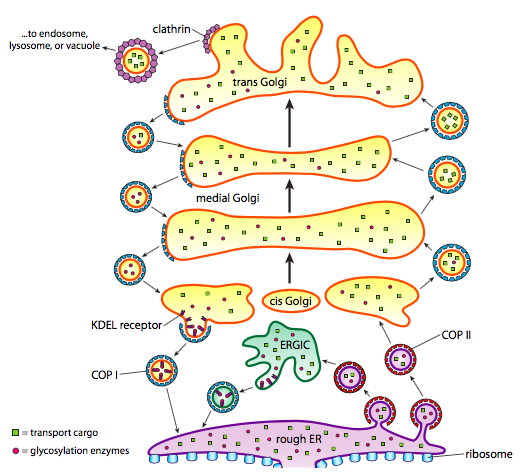
a vezikulák képződése a szőrzetfehérjéktől függ, amelyek megfelelő körülmények között gömb alakú ketrecekké alakulnak össze. Transzmembrán fehérjékkel társítva a csatolt membránt gömb alakúvá is húzhatják. A vezikulumképződésben használt kabátfehérjék fő típusai a COPII, a COPI és a clathrin.
a COPII rétegfehérjék alkotják az ER-ből a Golgi-ba mozgó vezikulákat. A COPI coat fehérjéket a Golgi-készülék részei között használják, valamint vezikulákat képeznek a Golgi-ból az ER-be. Végül a klathrint arra használják, hogy vezikulákat képezzenek, amelyek elhagyják a Golgi-t a plazmamembránhoz, valamint a plazmamembránból képződött vezikulákhoz az endocitózishoz.
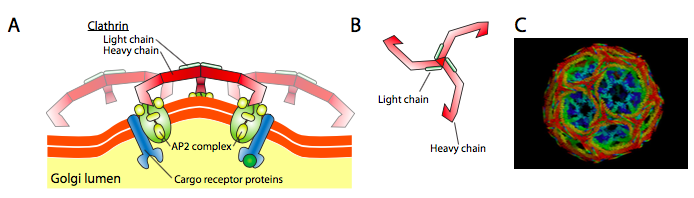
a Clathrin (\(\PageIndex{17}\) ábra) a legjobban leírható a három közül, a hólyagos kabátok pedig a clathrin triskelionok elrendezéséből készülnek (görögül, háromlábú). Minden triskelion három nehéz láncból áll, amelyek a C-terminálon vannak összekötve, és három könnyű láncból, amelyek mindegyik nehéz lánchoz kapcsolódnak. A különböző triskelionok nehéz láncai kölcsönhatásba lépnek nehéz lánc “lábaik” hosszában, hogy nagyon erős konstrukciót hozzanak létre. A könnyű láncok feleslegesek a vezikulumképződéshez, és úgy gondolják, hogy segítenek megelőzni a citoplazmában lévő klathrin molekulák véletlen kölcsönhatásait.
jelentős hasonlóság van a vezikulumképző mechanizmusok között, amelyek ezeket a különböző rétegfehérjéket használják, kezdve az ARF1 toborzásával (az ARF az ADP riboszilációs faktort jelenti, amelynek itt semmi köze a funkciójához) a membránhoz. Ehhez szükség van a GTP ARNO-megkönnyített cseréjére a GDP-re (az ARNO ARF nukleotidkötő hely nyitó). Miután az ARF1 megkötötte a GTP-t, a konformációs változás egy N-terminális mirisztoil csoportot tár fel, amely beilleszkedik a membránba. Mind a COPI, mind a clathrin bevonatú vezikulák ARF1-et és ARNO-t használnak, de a COPII hasonló fehérjéket használ, az úgynevezett Sar1p és Sec12p.
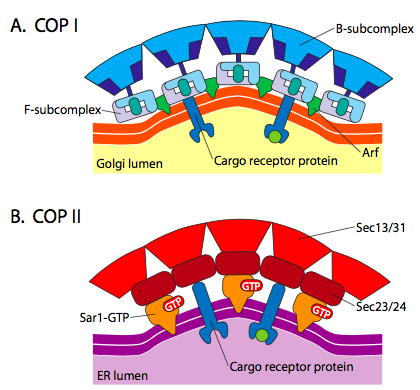
ábra \(\PageIndex{18}\). COP-bevonatú vezikulák
az ARF1 (vagy Sar1p) olyan adapterfehérjék toborzására szolgál, amelyek kötődnek a membránhoz kötött receptorfehérjék “farok” végéhez. Ezeknek a receptoroknak az üzleti vége kötődik a car-go molekulákhoz, amelyeket be kell csomagolni a vezikulába. Az adapter fehérjék a membrán (a receptorokon keresztül) és a kabátfehérjék közötti kapcsolatként működnek. A klathrin esetében az adapterfehérjék AP1 a transz-Golgi-eredetű vezikulák esetében, AP2 pedig az endocita vezikulák esetében. A COPI hólyagok, a hozzávetőleges homológok a β-, γ-, δ-, s gyöke – a Rendőrök, miközben a COPII rendszert használ Sec23p, valamint Sec24p.
Végül a adapterek linket a tényleges kabát fehérjék: clathrin, α – vagy ε – ZSARU, Sec13p, valamint Sec31p. Mik ezek a fehérjék mind a közös, hogy spontán (azaz az energiafelhasználás követelménye nélkül) ketrecszerű gömb alakú szerkezetekké válnak. Az elektronmikroszkóp alatt a clathrin-bevonatú vezikulák élesebben vannak meghatározva, és a clathrin alegységek által határolt hatszögletű és ötszögletű formák “futball-labda” megjelenést kölcsönöznek a vezikulának. A COP coatamer bevonatú vezikulák sokkal homályosabbak az EM alatt.
mindhárom típusú vezikulumbevonat fehérje képes spontán módon kapcsolódni egy gömb alakú konstrukcióhoz, de csak a COPI és a COPII bevonatú vezikulum is spontán “csípi le” a membránt, hogy felszabadítsa a vezikulát a kiindulási membránból. A klathrinnel bevont vezikulákhoz külső mechanizmusra van szükség a vezikulum felszabadításához (\(\pageindex{19}\) ábra).
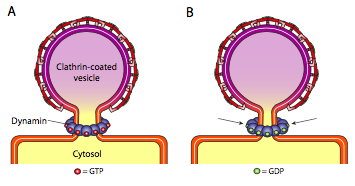
miután a vezikulum majdnem elkészült, még mindig van egy kis membránszár vagy nyak, amely összeköti a vezikulumot a membránnal. E szár körül a dinamikus GTP-molekulák gyűrű/spirál szerkezetben aggregálódnak. A dinaminmolekulák globuláris Gtpázok, amelyek a GTP hidrolízisével összehúzódnak. Amikor a vezikulum szára körül társulnak, minden dinaminfehérje összehúzódik, azzal a kombinált hatással, hogy a szárat annyira összehúzza, hogy a membrán összeilleszkedjen, lezárva és felszabadítva a vezikulát a kiindulási membránról.
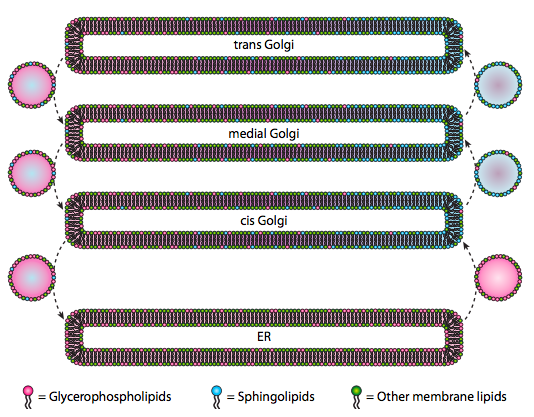
bár a lipideket és a membránokat a 4. fejezetben tárgyaltuk, elhanyagoltuk, hogy megvitassuk szintézisük helyét az eukariótákban. Amint azt a \(\PageIndex{20}\) ábra jelzi, bizonyos típusú lipidek szintézise szegregált és kizárólagos. A glicerofoszfolipidek elsősorban az endoplazmatikus retikulumban képződnek, bár mitokondriumokban és peroxiszómákban is előfordulnak. Ezzel szemben a szfingolipidek nem termelődnek az ER-ben (bár ceramid prekurzoraik vannak) emlősökben, a szükséges enzimek a cisz lumenében és a mediális Golgi-ban találhatók. Bizonyíték van anterográd és retrográd hólyagos forgalomra a különböző Golgi és ER rekeszek között, ami elméletileg a lipid típusok újraelosztására utalna. Azonban a szfingolipidek hajlamosak lipid tutajokká aggregálódni, és úgy tűnik, hogy jobban koncentrálódnak az anterográd mozgó vezikulákban.
a kabátfehérjék röviddel a vezikuláris felszabadulás után jönnek le. A klathrin esetében a folyamat magában foglalja a Hsc70-et, egy Atpázt. A COPI vagy COPII bevonatú vezikulák esetében azonban úgy tűnik, hogy a GTP ARF/Sar1p-n történő hidrolízise gyengíti a rétegfehérje affinitását az adapterek iránt, és bevonatot indít el. A GTPase aktivátor ARF GAP (vagy Sec23p), és a COP I (vagy II) bevonat szerves része.
a vezikulák kétféle rakományt hordoznak: oldható fehérjéket és transzmembrán fehérjéket. Az oldható fehérjék közül néhányat a vezikulában vesznek fel, mivel receptorhoz kötődnek. Más fehérjék csak a közelben vannak, és a vezikulum kialakulásakor fel vannak ragadva. Időnként olyan fehérjét vesznek fel, amelynek nem kellett volna lennie; például a PDI bezárható az ER-ből kialakuló vezikulumba. Kevés funkciója van a Golgi-ban, és szükség van rá az ER-ben, akkor mi történik vele? Szerencsére a PDI-nek és sok más er-proteinnek van egy C-terminális jelszekvenciája, a KDEL (lizin-aszparaginsav-glutaminsav-leucin), amely azt kiáltja: “az ER-be tartozom.”Ezt a szekvenciát a Golgi belsejében lévő KDEL-receptorok felismerik, és a KDEL-fehérjék receptorokhoz való kötődése vezikulumképződést vált ki, hogy visszaküldje őket az ER-be.
a szekréciós vezikulák különleges problémát okoznak az oldható rakományban. Ha a vezikulum egyszerűen a benne lévő fehérjékre támaszkodna a képződési folyamat során, nehéz lenne magas koncentrációt elérni ezekből a fehérjékből. Sok szekretált fehérjére van szüksége a szervezetnek gyorsan és jelentős mennyiségben, ezért a transz-Golgi-ban van egy mechanizmus a szekréciós fehérjék aggregálására. A mechanizmus olyan aggregáló fehérjéket használ, mint a secretogranin II és a chromogranin B, amelyek a célfehérjéket nagy koncentrált granulátumokban egyesítik. Ezek a graninok az alacsony pH és a magas Ca2 + transz-Golgi környezetben működnek a legjobban, így amikor a vezikulum a sejten kívül felszabadítja a tartalmát, a magasabb pH és az alacsonyabb Ca2+ lebontja az aggregátumokat, hogy felszabadítsa az egyes fehérjéket.
a Golgi érése során következetes pH-változás következik be, így az ER-től a Golgi-ig haladva minden rekesz fokozatosan alacsonyabb (savasabb) lumenal pH-val rendelkezik.
végül felmerül a vezikulák célzásának kérdése. A vezikulák sokkal kevésbé hasznosak, ha egy molekuláris tehervonaton dobják őket, és véletlenszerűen dobják le őket. Ezért van egy dokkoló mechanizmus, amely megköveteli a v-pergő fehérje illesztését a vezikulum citoplazmatikus felületén, a T-pergő pedig a célmembrán citoplazmatikus felületén. A vezikulum fúziója a membránhoz csak akkor folytatódik, ha van egyezés. Ellenkező esetben a vezikulum nem tud összeolvadni, és egy másik molekuláris motorhoz kapcsolódik, hogy egy másik, remélhetőleg helyes cél felé haladjon. Ezt a folyamatot segítik a fehérjék megkötése, amelyek kezdetben kapcsolatba lépnek a bejövő vezikulummal, és elég közel húzzák a célhoz, hogy teszteljék a pergő fehérje kölcsönhatását. A vezikulum és a célmembránok más fehérjéi kölcsönhatásba lépnek, és ha a csapdák megegyeznek, segíthetnek a vezikulum “csörlésében” a célmembránba, majd a membránok összeolvadnak. Fontos ökölszabály a hólyagos fúzió megértéséhez, valamint a membránfehérjék és lipidek irányának megértéséhez, hogy a membrán citoplazmatikus oldala mindig a citoplazma felé néz. Ezért egy olyan fehérjét, amely végül megtalálható a sejtmembrán külső felületén, kezdetben behelyezzük az ER membrán lumenális felületébe.
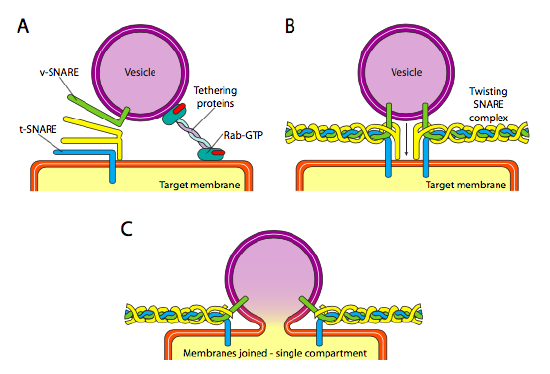
pontosabban, amikor egy vezikulum megközelíti a célmembránt, a rab-GTP megkötő fehérje, amely kettős geranilgeranil lipid farokon keresztül kapcsolódik a célmembránhoz, lazán kapcsolódik a vezikulához, és a célmembrán közelében tartja, hogy a csapdák működjenek. A v-SNAREs és a t-SNAREs most lehetősége van arra, hogy kölcsönhatásba lépjenek és teszteljék a mérkőzést. A közelmúltban a csapdákat r-SNAREs és Q-SNAREs névre keresztelték, konzervált arginin és glutamin maradványok alapján. Ezen a két elsődleges csapdán kívül legalább egy másik csapda is részt vesz, amelyek együttesen egy négyből álló köteget alkotnak (négy, nem három, mert legalább a legjobban tanulmányozott példában az egyik csapda úgy van meghajlítva, hogy két alfa-spirális doménje részt vesz az interakcióban. A négy spirál körbeveszi egymást, és úgy gondolják, hogy miközben ezt teszik, összehúzzák a vezikulumot és a célmembránt.
a tetanusz toxin, a tetanospasmin, amelyet a Clostridium tetani baktériumok szabadítanak fel, görcsöket okoz az idegsejtekre hatva, és megakadályozza a neurotranszmitter felszabadulását. Ennek mechanizmusa az, hogy hasítja a szinaptobrevint, egy pergő fehérjét, így a szinaptikus vezikulák nem tudnak összeolvadni a sejtmembránnal. A Clostridium botulinum botulinumból származó Botulinum toxin a csapdákra is hat, hogy megakadályozza a vezikulum fúzióját és a neurotranszmitter felszabadulását, bár különböző neuronokat céloz meg, így ellentétes hatása van: a tetanuszt a gátló neurotranszmitterek felszabadulásának megakadályozása okozza, míg a botulizmust az izgató neurotranszmitterek felszabadulásának megakadályozása okozza.