Bevezetés
a myocardialis necrosis markerek megfelelő értelmezése elengedhetetlen az akut koronária szindrómával (ACS) gyanúsított betegek diagnosztizálásához, rétegződéséhez és kezeléséhez. Az akut miokardiális infarktus (AMI) szívmarkereire vonatkozó protokollokat az AMI harmadik univerzális meghatározására utalják.
ez a dokumentum megállapítja, hogy a szív troponin (cTn) emelkedése és csökkentése alapvető fontosságú a diagnózis megállapításához ischaemiás tünetek, elektrokardiográfiás változások vagy újonnan megnyilvánuló szegmentális változások összefüggésében egy képalkotó vizsgálatban.1
a cTn meghatározásának technológiai fejlődése javította a myocardialis sejtkárosodás kimutatásának és számszerűsítésének képességét. A cTn-értékek emelkedésére vonatkozó kritériumok az alkalmazott vizsgálattól függenek, és azokat az egyes vizsgálatok pontossági profilja alapján kell meghatározni, beleértve a nagy érzékenységű vizsgálatokét is.2 a különböző kereskedelmi ctn immunvizsgálatok megléte különböző percentilis 99 (p99) koncentrációkkal; az a tény, hogy egyes laboratóriumok eltérő hivatkozásokat használnak a szívizom károsodásának vizsgálati eredményeire (“normál”, “határozatlan” vagy “szuggesztív”); és a cTn-vizsgálatok válogatás nélküli alkalmazása nagy populációkban, amelyek nagyon eltérő valószínűséggel mutatják be az ACS-t, általában zavart okoznak a klinikai kezelés összefüggésében.
jelentős számú olyan beteg van, akik AMI hiányában ennek ellenére ctn-koncentrációt mutatnak> p99. Ezeknek a betegeknek általában kardiovaszkuláris kockázati tényezői vannak, és az ilyen egyéneknél a szövődmények valószínűsége hasonló az ACS-ben szenvedő betegekéhez.3
a nem st-emelkedésű akut koronária szindrómában (NSTE-ACS) szenvedő betegek kezelésére vonatkozó legújabb európai ajánlások a nagy érzékenységű cTn (hs-cTn) alkalmazását támogatják a hagyományos vagy negyedik generációs (4G) troponinokkal szemben, és legfeljebb két algoritmust fontolgatnak (0H/3h, 0h/1h) az ami megerősítésére (szabály) vagy kizárására (kizárására).4
a szív troponinjai rendkívül specifikusak a szívizom károsodására. A szívizom károsodása azonban semmiképpen sem zárja ki az ACS-t. Következésképpen a klinikai útmutatók hangsúlyozzák, hogy a cTn-koncentrációt a beteg tüneteivel összefüggésben kell értelmezni. Ebben a tekintetben emelkedett cTn-koncentráció szepszisben, hipertóniás krízisekben, tüdőembóliában stb., jelzik a szívizom károsodását, de nem az AMI-t, és nem szabad használni az ACS specifikus kezelésének jelzésére.5
a “nagy érzékenység” kifejezést azokra az immunvizsgálatokra kell fenntartani, amelyek képesek meghatározni a p99-et 6
variációs együtthatóval (CV) a tudományos közösségben kétségek merülnek fel azzal kapcsolatban, hogy a hs-cTn alkalmazása jelentős klinikai javulást jelent-e, és hogy további vizsgálatokat és konzultációkat jelent-e.7 a jelen vizsgálatot a nagy érzékenységű troponin T (hs-TnT) diagnosztikai teljesítményének értékelésére, annak meghatározására, hogy lerövidíti-e a diagnózisig eltelt időt, valamint alkalmazásának klinikai következményeinek elemzésére végezték.
módszer
prospektív, longitudinális megfigyelési vizsgálatot végeztek a CL (Valencia), a Cl (m), a Severo Ochoa (Legan), a Sant Pau (Barcelona) és a Miguel Servet (Zaragoza) (Spanyolország) kórház sürgősségi szolgálataiban(HES), a TUSCA (Troponina Ultrasensible en el SCA) vizsgálat8 betegeinek bevonásával 2009 júniusa és 2010 áprilisa között. A tanulmányt a Helsinki Nyilatkozat elveivel összhangban végezték, és a részt vevő központok helyi etikai bizottságai jóváhagyták. Minden betegtől írásbeli tájékozott beleegyezést kaptak. Folyamatosan bevontuk a HES-ben látott 18 évesnél idősebb betegeket az NSTE-ACS-re utaló mellkasi fájdalom miatt. A betegek beiratkozása a HES kezdeti ellátása során történt, a felvételi és kizárási kritériumok értékelése után. A betegkezelés és az alkalmazott kezelés az Európai Kardiológiai Társaság konszenzusos útmutatóin alapuló belső protokollokat követte, a betegekért felelős orvosok indikációi alapján, a vizsgálatban való részvétel teljes függetlenségével. Soros 4G cTn meghatározásokat végeztek az ACS diagnosztizálására, a rutin klinikai és immunoassay gyakorlatnak megfelelően minden központban.
a beteg jellemzőit esettanulmány formájában adták meg, és tartalmazták a demográfiai adatokat, a tünetek megjelenéséig eltelt időt, a kockázati tényezők jelenlétét (artériás hipertónia, diabetes mellitus , krónikus obstruktív tüdőbetegség, szívelégtelenség és veseelégtelenség). Rögzítettük az EKG jellemzőit fájdalommal és anélkül, valamint a kezdeti sürgősségi ellátás után a menedzsmentre vonatkozó információkat (katéterezés, angioplasztika, bypass műtét stb.), a végső diagnózis és a beteg rendeltetési helye.
az ST-szegmens magasságú ACS-ben szenvedő betegeket kizárták, csakúgy, mint az újonnan megnyilvánuló bal kötegblokk, defibrilláció vagy kardioverzió az első laboratóriumi meghatározások előtt, szívműtét a felvétel előtti három hétben, terhes nők, súlyos kognitív károsodásban szenvedő betegek és krónikus veseelégtelenségben szenvedő betegek hemodialízisnek vetették alá.
a HES-ben, az intenzív osztályon (ICU) vagy a kórházi osztályon való tartózkodás első 12 órája alatt soros vérmintákat kaptunk a HS-TnT mérésére, a következő protokoll alapján:
- –
Minta T0. Az első segítségnyújtás idején a HES-ben.
- –
Minta T1. Két órával a mintavételi időpont után 0 vagy közvetlenül a felvétel előtt néhány kórházi egység (ICU vagy kórterem).
- –
Minta T2. 4-6 óra között a mintavételi időpont után 0 vagy közvetlenül a kórházi egységbe való felvétel előtt.
- –
Minta T3. 8 és 12 óra között a mintavételi időpont után 0, ha a beteg még mindig szolgálatban volt, vagy közvetlenül a kórházi egységbe való felvétel előtt, vagy a beteg HES-ből történő elbocsátásakor.
elegendő vért gyűjtöttünk ahhoz, hogy 5 alikvot 0,5 ml heparinizált plazmát kapjunk a beteg minden mintájából, a rutin vizsgálathoz szükséges minta mellett. Az aliquotokat -80cc-nél fagyasztottuk, és az egyes központok kódjával azonosítottuk: három számjegy, amely megfelel a beteg számának és a gyűjtési időpontnak (T0, T1, T2 vagy T3), az érintett minta szerint. Betegenként átlagosan 3,7 mintát kaptunk. Az összes mintát átvitték a központi laboratóriumba (Hospital Sant Pau, Barcelona) a 4G cTn és a hs-TnT elemzésére, és minden egyes gyűjtésből legfeljebb egy hónap telt el. A kórházak mind elvégezték az akkor alkalmazott rutin 4G cTn tesztet (2 központ cTnT-vel és 3 cTnI-vel). A végső betegdiagnózist egy szakértő állapította meg, az egyes központokban a vezető nyomozó által kitöltött esetjelentési űrlap által szolgáltatott összes klinikai információ alapján, tükrözve a klinikai és EKG adatokat, valamint a központi laboratóriumban végzett centralizált 4G cTn meghatározást. A szakértőt elvakította a hs-cTn meghatározása.
az infarktust a ctnt-koncentráció > 20% – os emelkedésének vagy csökkenésének jelenlétében diagnosztizálták több minta között, legalább egy érték nagyobb volt, mint a P99 a referencia populáció esetében (0,01 ~ g/l). Az instabil angina (UA) diagnózisát olyan betegeknél állapították meg, akiknél a miokardiális ischaemia klinikai bizonyítéka volt pozitív 4G cTn nélkül. Az UA-ban szenvedő betegek kórtörténetében nyugalmi angina, a korábbi krónikus angina súlyosbodása, az ST-szegmens ischaemiára utaló változások biomarker variációk nélkül (kinetika), pozitív ischaemia detektálási tesztek vagy szűkület a koszorúér>70% – A, amint azt a koszorúér angiográfia bizonyítja. A cTnT-szinteket viszont nagy érzékenységű technikával mértük egy Cobas e601 analizátoron (hs-TnT, Roche Diagnostics, Bázel, Svájc). A technika kimutatási határa 5,0 ng/l, és a referencia p99, amelyet klinikai döntési határként használtak, 13,0 ng/l volt. ezeknek a cTn-teszteknek az analitikai pontatlanságát 20 ismétlésben értékelték 8 mintacsoportból, a végkoncentrációkat úgy igazítva, hogy lefedjék a 7 és 928 ng/l közötti tartományt, magas cTnT-koncentrációjú mintát hígítva olyan szérumkészlettel, amely nem mutat kimutatható hs-TnT szinteket (
ng/l). A cTnT-teszt p99-ét (10ng/l=0,01 Ft/l) 15,2% – os variációs együtthatóval (CV) mértük. A CV 10% – os értéke 35ng / l=0,035 Ft/l volt. A hs-TnT teszt p99-ét (13 ng/l) 6,9% – os CV-vel mértük.
A kvalitatív változók leíró elemzéséhez a gyakoriságokat és a százalékokat számítottuk ki, a kvantitatív változók esetében központi tendenciamérésekkel. Az adatokat normál eloszlás esetén az átlag és a szórás (SD), nem normál eloszlás esetén pedig a medián és az interkvartilis tartomány (IQR) formájában fejeztük ki, amint azt a Kolmogorov-Smirnov teszt is bizonyítja.
a kvantitatív változók összehasonlítása a Student t-tesztjén vagy a Mann–Whitney U-teszten alapult normál adateloszlás jelenlétében vagy hiányában. A kvalitatív változók összehasonlítása viszont a chi-négyzet teszten vagy a Fisher-pontos teszten alapult, adott esetben.
a statisztikai szignifikancia szintjét minden esetben 5%-ban határozták meg (6,05%) a Kétfarkú vizsgálat során.
a 4G cTn és hs-TnT diszkriminációs vizsgálatot a vevő működési jellemző (ROC) görbéje alatti terület (AUC) kiszámításával végezték a különböző mintavételi időpontokban, a megfelelő 95% – os konfidencia intervallummal (CI). Ezeknek a görbéknek a jelentőségét az AUC CI-jének kiszámításával értékelték, szignifikánsnak meghatározva azokat az értékeket a 0,5% feletti alsó határral rendelkező területen. A ROC görbe alatti területek összehasonlítását a CI értékek átfedésének tanulmányozásával végeztük.
a diagnosztikai teljesítményt az érzékenység, a specificitás, valamint a pozitív és negatív prediktív értékek kiszámításával értékelték. A 95% – os konfidencia intervallumot ezen intézkedések nagyságának klinikai értékeléséhez számították ki – az intervallumot szignifikánsnak tekintették az értékek átfedésének hiányában.
eredmények
a vizsgálatban összesen 351 beteg vett részt; 234 férfi volt (67,9%), az átlagéletkor 65,7 év volt. A főbb demográfiai adatokat és a kardiovaszkuláris kockázati tényezőket az 1. táblázat foglalja össze. Az AMI végleges diagnózisát 77 betegnél, az UA-t 102 betegnél állapították meg. Összesen 172 beteget diagnosztizáltak ACS nélkül.
a vizsgálati minta jellemzői és kardiovaszkuláris kockázati tényezői.
| változók | összesen | nincs ACS | instabil angina | AMI | p |
|---|---|---|---|---|---|
| nem. betegek n (%) | 351 | 172 (49) | 102 (29.1) | 77 (21.9) | – |
| életkor (medián) | 66 (27-93) | 64.4 (27-93) | 71 (31-90) | 73 (36-88) | |
| férfiak, % | 67.9 | 61.5 | 73.5 | 74 | |
| betegség története n (%) | |||||
| AHT | 220 (62) | 101 (58.7) | 73 (71.6) | 46 (59.6) | NS |
| cukorbetegség | 92 (26.2) | 38 (22.1) | 35 (34.3) | 19 (24.7) | NS |
| szívelégtelenség | 52 (14.8) | 20 (11.6) | 20 (19.6) | 12 (15.6) | NS |
| glomeruláris szűrési sebesség (ml / perc/1, 73m2) | 79.6 | 81.9 | 80.7 | 72.9 | |
| TNT / l (medián) | 0.285 (0.01–6.87) | 0.009 (0.001–0.46) | 0.009 (0.009–0.03) | 0.066 (0.009–6.870) | |
| HR-TnT ng / l (medián) | 63.87 (2.99–7.096) | 5.5 (1.2–481.6) | 11.69 (1.99–66) | 90.4 (2.9–7.096) | |
| NT-proBNP pg / ml (medián) | 1.130 (5.46255) | 141 (5-13.302) | 238.5 (16.4–9.164) | 589 (41-46.255) | |
| elektrokardiogram fájdalom (70.67%) | |||||
| normál | 103 (41.1) | 70 (61.4) | 22 (27.5) | 11 (20) | |
| t neg | 57 (23) | 21 (18.6) | 23 (28.8) | 13 (23.6) | |
| ↓ Szent | 60 (24.5) | 9 (8) | 26 (32.6) | 25 (45.4) | |
| a tünetek alakulása (min) (88%) | |||||
| ≤3 óra (%) | 46 | 63 (42) | 43 (44.8) | 41 (55.4) | 0.16 |
| >3h (%) | 57 | 87 (58) | 53 (55) | 33 (44.6) | NS |
| Catheterization | 36.9 | 12 (7) | 64 (62.7) | 53 (68.8) | |
| Angioplasty | 20.9 | 2 (1.2) | 29 (28.4) | 41 (53.2) | |
| Stent | 18.7 | 1 (0.6) | 28 (27.5) | 35 (45.5) | |
| Bypass | 2.2 | 0 | 4 (3.9) | 4 (5.2) | |
| sürgősségi szolgálat mentesítése | 41.1 | 128 (74.7) | 10 (10.9) | 5 (6.6) | |
| kórházi mentesítés | 57.8 | 44 (25.3) | 92 (88.1) | 72 (91) | |
| halál | 1.1 | 0 | 1 (1.9) | 3 (3.8) | |
AHT: artériás hipertónia; AMI: akut miokardiális infarktus; NS: nem jelentős; NT-proBNP: agyi natriuretikus peptid; ACS: akut koszorúér-szindróma; TnT: troponin T; hs-TnT: nagy érzékenységű troponin T.
az AMI-ben szenvedő betegek összesen 55,4% – a érte el a HES-t az első három órán belül, míg mind az UA-val, mind az ACS-vel nem rendelkezők nagyobb százaléka három óra múlva érkezett. Ami a markerek pozitivitását illeti a végső diagnózis szerint az AMI végső diagnózisával rendelkező betegek 87% – a 4G cTn-t mutatott>0,035 6G/l a vizsgálat első 12 órája alatt. A nem ACS betegek és az UA-ban szenvedők esetében a pozitivitást az esetek 4% – ában regisztrálták. A hs-TnT koncentráció >13 ng/l (p99) volt a nem ACS-vel diagnosztizált betegek 26, 7% – ánál, illetve 46% – ánál (ábra. 1). Másrészt, 4G cTn segítségével p99 egy cut-off pont 0.01 (a vizsgálat aranystandardja) az UA-val diagnosztizált betegek 16% – ánál, az ACS-vel nem rendelkező betegek 11% – ánál bizonyult pozitívnak.
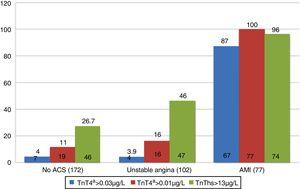
Marker pozitivitás a végső diagnózis szerint. Ami: akut miokardiális infarktus; ACS: akut koszorúér-szindróma; TnT: troponin T; hs-TnT: nagy érzékenységű troponin T.
a kinetika alkalmazásakor a négy meghatározás közül néhányban (6 kritérium), az UA-ban szenvedő betegek 21,5%-a mutatott HS-TnT emelkedést+Kb (ábra. 2).

pozitivitás + a markerek száma a végső diagnózis szerint. Ami: akut miokardiális infarktus; ACS: akut koszorúér-szindróma; TnT: troponin T; hs-TnT: nagy érzékenységű troponin T.
az első mérésnél (T0) a hs-TnT diagnosztikai érzékenysége szignifikánsan nagyobb volt, mint a 4G cTn (CV) (87,0%; 83,0–90,3% vs.42,9%; 37,6–48,2%; p
0,05), ami 95,1% negatív prediktív értéket eredményezett. Azonban a specificitás (71,5%; 66,5–76,2% vs.97,4%; 95,2–98,8%; p0.05) és a pozitív prediktív érték (46,2% vs.82,5; p0. 05) egyértelműen alacsonyabb volt, mint a 4G cTn (CV). A ROC görbe alatti terület elemzésekor a hs–TnT jobbnak bizonyult a 4G cTn–nél (CV) (0,792; 0,746-0,833 vs.0,701; 0,650-0,748) (ábra. 3 és 4).
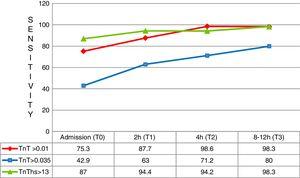
érzékenység a különböző vizsgálati időpontokban. TnT: troponin T; hs-TnT: nagy érzékenységű troponin T.
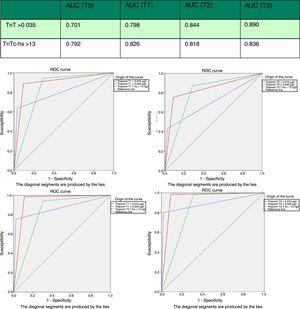
a hs-TnT és a TnT 4G görbéje (AUC) alatti terület a mintavételi és vevőegység működési jellemző (ROC) görbéiben. AUC: görbe alatti terület; TnT: troponin T; hs-TnT: nagy érzékenységű troponin T.
két órával a beteg érkezése után a HES-be (T1) a hs-TnT továbbra is sokkal magasabb diagnosztikai érzékenységet mutatott, mint a 4G cTn (94,4%; 91,3–96,6 vs.63,0%; 57,6–68,2; p0.05). A HS-TnT negatív prediktív értéke gyakorlatilag abszolút volt (97,9%), diagnosztikai pontossága általában jobb volt, mint a 4G cTn (ROC 0,826 vs.0,798). A hs-TnT alacsony specifitása alacsony pozitív prediktív értéket eredményezett (46,5%). A többi mintavételi eredmény hasonlónak bizonyult, bár kisebb diagnosztikai teljesítményt tükröz.
a tünetek megjelenését követő első három órában összesen 41 beteg érkezett az AMI végleges diagnózisával. Ezekben az esetekben a hs-TnT kiváló diagnosztikai érzékenysége a 4G cTn (CV), valamint a 4G cTn (p99) tekintetében különösen jelentős volt, 87,8% – os érzékenységgel szemben, szemben a 36,6% – kal, illetve a 73,2% – kal (ábra. 5).
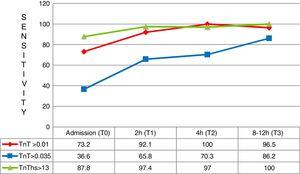
érzékenység a különböző vizsgálati időpontokban a tünetek megjelenése min. TnT: troponin T; hs-TnT: nagy érzékenységű troponin T.
azoknál a betegeknél, akiknél nem ST elevációval járó myocardialis infarctust (n=36) diagnosztizáltak, és akiknek hosszú evolúciós ideje volt (> 3 óra), kisebb volt a diagnosztikai pontosság a hs-TnT-vel (az alacsonyabb specificitás miatt), mint azoknál a betegeknél, akiknél a tünetek megjelenése után rövidebb volt az idő. A kinetika alkalmazásakor ismét megfigyelhető volt a specificitás növekedése, az AUC növekedésével. Ennek megfelelően a hs-TnT esetében 69% – os specificitással kezdtünk, míg a 65% – os specificitás, az 55,3% – os pozitív prediktív érték mellett elérte a 85% – ot, ami javította az általános diagnosztikai teljesítményt (2.táblázat).
a különböző cardialis troponinok kinetikája ( ~ ) azoknál a betegeknél, akiknél a tünetek >180 perc alatt jelentkeznek.
| érzékenység | specificitás | PPV, % | NPV, % | AUC | |
|---|---|---|---|---|---|
| cTnT>0,01 + ons | 100% (97.9–100) | 96.4% (92.4–98.6) | 86.8 | 100 | 0.982 |
| cTnT>0,035 + ons | 81.8% (75.2–87.2) | 97.9% (94.4–99.4) | 90.0 | 95.8 | 0.898 |
| HR-TnT> 13 + ons | 78.8% (71.9–84.6) | 85.0% (78.8–89.9) | 55.3 | 94.4 | 0.818 |
AUC: a görbe alatti terület; cTnT: szív troponin T; hs-TnT: nagy érzékenységű troponin T; PPV: pozitív prediktív érték; NPV: negatív prediktív érték.
ezenkívül értékeltük a ROC elemzésből származó optimális határértékeket. Az optimális pont 37 ng/l (hs-TnT-ROC) volt (3.táblázat). A hs-TnT-ROC értéke 59 érzékenységet mutatott.7% – messze elmarad a hs – TnT-től, de nagyobb, mint a 4G TnT (CV) -, az első mérés során pedig 95,3% – os specificitás. Ez a nagyobb érzékenység a 4G TnT (CV) tekintetében a többi mintavételben is fennmaradt.
a hs-TnT ROC diagnosztikai teljesítményének összehasonlítása (> 37).
| T0 | Sensitivity, % | Specificity, % | EFF, % | LR+ | LR− | PV+, % | PV−, % |
|---|---|---|---|---|---|---|---|
| cTnT>0.01 | 75.3 | 91.2 | 87.7 | 8.60 | 0.27 | 70.7 | 92.9 |
| cTnT>0.035 | 42.8 | 97.5 | 85.5 | 16.8 | 0.59 | 82.5 | 85.8 |
| hs-TnT>13 | 87 | 71.5 | 74.9 | 3.1 | 0.18 | 46.2 | 95.1 |
| hs-TnT>37 | 59.7 | 95.3 | 87.5 | 12.6 | 0.42 | 78 | 89.4 |
ctnt: szív troponin T; hs-TnT: nagy érzékenységű troponin T.
a diagnózis elérésének időmegtakarítása a hs-TnT versus 4G cTn (CV) használatakor 113 perc volt. A megtakarítás viszont 147 perc (p0.001) lenne a tünetek megjelenésétől számított 3 óra alatt felvett betegek esetében, 63 perc (p=0,024) pedig a tünetek megjelenésétől számított három órán át felvett betegek esetében.
megbeszélés
a jelen tanulmányban kapott adatok képesek tisztázni bizonyos kérdéseket a hs-TnT döntéshozatalban való alkalmazásával kapcsolatban, tekintettel az ACS diagnosztikai és prognosztikai eszközeként való hasznosságára vonatkozó szilárd bizonyítékokra. A HS-TnT diagnosztikai teljesítménye végül nagyobbnak bizonyult, mint a 4G cTn a különböző mintavételi időpontokban. A teljesítmény viszont a tünetek megjelenését követő órákban csökkent. Vizsgálatunkban két minta (konkrétan 20%) közötti relatív változásokat használtunk, amelyek diszkréten javították a pozitív prediktív értéket, bár anélkül, hogy gyakorlati felhasználássá váltak volna. Ebben a tekintetben a 20% – os hányados valószínűleg túl kicsi lehet, és egyes szerzők javaslata szerint tanácsos lett volna a hányadost magasabb százalékra növelni, mivel az AMI sok esetben diszkréten magasabb értékeken volt, mint a felső referencia határ (URL).9,10 más kutatók javasolják a relatív változásokat (30 és 250% között) a diagnosztikai specificitás növelése és az AMI diagnózisának javítása érdekében.11-14 Mueller et al.15 közzétett eredmények, amelyek megmagyarázzák, hogy a relatív változások miért nem sikerül dönteni a nem st emelkedésű miokardiális infarktusban. Az abszolút változások alkalmazásával az ACS-ben szenvedő és nem ACS-ben szenvedő betegek populációjában legalább 9,2 ng/l, vagy az ACS-ben szenvedő populációban 6,9 ng/l növekedés vagy csökkenés megfelelőbbnek tűnik, mint a relatív változások az AMI kizárása szempontjából. A specifitás csökkenésével kapcsolatos problémák mellett különbségek vannak az URL-ben az alkalmazott teszt szerint. Ez kiemeli a faj, a nem, az életkor vagy a vizsgálatban résztvevők számának fontosságát16, és növeli a konszenzus elérésének nehézségeit a döntések meghozatalában.
vizsgálatunkban a HS-TnT érzékenységének fölénye a nem st emelkedésű miokardiális infarktus diagnosztizálásában nagyobbnak bizonyult azoknál a betegeknél, akiknél a tünetek nemrégiben jelentkeztek, összhangban más szerzők megállapításaival.17,18 a mellkasi fájdalommal kevesebb, mint három órán át jelentkező beteg esetében, két órával az érkezés után egy második negatív meghatározással az esetek majdnem 100% – ában kizárhatjuk az AMI-t. Ez a klinikai és EKG-eredményekkel kombinálva képes azonosítani a korai mentesítésre és a járóbeteg-kezelésre jelentkezőket. Másrészt azok a betegek, akiknél nem st elevációs myocardialis infarctust diagnosztizáltak, és hosszú evolúciós időket (3 óra felett) mutatnak, kisebb diagnosztikai pontosságot mutatnak a hs-TnT-vel, még két soros meghatározás elvégzése esetén is. Ezekben az esetekben ki kell értékelnünk a ROC-elemzésből származó optimális határértékeket. Vizsgálatunkban a határérték 37 ng / l volt, ami lehetővé tenné számunkra, hogy “uralkodjunk”, vagyis azok a betegek, akiknek pontszáma meghaladja ezt a határértéket, nagyon nagy valószínűséggel mutatják be az AMI-t. Azt is állították, hogy a szakirodalomban alábecsülték a specificitás csökkenését, és ez nem tükrözi a kórházaink HES-jében látott betegeket, ahol az átlagéletkor, a társbetegségek és a cTn-emelkedés általában magas.
a diagnózisig eltelt idő jelentősen csökkent (247-ről 71-re.5 perc).19,20 vizsgálatunkban a nem st emelkedésű myocardialis infarctus diagnózisának időmegtakarítása 147 perc volt azoknál a betegeknél, akik a tünetek megjelenése után három órán belül jelentkeztek, és 63 perc, amikor 3 óra után számoltak be.
huszonkét olyan beteg (21,5%), akiknél az UA diagnózisa mentesítéskor nem ST emelkedésű myocardialis infarctus esetek voltak a hs-TnT két meghatározása után, amelyek kinetikája több mint 20% volt közöttük. 13-ig.A nem ACS betegek 9%-A (n=24) pozitivitást mutatna a hs-TnT-vel az ilyen kinetika alkalmazásakor, és megfelelne más, progresszív szívkárosodást okozó betegségeknek, mint például myocarditis, tüdőembólia vagy takotsubo szindróma. A különböző hs-TnT elemzések akár 27% – kal több AMI-esetet észlelnek, mint a jelenlegi módszer mellkasi fájdalomban szenvedő betegeknél, akiknek alacsony vagy közepes az ACS valószínűsége.20,21 még azt is feltételezhetjük, hogy az UA diagnózisa eltűnik, amint azt Sabatine et al.22 azoknál a betegeknél, akiknek pozitív testmozgási tesztje volt, ultraszenzitív technikákkal értékelték. Ebben a vizsgálatban a HS-TnI minden betegnél kimutatható volt a tesztek előtt; az ischaemia nélküli betegeknél változás nélkül maradt; enyhe ischaemiában szenvedőknél 24% – kal, közepesen súlyos vagy súlyos ischaemiában szenvedőknél pedig 40% – kal nőtt. A 4G cTn-nél nem figyeltek meg változást. Következésképpen a nem st emelkedésű miokardiális infarktus diagnosztizálására hivatkozott eredmények a hagyományos cTn alkalmazásával aggodalomra adnak okot, mivel a szívizom károsodása korlátozott mértékű, és a cTn értékek nem mindig emelkednek korán, vagy növekedésük nem elegendő a korai azonosításhoz.
gyors megoldási protokollokat kell bevezetni, amelyek révén alacsony ischaemiás kockázatú és normál EKG–követéssel rendelkező betegeink csak 3-4 órát töltenek kórházban.23,24 megvizsgálták, hogy egyetlen hs-TnT meghatározás elegendő-e az AMI kizárásához,25 és más vizsgálatok megvizsgálták az egyetlen meghatározás lehetőségét, ha a hs-TnT érték
ng/l (azaz nem kimutatható).24 a jövőben mindezeket a helyzeteket figyelembe kell venni.Következtetések
a nagy érzékenységű troponin T teszt javítja a diagnosztikai teljesítményt, lerövidíti az AMI diagnosztizálásához szükséges időt, és képes azonosítani a kisebb infarktusban szenvedő betegek nagyobb számát, amelyeket korábban UA-ként diagnosztizáltak, és amelyek magas halálozási kockázattal rendelkeznek, összehasonlítva a hagyományos cTn-vel. Ezenkívül lerövidíti az esetek kizárásának idejét, mivel az AMI-T 2 órán belül el lehet dobni. mindez magában foglalja a myocardialis nekrózisban szenvedő betegek korábbi kezelését és a betegek HES-ben való tartózkodásának lerövidítését. Azonban azokban az egyénekben, akik három órás tünetek megjelenése után jelentenek a HES-nek, a hs-TnT nem lenne képes javítani a 4G cTn diagnosztikai teljesítményén, ezért a döntéshozatalnak óvatosabbnak kell lennie. A hs-cTn tesztek megváltoztatják az ACS-re utaló mellkasi fájdalomban szenvedő betegek kezelését és koncepcióját. Ez szükségessé teszi a sürgősségi és a kritikus orvosok számára, hogy megismerjék rutinszerű használatukat.
összeférhetetlenség
a szerzők kijelentik, hogy nincs összeférhetetlenségük.