Cell adhéziós
Cell adhéziós az a folyamat, amelynek során a sejtek kölcsönhatásba specifikus molekulák a sejt felszínén, és tulajdonítanak a szomszédos sejtek. Ez a folyamat a sejtfelületek közötti közvetlen vagy közvetett kölcsönhatásokon keresztül történhet, ahol a sejtek a környező extracelluláris mátrixhoz kapcsolódnak, amely a sejtek által a sejtek közötti térbe felszabadított molekulákat tartalmazza. A sejtadhézió akkor következik be, amikor a sejtadhéziós molekula (CAM) kölcsönhatásba lép a sejtfelszínen elhelyezkedő transzmembrán fehérjével. A sejtadhézió különböző módon kapcsolja össze a sejteket, és részt vehet a jelátvitelben, hogy a sejtek felismerjék és reagáljanak a környező környezet változásaira. A sejtadhézió által szabályozott egyéb sejtfolyamatok közé tartozik a sejtvándorlás és a szövetfejlődés a többsejtű organizmusokban. A sejtadhézió változásai megzavarhatják a fontos sejtfolyamatokat, és számos betegséghez vezethetnek, beleértve a rákot és az ízületi gyulladást. A sejtek adhéziója elengedhetetlen a fertőző organizmusok, például baktériumok vagy vírusok által okozott betegségek esetén is.
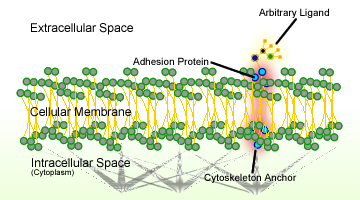 1.ábra. A sejtadhézió vázlata
1.ábra. A sejtadhézió vázlata
osztályozás
a bütykök négy fő családra oszthatók: integrinek, immunglobulin (Ig) szupercsalád, kadherin és szelektinek. Ezen adhéziós molekulák mindegyikének más-más funkciója van, és más ligandumot ismer fel. A kadherinek és az immunglobulinok homotípusos bütykök, mivel közvetlenül kötődnek egy másik sejt azonos típusú CAM-jéhez, míg az integrinek és a szelektinek heterológ bütykök, amelyek különböző típusú CAM-okhoz kötődnek. A sejtadhézió hibáit gyakran a bütykök expressziójának hibáinak tulajdonítják. A többsejtű organizmusokban a bütykök közötti kötődés miatt a sejtek egymáshoz tapadnak, és egy sejtcsatlakozásnak nevezett struktúrát alkotnak.
funkciójuk szerint a sejtcsomópontok a következők szerint osztályozhatók:
horgonyzó csomópontok (adherens csomópontok, desmosómák és hemidesmosómák), amelyek a sejteket fenntartják és erősítik a sejtek közötti érintkezést.
elzáró csomópontok (szoros csomópontok), amelyek lezárják a sejtek közötti réseket sejt–sejt érintkezés útján, vízálló gátat hozva létre a diffúzióhoz.
Csatornaképző csomópontok (rés csomópontok), amelyek összekapcsolják a szomszédos sejtek protoplazmáját, lehetővé téve a molekulák szállítását a sejtek között.
jelátviteli csomópontok, amelyek a rendszeren belüli szinapszisok lehetnek.
Alternatív megoldásként a sejtcsomópontokat 2 fő fajtába lehet besorolni annak megfelelően, ami kölcsönhatásba lép a sejttel: sejt–sejt csomópontok, a fő mediátusban kadherinek, sejt–mátrix csomópontok, a fő mediátban integrinek.
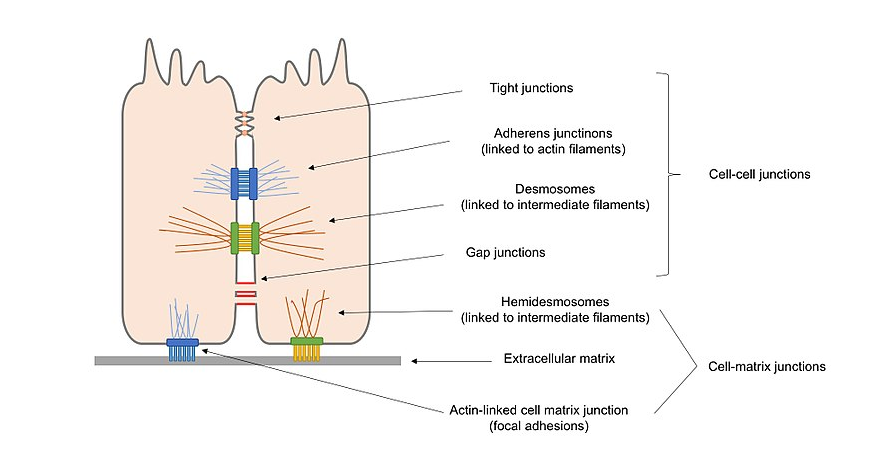 2.ábra. A hámsejtekben jelen lévő különböző típusú sejtcsomópontok áttekintő diagramja, beleértve a sejt–sejt csomópontokat és a sejt–mátrix csomópontokat.
2.ábra. A hámsejtekben jelen lévő különböző típusú sejtcsomópontok áttekintő diagramja, beleértve a sejt–sejt csomópontokat és a sejt–mátrix csomópontokat.
a Sejtadhéziós fehérjék szerkezeti jellemzői
a Sejtadhéziós fehérjék általában glikoproteinek, amelyek közvetítik a sejt-sejt és sejt extracelluláris mátrix felismerését az extracelluláris felületen. A legtöbb sejtadhéziós molekula hasonló konformációval rendelkezik tapadó doménjeiben. Például: a kadherin, az immunglobulin-szerű, a III-as típusú fibronektin és az EGF adhéziós doménjei döntően a folyamat során kialakuló, ún. A sejtadhézióban szerepet játszó közös motívum a görög kulcshordó szerkezet, amely egy vagy két párhuzamos anti-párhuzamot tartalmaz.
az Ig-szerű domainek a görög kulcstartók egyik fő osztálya. Szekvencia hasonlóságuk van a hét-kilenc párhuzamos anti-párhuzamos alternáló szálat tartalmazó antitestek változó vagy állandó doménjével. Az anti-párhuzamos p lapok alkotnak egy 3-D-D-hordó. Az Ig-szerű doméneket hidrofób mag és diszulfid kötések stabilizálják. Két fő csoportra oszthatók: Ig C-szerű és Ig V-szerű domének.
a Sejtadhéziós fehérjék funkcionálisan kapcsolódó szerkezeti jellemzői
a Sejtadhéziós fehérjék funkcionális sokféleséggel rendelkeznek. A sejtadhéziós molekulák kölcsönhatása lehet homofil vagy heterofil fehérje-fehérje kölcsönhatások vagy fehérje-szénhidrát kölcsönhatások. A sejtadhéziós molekulák szerkezeti változásai gyakran kapcsolódnak funkcionális tulajdonságaikhoz.
Homofil Fehérje-Fehérje Kölcsönhatások.
például a kadherinek transzmembrán Ca2 + – függő homofil adhéziós molekulák. A kadherinek felelősek a szövetek hasonló sejtjei közötti csomópontok fenntartásáért. A sejt-sejt adhéziót a kadherinek N-terminális doménje közvetíti. Öt hasonló extracelluláris domént tartalmaz EC1 nak nek EC5. Az N-kadherinben végzett röntgen-kristálytani vizsgálatok azt mutatták, hogy az EC1 domén dimert képez, amelyben a monomerek párhuzamosan vannak orientálva a plazmamembránból kifelé mutató ragasztókötő felületükkel. Az EC1 domének monomer egységei antiparallel módon lépnek kölcsönhatásba egymással, ragasztókötő felületeik felhasználásával, és egy homogén hordószerkezetet alkotnak. Az interakció feltételezett interfészét javasolták mind hidrofób, mind poláris / töltött karakterrel, amely utánozza az immunglobulin domének kölcsönhatásának interfészét az Ig szupercsaládban.
Heterofil Fehérje-Fehérje Kölcsönhatások.
például az integrinek különböző sejtfelszíni receptorokhoz és extracelluláris mátrix ligandumokhoz való kötődése a heterofil fehérje-fehérje kölcsönhatás egyik fő osztálya a sejtadhéziós rendszerekben. Az oldható fibrinogénhez való kötődés után az integrin AIIB A3 nagy affinitású kötési állapotba alakul át. Az integrin ligandumkötés által kiváltott konformációs változásai ebben az esetben kritikusak tapadási aktivitása szempontjából. A T-sejt receptor kötődése modulálhatja az integrin, a leukocita funkcióhoz kapcsolódó antigén – 1 (LFA-1) kötési affinitását receptoraihoz, például ICAM-l vagy ICAM-2 (intercelluláris sejtadhéziós molekula). Az ICAM-l kötődése tovább indukálhatja az LFA-1 konformációs változásait. A fehérje ragasztókötési helye az LFA-l C-terminálisában helyezkedik el röntgen-kristálytani vizsgálat alapján.A tripeptid, arginin-glicin-aszparaginsav (RGD), egy közös integrin ligandum kötő motívum. Például a fibronektin integrinkötő ligandum III típusú moduljának görög kulcscsöves szerkezete van, amelynek RGD motívuma, amely az F és G főszálakat összekötő hurok csúcsán helyezkedik el, közvetíti az adhéziót. Az RGD-hurok kiegyenesítése egy lineárisabb ingadozó konformációvá a kibontás révén csökkenti a hurok hozzáférhetőségét a felülethez kötött integrinekhez, és ezáltal csökkenti a kötés affinitását és szelektivitását.
Fehérje-Szénhidrát Kölcsönhatások.
a szelektinek fontosak a vascularis endotheliummal való lymphocyta és neutrophil kölcsönhatásban. A szelektinek adhéziós molekulák, amelyek kötődnek a szénhidrátokhoz. Még nincsenek közvetlen szerkezeti adatok a szelektinek szénhidrátokhoz való kötődéséről. A szelektinek alacsony affinitással kötik meg a szénhidrátokat, és nagyon gyors be-és kikapcsolási arányuk van.