a szénhidrát rész hozzáadása egy fehérjemolekulához fehérje glikozilezésnek nevezzük. Ez egy gyakori poszttranszlációs módosítás a sejtmembrán képződésében részt vevő fehérjemolekulák számára. E folyamat során a monoszacharid egységek aminosav-láncokkal való összekapcsolása előkészíti az enzimatikus reakciók sorozatát, amelyek glikoproteinek képződéséhez vezetnek (n és o kapcsolt oligoszacharidok, amelyek egy fehérje entitáshoz kapcsolódnak). Állítólag mind a 16 ismert enzim közvetíti ezt a reakciót. Egy tipikus glikoproteinnek legalább 41 kötése van, amelyek 8 aminosavat és 13 különböző monoszacharid egységet tartalmaznak, és tartalmazzák a glikofoszfatidilinozit (GPI) és a foszfoglikozil kötéseket. A fehérje glikozilezés segít a fehérjék megfelelő hajtogatásában, a stabilitásban és a sejt-sejt adhézióban, amelyre általában az immunrendszer sejtjei szükségesek. A fehérje glikozilációjának fő helyei a testben az ER, a Golgi test, a mag és a sejtfolyadék.
a fehérje glikozilezés két fő típusba sorolható:
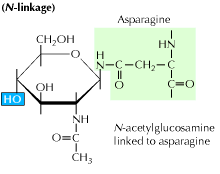 a) N-kapcsolt glikozilezés: 14-cukor prekurzor hozzáadásával kezdődik egy aszparagin aminosavhoz. Glükóz, mannóz és n-acetil-glükózamin molekulákat tartalmaz. Ezt az entitást ezután átviszik az ER lumenbe. Az oligoszacharil-transzferáz enzim az oligoszacharidláncot aszparaginhoz köti, amely a tripeptidszekvenciában, az Asn-X-Ser vagy az Asn-X-Thr-ben fordul elő. Az X bármilyen aminosav lehet, kivéve a prolint. Az oligoszacharidhoz kötődő fehérjeszekvencia most már megfelelően hajtogatódik, és most áttelepül a Golgi testbe, ahol a mannóz maradékot eltávolítják.
a) N-kapcsolt glikozilezés: 14-cukor prekurzor hozzáadásával kezdődik egy aszparagin aminosavhoz. Glükóz, mannóz és n-acetil-glükózamin molekulákat tartalmaz. Ezt az entitást ezután átviszik az ER lumenbe. Az oligoszacharil-transzferáz enzim az oligoszacharidláncot aszparaginhoz köti, amely a tripeptidszekvenciában, az Asn-X-Ser vagy az Asn-X-Thr-ben fordul elő. Az X bármilyen aminosav lehet, kivéve a prolint. Az oligoszacharidhoz kötődő fehérjeszekvencia most már megfelelően hajtogatódik, és most áttelepül a Golgi testbe, ahol a mannóz maradékot eltávolítják.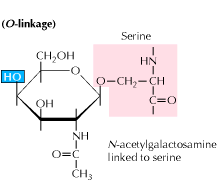
b) O-kapcsolt glikozilezés: a glikozilezés az N-acetil-galaktozamin enzim által közvetített hozzáadásával kezdődik, amelyet más szénhidrátok követnek a szerin-vagy treonin maradékokhoz. A vizsgálatok azt mutatják, hogy az O-kapcsolt glikozilezés a fehérje feldolgozásának későbbi szakaszában következik be.