Bevezetés
az 5-ös típusú foszfodiészteráz (PDE5) enzimatikus hatása az elsődleges mechanizmus a cGMP inaktiválására, az értágító szer nitrogén-monoxid (NO) downstream közvetítője (Lugnier, 2006).
az erectilis dysfunctio (ED) során az endothel cavernous erekből származó NO csökkent termelése farmakológiailag leküzdhető PDE5 inhibitorok (PDE5i) alkalmazásával a cGMP felezési idejének meghosszabbítása és a maradék értágító funkció fokozása érdekében (Hawksworth and Burnett, 2015). Ezután számos, a PDE5-re gátló hatású molekulát vetítettek ki és bocsátottak forgalomba, amelyek eltérő hatást mutatnak a hatás kezdetével és időtartamával. Jelenleg a PDE5i az első választott gyógyszer, amelyet az ED kezelésére használnak (Mehrotra et al., 2007).
a nem kiválasztott ED betegek közel 80% – ában elismert hatékonyság ellenére (Eardley et al., 2010; Hatzimouratidis et al., 2010; Porst et al., 2013), figyelemre méltó lemorzsolódás a pde5i kezelésről nemrégiben számoltak be. Mennyiségi szempontból átlagosan havi 4% – os abbahagyási arányról számoltak be, a terápia általános elhagyásával az esetek 50% – ában évente (Carvalheira et al., 2012; Corona et al., 2016). A betegek által a terápia elhagyásának igazolására adott fő okok között a hatékonyság hiányát és a mellékhatásokat említik a leggyakoribbnak (Corona et al., 2016). Kétféle mellékhatást lehet megkülönböztetni: azokat, amelyek szigorúan kapcsolódnak a PDE5 gátláshoz, mint például a fejfájás, a kipirulás és a dyspepsia, valamint azokat, amelyek a gyógyszerek egyéb PDE-re gyakorolt maradék gátló aktivitásához kapcsolódnak, mint például az értágulat és a tachycardia (PDE1), látászavarok (PDE6) és hátfájás (PDE11) (Bischoff, 2004; Gupta et al., 2005). Mivel a mellékhatások előfordulása mind a szérumszinttel, mind a gyógyszerrel való időbeli expozícióval növekszik (Gupta et al., 2005; Taylor et al., 2009), a gyógyszer biztonságossági/hatékonysági profilja alternatív módon javítható farmakokinetikai megközelítéssel egy új gyógyszerforma megtervezésével (Mehrotra et al., 2007). Ezt a megközelítést sikeresen alkalmazták a Pde5i esetében Vardenafil. Valójában ez a molekula viszonylag alacsony biohasznosulást szenved (65%, Center for Drug Evaluation and Research, 2003). A filmtablettához (FCT) képest, amely a klasszikus per os beadásra szolgáló eredeti készítmény, az oro-diszpergálható tabletták (ODT) a Vardenafil számára jelentősen növelte a gyógyszerek biohasznosulását azáltal, hogy elősegítette a nyelv alatti felszívódást, ezt az utat elismerték, hogy kevésbé befolyásolja a first-pass metabolizmus (Heinig et al., 2011).
a szildenafil (Sild) volt az első szelektív PDE5 inhibitor, amelyet ED kezelésére engedélyeztek (Boolell et al., 1996). Ez egy viszonylag lipofil molekula, és orális alkalmazás után a plazma csúcskoncentráció 0,5-2 óra közötti idő alatt érhető el. a Sild viszonylag alacsony orális biohasznosulást mutat (38-41%), elsősorban a kiterjedt bél-és first-pass metabolizmus miatt (Gupta et al., 2005). Annak ellenére, hogy a hosszú jelenléte a piacon, a fejlesztés az új készítmények gyógyszer rosszul követett, amíg a közelmúltban megjelent az olasz piacon egy új készítmény: az oro-diszpergálható film (ODF). Valójában az ODF-et az FCT bioekvivalens formájaként hagyták jóvá (Leoni et al., 2013). Az orálisan széteső készítmények azonban megfelelő rendszereket jelenthetnek a transz-nyálkahártya, különösen a szubnyelvi felszívódás elősegítésére (Kathpalia and Gupte, 2013).
ebben a vizsgálatban az ODF vagy ODT szublingvális beadásához kapcsolódó Sild farmakokinetikáját értékeltük, összehasonlítva az FCT-vel, mint eredeti per os formulával. Ennek érdekében megvizsgáltuk a különböző Sild készítmények felszabadulási/permeációs profilját in vitro rendszerek kifejezetten a gyógyszerek transz-nyálkahártya felszívódásának értékelésére fejlesztették ki. Továbbá SZÁMSZERŰSÍTETTÜK a Szild farmakokinetikájának szérumprofilját a per os FCT, valamint a szublingvális ODT és ODF alkalmazása után ED-ben szenvedő betegeknél.
anyagok és módszerek
vegyi anyagok és gyógyszerkészítmények
Hank ‘ s balance sók oldat pH 7,4 (HBSS), HEPES oldat, benzanilid, és Sild citrát mind vásárolt Sigma–Aldrich (Milánó, Olaszország). A piacon elérhető alternatív bioekvivalens termékek használatából eredő zavaró eredmények elkerülése érdekében a következő termékeket használták: Viagra (Pfizer, Milánó, Olaszország), Viagra (Oro) és Rabestrom (Ibsa, Lodi, Olaszország). Gyógyszereket írtak fel a betegeknek a járóbeteg-értékelés során magáncélú használatra. Az in vitro vizsgálatokhoz és a farmakokinetika in vivo értékeléséhez (lásd alább) a gyógyszereket kifejezetten a vizsgálatban részt vevő személyzet vásárolta a helyi gyógyszertári létesítményekben, majd optimális körülmények között kezelte/tárolta.
Dezaggregációs teszt
az in vitro dezaggregációs vizsgálatokat az Európai Gyógyszerkönyv (2016) szerint végeztük tabletta dezintegrációs teszterrel (Sotax DT 2, S1A kiegészítő ábra), víz mint merülő folyadék felhasználásával 37 0, 5 C. A dezaggregáció idejét a dózisforma teljes dezintegrációjánál ellenőriztük. A teljes szétesést úgy definiáljuk, mint azt az állapotot, amelyben az egységnek a vizsgálóberendezés ernyőjén maradó vagy a tárcsák alsó felületéhez tapadó maradéka olyan lágy tömeg, amelynek nincs tapinthatóan szilárd magja. A vizsgálatokat három példányban végezték,és az eredményeket átlagértékként jelentették.
oldódási teszt
In vitro gyógyszeroldódási vizsgálatokat végeztek az Európai Gyógyszerkönyv szerint . Az oldódási teszteket lapátkészülékkel végeztük, lapátsebesség 50 rpm, HBSS pH 7,4-et használtunk oldódási közegtérfogatként(900 ml 37 0,5 KB-nál).
a felszabadulási vizsgálatok során 2 ml oldódási közeg mintát, at 0, 2, 4, 6, 10, 20, 30, és 40 perc, eltávolítottuk, és átszűrjük 0,45 Ft cellulóz-észterek szűrő, és így hígítjuk. Ezt követően az Sild mennyiségi meghatározását nagy teljesítményű folyadékkromatográfiával (HPLC)-UV-vel végeztük. Az eltávolított térfogatot minden alkalommal friss közegre cserélték. A vizsgálatokat három példányban végezték,és az eredményeket átlagértékként jelentették. Az adatokat a készítmény hatóanyag-tartalmára normalizáltuk.
transz-nyálkahártya permeációs teszt
a Sild transz-nyálkahártya permeációs profilját in vitro egy specifikus eszköz alkalmazásával értékelték Delvadia et al. (2012) megfelelően módosítva. Röviden, Az eszköz egy függőleges diffúziós rendszerből állt, amelyet donor–vevő kamrák mutattak be, amelyeket eldobható cellulóz–acetát membrán választ el (pórus 0,45 KB). A donor sejt 1,5 ml HBSS-t tartalmazott, míg a vevőkamra egy 30 ml-es zárt recirkulációs kör része volt, beleértve a cső és a tartály térfogatát. A mintavételt a vevőkamra tartályából végeztük a 0, 5, 10, 20, 30, és 40 perc, és helyébe egyenértékű mennyiségű friss HBSS. A mintákat HPLC-UV-vel elemeztük a gyógyszertartalom szempontjából (Fej Xhams et al., 2014). Az adatokat a tiszta Szild-citrát esetében megfigyelt legmagasabb áthatolt Szild-koncentrációra normalizáltuk. A vizsgálatokat három példányban végezték,és az eredményeket átlagértékként jelentették.
farmakokinetikai vizsgálat önkéntes pszichogén ED betegeken
a vizsgálatot az andrológia és reproduktív orvoslás egységében (Padovai Egyetemi Kórház, Olaszország) végezték 2017 májusa és szeptembere között, a Helsinki Nyilatkozat szerint, a Padovai Egyetemi Kórház Etikai Bizottságának jóváhagyásával (3982/AO/16 protokollszám és egymást követő módosítások). A zavaró eredmények elkerülése érdekében pszichogén ED-vel rendelkező alanyokat vontak be, mert az organikus zavarok alacsonyabb előfordulása az ED-hez kapcsolódik (Ludwig and Phillips, 2014).
a minta méretét úgy számítottuk ki, hogy legalább 0,5 hatásméretet érjünk el 0,8 statisztikai teljesítménnyel és 0,05 szignifikanciaszinttel háromcsoportos összehasonlításhoz (lásd teljesítménykalkulátor – egyirányú független ANOVA).
húsz beteget (átlagéletkor 31,4, 5,7 év) vettek fel egymás után az aláírt tájékoztatáson alapuló beleegyezés kiadásával. A betegek járóbeteg-értékelésen vettek részt, amely arról számolt be, hogy az előző 6 hónapban vagy annál hosszabb ideig nem sikerült elérni és fenntartani az erekciót a kielégítő nemi közösüléshez. Az ezt követő klinikai értékelést minden betegnél elvégezték annak megállapítása érdekében, hogy nincsenek-e ED-vel kapcsolatos betegségek, például diabetes mellitus, magas vérnyomás, neurológiai rendellenesség, antidepresszánsok alkalmazása. A pszichogén ED diagnózisát a < 26 index pontszám teljesítése igazolta a nemzetközi erekciós funkció Index-15 (IIEF-15) kérdőív (Lotti et al., 2016), valamint az éjszakai spontán erekció fenntartása, amelyet éjszakai Péniszdaganat és merevség-monitorozás értékel a RigiScan Plus merevség-értékelési rendszeren keresztül (Dacomed, Egyesült Államok) két egymást követő éjszakán keresztül, a korábban leírtak szerint (Munoz et al., 1993; Caretta et al., 2005). A kizárási kritériumok a következők voltak: rosszindulatú daganatok diagnosztizálása, rendellenes hormon plazmaszint (ill. luteinizáló hormon >8 UI/l, teljes tesztoszteron <10,4 nmol/l, tirotropin >4,5 mUI/l, prolaktin >20 ng/ml), valamint megnövekedett intima-media vastagság az aorta feletti törzseknél (>0.9 mm) és/vagy cavernous artériák (>0,3 mm), színes Doppler-ultrahanggal értékelve, amint azt korábban leírtuk (Caretta et al., 2005, 2009).
a betegek beleegyeztek egy egyszeri dózisú, háromutas, keresztezett, nyílt elrendezésű vizsgálatba. A gyógyszer adagolási sémáját az 1. ábra mutatja be. A Sild adagját 50 mg-nak választották, összhangban a pszichogén ED kezeléséről szóló korábbi jelentésekkel (Banner and Anderson, 2007). A betegeket arra kérték, hogy a vizsgálat előtt és alatt 1 hétig ne vegyenek be kábítószert vagy alkoholt. Ezenkívül a gyógyszeradagolás napján a betegeket arra is felkérték, hogy legalább 2 órával a vizsgálat előtt fogyasszanak zsírmentes reggelit (tej vagy más zsíros étel nélkül). A referenciakészítménynek tekintett FCT-t klasszikusan per os-ként adták be úgy, hogy az orális tablettát egy pohár vízzel lenyelték. Az ODT és az ODF esetében a betegeket arra utasították, hogy a készítményt a nyelv alatt tartsák 15 percig víz feltételezése nélkül, majd nyelés után. A vénás vérmintákat standard csövekben gyűjtöttük (Vacutainer ,BD Biosciences, Milánó, Olaszország) a 0, 5, 10, 15, 30, 60, 90, 120, 240 perccel a gyógyszer beadása után. Kompenzációt steril sóoldat folyamatos infúziójával végeztünk. Az adagolás után az alanyokat a vérvétel befejezéséig elhelyezték. Az adagolástól számított 24 órán belül további vérelvonást hajtottak végre kontroll okokból a teljes gyógyszer-clearance megállapítása érdekében. Kimosási periódusként 7 nap telt el egy Adagolás és a következő adag között. A vérvételt követően a plazmát azonnal elkülönítették és -80 6c hőmérsékleten tárolták a felhasználásig.
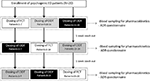
1. ÁBRA. Adagolási séma és a farmakokinetikai paraméterek értékelésének értékelése 20 pszichogén erectilis dysfunctióban (ed) szenvedő betegnél, három csoportra osztva (sorrendben 1-7; 8-14; és 15-20 betegek). A betegek minden csoportja per os filmtablettát (FCT), szublingvális Oro-diszpergálódó tablettát (ODT) vagy szublingvális Oro-diszpergálódó filmet (ODF) kapott, minden egyes adagolásból legalább 1 hetes lemosással. Minden készítmény 50 mg szildenafilt (Sild) tartalmazott.
a ház során a betegeket arra is felkérték, hogy rögzítsék a gyógyszermellékhatásokat (ADR) egy kifejezetten megfogalmazott formában, az Agenzia Italiana del Farmaco (AIFA1) ADR jelentési űrlapjából adaptálva. A kérdőív lefordított változata kiegészítő anyagként áll rendelkezésre (lásd Az S1 kiegészítő adatlapot). A betegeket arra kérték, hogy nevezzék meg a mellékhatás típusát,a teljes intenzitást (szubjektív értékelési skálán 1-től nagyon gyengéig, 5-ig, nagyon intenzívig), a megjelenés idejét és a teljes időtartamot.
a szildenafil mennyiségének meghatározása a humán szérumban
a szild szérumszintjének meghatározásához 400 db szérummintát adtak hozzá 500 ml metanolból, kiegészítve a belső standard (IS) benzaniliddel (5 ~ g/ml). Ezt követően 5 ml etil–acetátot adtunk az elegyhez, a mintákat folyadék-folyadék extrakcióra vortexeltük, a két fázist centrifugálással választottuk el. A szerves részt ezután vákuumcentrifuga alatt elpárologtattuk 40 C. A kapott maradékot újra feloldottuk 200 ml metanollal, és végül nagy teljesítményű folyadékkromatográfiás-tandem tömegspektrometriás (HPLC-MS/MS) elemzéshez használtuk.
nagy teljesítményű folyadékkromatográfia-MS / MS analízis használt rendszer Agilent-Varian 1260 és a tripla-négyszeres detektor Agilent-Varian 320 MS kromatográfiás elválasztást végeztünk egy oszlop Fenomenex C-18 Evo 3 Anavar 100 és a mobil fázis alkotja acetonitril 0,1% hangyasav vízben egy gradiens részletezett kiegészítő ábra S2A. Pozitív detektálási módot alkalmaztunk az IS 198 > 105 Da átmenetére, amelyet 40 V kapilláris feszültséggel és 16 V ütközési energiával kaptunk, míg 475 > 100 Da Sild esetében 40 V kapilláris feszültséggel és 22,5 V ütközési energiával. Az IS és Sild reprezentatív kromatogramjait valós mintákban az S2B kiegészítő ábra mutatja.
Statisztikai analízis
a farmakokinetikai paramétereket (PK), mint pl. a maximális szérumkoncentrációt (Cmax), a maximális szérumkoncentrációig eltelt időt (tmax) és a görbe alatti területet (AUC) különböző időpontokban a GraphPad szoftverrel (La Jolla, CA, Egyesült Államok) végzett speciális alkalmazási rutinokkal számították ki. Az adatok statisztikai elemzését SPSS 21.0-val végeztük Windows (SPSS, Chicago, IL, Egyesült Államok). A Kolmogorov-Smirnov tesztet használták az eloszlás normalitásának ellenőrzésére. A normál eloszlást nem mutató változókat log transzformáltuk. A betegek kiindulási jellemzőit, a PKs-t és az in vitro kísérletekből származó adatokat összehasonlították a Bonferroni–Holm korrekcióval végzett párosítatlan Student t-tesztekkel többszörös összehasonlítás céljából. Ismételt mérések ANOVA-t végeztek a gyógyszerleadás és a Szild szérumkoncentráció különbségeinek tesztelésére. Levene tesztjét használták a csoportok közötti variancia homogenitásának tesztelésére. Ha a variancia homogenitásának feltételezését megsértették, Welch-tesztet végeztek, és a megfelelő P-értéket jelentették. Az ADR arányát összevetettük a 6 pontos teszttel. P-értékek < 0.05 statisztikailag szignifikánsnak tekinthető.
eredmények
a szildenafil különböző gyógyszerformákból történő felszabadulásának/Permeációjának In Vitro analízise
a három gyógyszerformából származó Szild felszabadulásának és permeációjának dinamikáját korábban in vitro vizsgálták (2.ábra). Az FCT, ODT és ODF teljes lebontásának idejét az Európai Gyógyszerkönyvben leírt standard teszttel értékelték (2016; 2a.ábra). Az ODF mutatta a legnagyobb bontási időt mind az FCT, mind az ODT-hez képest (p = 0,017 és P = 0,008).
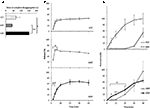
2. ÁBRA. Az 50 mg Sild-t tartalmazó FCTs, ODT és ODF-ek biotechnológiai tulajdonságainak in vitro értékelése. Az eredmények három független kísérletre nézve reprezentatívak, és átlagértékként szerepelnek, a standard deviáció pedig a standard deviáció. A) a bontási vizsgálat eredményei, megadva a készítmény teljes bontásáig eltelt időt (másodpercben). Jelentőség: a jelzett készítmények között 6 p < 0,05 és 0,01 p < 0,01. B) az oldódási teszt eredményei, az egyes készítmények által felszabaduló Szild mennyiségének jelentése a gyógyszer adagjának százalékában. Jelentőség: aP < 0,01 vs.FCT; bP < 0,001 vs. ODT. C) a permeációs vizsgálat (az “anyagok és módszerek” szakaszban részletezett) eredményei, amelyek a cellulóz-acetát membránon átáramló Szild mennyiségét jelentik, az 50 mg tiszta Szildporral elért legnagyobb érték százalékában (szakaszos vonal a felső panelen). Jelentőség: 6.o < 0,05 vs. ODT; 6950> 0,01 vs. ODT; ap < 0,01 vs. FCT.
ennek a bizonyítéknak a gyógyszer felszabadulására gyakorolt hatásának értékelése érdekében standard oldódási tesztet végeztünk (Európai Gyógyszerkönyv, 2016; 2b.ábra). Az FCT referenciakészítményhez képest az ODT a gyógyszer gyorsabb felszabadulását mutatta, amelynek maximális mértékét a vizsgálat kezdetétől számított 2 perc elteltével is elérték (P = 0,006 vs.FCT). Másrészt az ODF-ből felszabaduló gyógyszer százalékos aránya a vizsgálat első 4 percében alacsonyabb volt mind az FCT, mind az ODT-hez képest (p = 0,004 és P < 0,001). Különösen az ODF a gyógyszer progresszívebb felszabadulását mutatta az FCT-hez képest, elérve a maximális mértéket a vizsgálat kezdetétől számított 20 perc elteltével.
ennek alapján az egyes készítményekből származó Sild transz-nyálkahártya-áteresztését egy speciálisan kifejlesztett eszközzel értékeltük (2C ábra). Referenciaként a tiszta Szild-citrátot, amelyet 50 mg Szild-nek megfelelő tömegben használtak, mucosalis permeáció szempontjából értékelték, és szabad és gyors diffúziót mutattak a két kamra között. Az FCT esetében szinte ellentétes profilt figyeltek meg, amely elhanyagolható permeációt mutatott a vizsgálat kezdetétől számított 30 percig. Az ODT és az ODF permeációs profiljai a két korábbi feltételhez képest közbenső viselkedést mutattak. A vizsgálat első 20 percében az ODF szignifikánsan nagyobb mértékű permeációt mutatott az ODT-hez képest (p = 0,033 5 percnél, P = 0,003 10 percnél, P = 0,041 20 percnél). A donorkamrában teljesen lebontott FCT-től és ODT-től eltérően az ODF maradék lágyzselé tömege még a vizsgálat végén is fennmaradt a cellulóz-acetát membránon (S2c kiegészítő ábra).
a szildenafil differenciális farmakokinetikája
húsz pszichogén de által érintett férfi alany elfogadta, hogy alternatív módon FCT-t, ODT-t vagy ODF-t kapjon, elválasztva egy hét kimosással. Amint azt az “anyagok és módszerek” szakaszban részleteztük, az FCT-t klasszikusan lenyelték, hogy lehetővé tegyék a klasszikus per os alkalmazást, míg az ODT-t és az ODF-et a nyelv alatt tartották 15 percig a nyelv alatti út elősegítése érdekében. A betegek klinikai jellemzőit az 1. táblázat tartalmazza. A három adagolási körülménynek megfelelő szild szérumszinteket a 3.ábra mutatja. Jelentős variabilitás jellemezte a három készítmény gyógyszerszérumprofilját. Az FCT-hez képest az ODT a Sild szérumszintek látszólagos korai emelkedését mutatta; ez a tendencia azonban statisztikailag nem volt szignifikáns. Másrészt az ODT gyógyszerformánál az adagolást követő 120, illetve 240 perc elteltével a Szild-szint gyorsabb bomlását figyelték meg (P = 0,044 és P = 0,024 vs. FCT).
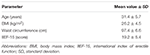
TÁBLÁZAT 1. A vizsgálatban résztvevők klinikai jellemzői (N = 20).
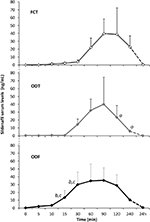
3. ÁBRA. A Sild szérumszintjének In vivo értékelése 20 pszichogén ED-ben szenvedő betegnél, akik vagy az FCT per os-t, vagy a nyelv alatti ODT-t vagy a nyelv alatti ODF-et kapják, az “anyagok és módszerek.”Az adatokat átlagértékként kell megadni, a standard deviáció jelentősége: aP < 0,05 vs.FCT; bP < 0,01 vs. FCT; cP < 0,05 vs. ODT.
az ODF készítmény gyógyszerszérumprofilja mind az FCT-hez (P = 0,001 és P = 0,003), mind az ODT-hez (P = 0,048 és P = 0,041) képest a Sild-szint gyorsabb növekedését mutatta az adagolás után 15, illetve 30 perccel. A lassú in vitro bontási idővel (2B.ábra) összhangban az ODF átlagos koncentráció–idő görbe in vivo simább volt, mint az FCT és az ODT (3. ábra).
a három készítmény farmakokinetikai paramétereit, amelyeket a Sild szérumszintek elemzéséből nyertek, a 2.táblázat foglalja össze. Annak ellenére, hogy a Cmax, a tmax és az AUC0-240 perc tekintetében nem volt szignifikáns különbség a három gyógyszerforma között, az ODF mutatta a legalacsonyabb Cmax értéket (38,2 63,7 ng/ml) és a legrövidebb tmax értéket (70,0 24,5 perc). Különösen az ODF szignifikánsan magasabb AUC0-60 min értéket mutatott mind az FCT, mind az ODT értékhez képest (p = 0,005 és P = 0.043), ami a Sild relatív biohasznosulását eredményezi az ODF nyelvalatti adagolásától számított első órán belül.

2. TÁBLÁZAT. A szildenafil készítmények farmakokinetikai paraméterei.
gyógyszermellékhatások
a vizsgálatban résztvevők által tapasztalt gyógyszermellékhatások típusára és jellemzőire vonatkozó, saját magának adott kérdőív eredményeit a 3.táblázat foglalja össze. A Sild esetében jelentett ismert ADR között (Taylor et al., 2009), A leggyakrabban feljegyzett fejfájás, kipirulás, orrdugulás. Egy beteg alacsony fokú izomfájdalomról számolt be (1.fokozat a szubjektív értékelési skálán) az FCT adagolása után. Egyik beteg sem jelentett megváltozott látást, tachycardiát, gyengeséget vagy megváltozott hallást.

3. TÁBLÁZAT. A vizsgálatban résztvevők által rögzített gyógyszermellékhatások (N = 20).
összehasonlítva az FCT-vel mint referencia formulával, az ODT az ADR nem változó prevalenciáját mutatta. Az öblítési intenzitás személyes észlelése azonban szignifikánsan alacsonyabb volt (P = 0,031). Másrészt az ODF csökkentette a fejfájás prevalenciáját az FCT-hez képest (P = 0,043). Továbbá a kipirulás és az orrdugulás időtartamát és intenzitását alacsonyabb szinteken észlelték mind az FCT-hez (sorrendben P = 0,011 és P = 0,015), mind az ODT-hez (sorrendben P = 0,026 és P = 0,037) képest.
megbeszélés
ebben a tanulmányban bizonyítékot szolgáltatunk arra vonatkozóan, hogy a Sild beadásának nyelvalatti módja összefügg a gyógyszer korai biohasznosulásának növekedésével és a jobb tolerálhatósági profillal. Ezt a bizonyítékot mind az in vitro vizsgálatok alátámasztják, amelyek azt mutatják, hogy a Sild készítményt hosszabb idő jellemzi a lebontásig, de jelentősen elősegítette a transz-nyálkahártya felszívódását, valamint az in vivo bizonyítékokat.
foszfodiészteráz inhibitorok az első választás terápiás lehetőség az ED kezelésére; azonban a betegek által tapasztalt mellékhatásokat elismerik a terápia abbahagyásának legelterjedtebb okaként (Corona et al., 2016). A farmakokinetika módosítása az új gyógyszerkészítmény megtervezésével vonzó stratégiát jelenthet a gyógyszer biztonságosságának / hatékonyságának javítására (Mehrotra et al., 2007). E tekintetben a Szild-citrát szabadalmának 2013-as lejárta számos európai országban lehetővé tette számos új Sild-készítmény felszabadítását. Meg kell jegyezni, hogy a legtöbb Sild készítmények a piacon elérhető ma ténylegesen jóváhagyott bioekvivalens formái az eredeti FCT (Leoni et al., 2013). Érdekes, hogy orálisan széteső készítményeket fejlesztettek ki, amelyeket a beteg szájában történő gyors lebontás jellemez anélkül, hogy vízzel kellene nyelni (Goel et al., 2008). Ezek az új készítmények jobb megfelelést találnak azokban a populációkban, akiknek nehézségei vannak a hagyományos szilárd dózisok lenyelésében, például gyermekek, geriátriai betegek és dysphagiás betegek. Ezen túlmenően, a magasabb orális gyógyszer-rendelkezésre állás biztosításával az orálisan széteső készítmények értékes rendszereket képviselhetnek a transz-nyálkahártya, különösen a szubnyelvi felszívódás elősegítésére (Kathpalia and Gupte, 2013). Különösen Olaszországban hivatalosan két orálisan széteső Sild készítmény kapható a gyógyszertári létesítményekben: az ODTs és az ODFs.
ebben a tanulmányban a lehetséges farmakokinetikai variációk, valamint az ADR megfelelő mintázatának értékelésére törekedtünk, amely a Sild transz-nyálkahártya felszívódásának elősegítéséből származik a két rendelkezésre álló orálisan széteső készítmény nyelv alatti beadásával gyógyszer. Az eredményeket összehasonlítottuk a Sild eredeti formulájával, nevezetesen az FCTs-szel. Érdekes módon szigorú összefüggést találtunk mind in vitro, mind in vitro a biotechnológiai tulajdonságok és a különböző készítmények PKs-je között. Különösen annak ellenére, hogy az oldódási tesztben egyenlő gyógyszerdózis (50 mg) és kissé csökkent a gyógyszer felszabadulásának sebessége, az ODF-et egyrészt a bontásig eltelt idő, másrészt a transzmucosalis modellben a permeáció nagyobb aránya jellemezte, másrészt a gyógyszer biológiai hozzáférhetősége az adagolástól számított első órán belül megnövekedett. Ezután feltételezhetjük, hogy a nyelv alatti Sild felszívódást elősegíti a hosszan tartó gyógyszer-nyálkahártya érintkezés. Valójában ezt a jelenséget általában az orális transz-nyálkahártya-gyógyszerek esetében követik, ahol a mucoadhesive polimerek használata ajánlott a készítmény és a szájnyálkahártya közötti hosszabb ideig tartó érintkezés biztosítása érdekében (Lam et al., 2014), különösen azokból a gyógyszerekből, mint például a Sild, amelyet alacsony vízoldékonyság befolyásol (Zayed et al., 2012; Sun et al., 2014). Ezek az előzetes eredmények arra is utalnak, hogy ezen gyógyszercsoport klinikai hatékonysága javulhat az eredeti készítményekhez képest. E szempontok tisztázása érdekében további vizsgálatok szükségesek.
a jelen vizsgálat legszembetűnőbb bizonyítéka az ODF nyelv alatti alkalmazása során fellépő gyógyszermellékhatások jelentős csökkenése az azonos dózisban alkalmazott ODT-hez és FCT-hez képest, ami viszont fokozhatja a betegek megfelelését. Ez a bizonyíték annak az elvnek a fényében értelmezhető, hogy a gyógyszer mellékhatásainak előfordulása növekszik a szérumszintek és magának a gyógyszernek való expozíciós idő növelésével (Gupta et al., 2005; Taylor et al., 2009). Annak ellenére, hogy a többi vizsgált készítményhez képest nem változott a globális biológiai hozzáférhetőség, az ODF nyelv alatti beadása alacsonyabb Cmax-értéket és rövidebb tmax-értéket mutatott, ami a Sild bio-hozzáférhetőségének szignifikánsan nagyobb arányát eredményezte az adagolást követő első órában. Így azt feltételezhetjük, hogy az ODF nyelv alatti beadása ötvözi a gyógyszer hatékony felszívódását az átlagos alacsonyabb szérumszint elérésével Sild következésképpen alacsonyabb a mellékhatások kockázata. Elismerjük azonban az alacsony mintaméretet, mint a vizsgálat fő hátrányát. A kérdés megerősítéséhez további vizsgálatokra van szükség nagyobb kohorszokkal és különböző dózisokkal.
összefoglalva, ebben a tanulmányban arról számolunk be, hogy a Sild ODF szublingvális beadása javítja a gyógyszer tolerálhatósági profilját egy módosított farmakokinetikai valószínű bevonásával a generátor FCTs-hez képest. Bár az ODF-et eredetileg nem erre a célra tervezték, ez vonzó stratégiát jelent a beteg terápiának való megfelelésének javítására. További összehasonlító vizsgálatokat fejlesztünk a klinikai hatékonyság értékelésére pszichogén és szerves ED betegeknél.
szerzői hozzájárulások
az LDT és a CF koordinálta a tanulmányt és elkészítette a kéziratot. Az MDRP értékelte és bevonta a betegeket. Az EF in vitro elemzést végzett. Az SDA elvégezte a szérum elemzést. Az RP elvégezte a farmakokinetikai összehasonlítást. Az RP, az NR és az AG kritikusan felülvizsgálta és véglegesítette a kéziratot.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
köszönjük Dr. Alberto Barosso-nak, Dr. Giuseppe Maggioni-nak és Dr. Dimitri Portale-nak a betegek tanácsadásáért, Dr. Flavia Rosano-nak és Dr. Alice Passadore-nak a betegek kezeléséért, valamint az andrológia és reproduktív orvoslás osztályának minden munkatársának.
Kiegészítő anyag
a cikk kiegészítő anyaga megtalálható az interneten: https://www.frontiersin.org/articles/10.3389/fphar.2018.00059/full#supplementary-material
S1. ábra / a tabletta Szétesésvizsgálójának (A), illetve az Oldódásvizsgálathoz használt Oldódókészülék (B) reprezentatív képei.
S2 |A) ábra a szildenafil(Sild) szérumszintjének nagy teljesítményű folyadékkromatográfiás-tandem tömegspektrometriás (HPLC-MS/MS) vizsgálatához használt mozgófázis gradiens részletei. A belső standard benzanilidnél lévő szild reprezentatív kromatogramjait és tömegspektrumait valós mintákban jelentették (B). C) a cellulóz-acetát membránon keresztül történő transzmucosalis felszívódás in vitro becsléséhez használt eszközben a permeációs vizsgálat után megmaradó (nem folytonos vonallal kiemelt), visszamaradó oroszperzibilis film reprezentatív képe.
S1 adatlap | mellékhatás kérdőív.
lábjegyzet
- ^http://www.aifa.gov.it/en/content/reporting-adverse-reaction
Banner, L. L. és Anderson, R. U. (2007). Integrált szildenafil és kognitív viselkedés szex terápia pszichogén merevedési zavar: egy kísérleti tanulmány. J. Szex. Med. 4, 1117–1125. doi: 10.1111 / j. 1743-6109.2007. 00535.x
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Bischoff, E. (2004). A PDE-gátlás nem szelektivitásának hatékonysága, szelektivitása és következményei. Int. J. Impot. Res.Suppl. 1, S11-S14. doi: 10.1038 / sj.ijir.3901208
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Gepi-Attee, S., Muirhead, G. J., Naylor, A. M., et al. (1996). Szildenafil: orálisan aktív 5-ös típusú ciklikus GMP-specifikus foszfodiészteráz inhibitor a pénisz merevedési zavarának kezelésére. Int. J. Impot. Res. 8, 47-52.
PubMed absztrakt / Google Scholar
Caretta, N., Palego, P., Ferlin, A., Garolla, A., Bettella, A., Selice, R., et al. (2005). A spontán erekció folytatása az erectilis dysfunctio és a carotis falának különböző mértékű megváltozása által érintett kiválasztott betegeknél: a tadalafil szerepe. Eur. Urol. 48, 326–331. doi: 10.1016 / j.eururo.2005.01.013
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Caretta, N., Palego, P., Schipilliti, M., Ferlin, A., Di Mambro, A. és Foresta, C. (2009). Cavernous artéria intima-media vastagság: új paraméter a vaszkuláris erekciós diszfunkció diagnosztizálásában. J. Szex. Med. 6, 1117–1126. doi: 10.1111/j.1743-6109.2008.01112.x
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Carvalheira, A. A., Pereira, N. M., Maroco, J. és Forjaz, V. (2012). Lemorzsolódás a merevedési zavar PDE5-tel történő kezelésében: tanulmány a prediktorokról és a abbahagyás okainak kvalitatív elemzése. J. Szex. Med. 9, 2361–2369. doi: 10.1111 / j. 1743-6109.2012. 02787.x
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Kábítószer-értékelési és Kutatási Központ (2003). NDA 021400 Levitra (Vardenafil hidroklorid) tabletta: Klinikai Farmakológia / Biopharmaceutics Review. Rockville, Md: egészségügyi és Humán Szolgáltatások Minisztériuma. Silver Spring, MD: Food and Drug Administration.
Google Scholar
Gianfrilli, D., Mannucci, E., et al. (2016). Első generációs 5-ös típusú foszfodiészteráz inhibitorok lemorzsolódása: átfogó áttekintés és metaanalízis. Andrológia 4, 1002-1009. doi: 10.1111 / andr.12255
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Delvadia, P. R., Barr, W. H. és Karnes, H. T. (2012). A biorelevant in vitro release/permeation system for oral transmucosal dosage forms. Int. J. Pharm. 430, 104–113. doi: 10.1016/j.ijpharm.2012.03.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Eardley, I., Donatucci, C., Corbin, J., El-Meliegy, A., Hatzimouratidis, K., McVary, K., et al. (2010). Pharmacotherapy for erectile dysfunction. J. Sex. Med. 7, 524–540. doi: 10.1111/j.1743-6109.2009.01627.x
PubMed Abstract | CrossRef Full Text | Google Scholar
European Pharmacopoeia (2016). Európai Gyógyszerminőségi Igazgatóság &egészségügyi ellátás (EDQM), 9.Edn. Strasbourg: Európa Tanács.
Google Scholar
Fej Xhams, I., Neumajer, G., B. Xhamni, S. és Jankovics, P. (2014). A hamisított gyógyszerekben és étrend-kiegészítőkben található PDE-5 inhibitorok kvalitatív és kvantitatív elemzése HPLC-UV alkalmazásával, egyedüli referenciaként a szildenafil felhasználásával. J. Pharm. Biomed. Anális. 98, 327–333. doi: 10.1016 / j. jpba.2014.06.010
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Goel, H., Rai, P., Rana, V. és Tiwary, A. K. (2008). Orálisan széteső rendszerek: innovációk a készítményben és a technológiában. Legutóbbi Pat. Drog Deliv. Képletesen. 2, 258–274. doi: 10.2174/187221108786241660
CrossRef teljes szöveg / Google Tudós
Gupta, M., Kovar, A. és Meibohm, B. (2005). A merevedési zavar kezelésére szolgáló foszfodiészteráz-5 inhibitorok klinikai farmakokinetikája. J. Clin. Pharmacol. 45, 987–1003. doi: 10.1177/0091270005276847
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Hatzimouratidis, K., Amar, E., Eardley, I., Giuliano, F., Hatzichristou, D., Montorsi, F., et al. (2010). Európai Urológiai Szövetség. A férfiak szexuális diszfunkciójára vonatkozó irányelvek: merevedési zavar és korai magömlés. Eur. Urol. 57, 804–814. doi: 10.1016 / j.eururo.2010.02.020
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Hawksworth, D. J. és Burnett, A. L. (2015). Merevedési zavarok kezelése. Clint. Pharmacol. Ott. 98, 602–610. doi: 10.1002 / cpt.261
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
Heinig, R., Weimann, B., Dietrich, H., és B. (2011). A vardenafil új szájban diszpergálódó tabletta gyógyszerformájának farmakokinetikája: három klinikai vizsgálat eredményei. Clint. Kábítószer Investig. 31, 27–41. doi: 10.2165/11584950-000000000-00000
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Kathpalia, H. és Gupte, A. (2013). Bevezetés a gyorsan oldódó orális vékony film gyógyszeradagoló rendszerekbe: áttekintés. Curr. Drog Deliv. 10, 667–684. doi: 10.2174/156720181006131125150249
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Lam, J. K., Xu, Y., Worsley, A. és Wong, I. C. (2014). Orális transzmucosalis gyógyszeradagolás gyermekgyógyászati alkalmazásra. ADV. Kábítószer Deliv. Rev. 73, 50-62. doi: 10.1016 / j.cím.2013.08.011
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Leoni, L. A., Leite, G. S., Wichi, R. B. és Rodrigues, B. (2013). Szildenafil: két évtizedes előnyök vagy kockázatok? Öregedő Férfi 16, 85-91. doi: 10.3109/13685538.2013.801952
PubMed Absztrakt | CrossRef Teljes Szöveg | Google Tudós
Lotti, F., Corona, G., Castellini, G., Maseroli, E., Fino, M. G., Cozzolino, M., et al. (2016). A sperma minőségének romlása súlyossága szerint szexuális diszfunkcióval jár. Hum. Fedd. 31, 2668–2680. doi: 10.1093 / humrep/dew246
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Ludwig, W. és Phillips, M. (2014). Az erekciós diszfunkció szerves okai 40 év alatti férfiaknál. Urol. Int. 92, 1–6. doi: 10.1159/000354931
PubMed Absztrakt / CrossRef Teljes Szöveg / Google Tudós
Lugnier, C. (2006). Ciklikus nukleotid-foszfodiészteráz (PDE) szupercsalád: új célpont specifikus terápiás szerek kifejlesztésére. Pharmacol. Ott. 109, 366–398. doi: 10.1016 / j. pharmthera.2005.07.003
PubMed absztrakt / CrossRef teljes szöveg / Google Scholar
Mehrotra, N., Gupta, M., Kovar, A. és Meibohm, B. (2007). A farmakokinetika és farmakodinámia szerepe a foszfodiészteráz-5 inhibitor terápiában. Int. J. Impot. Res. 19, 253-264. doi: 10.1038 / sj.ijir.3901522
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Munoz, M., Bancroft, J. és Marshall, I. (1993). A merevedési zavar, a merevség, a merevség, a merevség, a merevség, a merevség. Int. J. Impot. Res. 5, 69-76.
Google Scholar
G., G., G., G., G., G., G., Giuliano, F., Glina, S., et al. (2013). Az ISSM Szexuális orvoslás Szabványügyi Bizottsága. SOP konzervatív (orvosi és mechanikai) kezelés a merevedési zavar. J. Szex. Med. 10, 130–171. doi: 10.1111 / jsm.12023
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
V., D., Wei, X., Xue, X., Fang, Z., Ren, M., Lou, H., et al. (2014). Az acetilpuerarin fokozott orális felszívódása és terápiás hatása a D-ons-tokoferil-polietilénglikol 1000 szukcinát nanoemulziók alapján. Int. J. Nanomedicine 9, 3413-3423. doi: 10.2147 / IJN.S63777
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Taylor, J., Baldo, O. B., Storey, A., Cartledge, J. és Eardley, I. (2009). Az 5-ös típusú foszfodiészteráz inhibitorok között a mellékhatások időtartamának és a kapcsolódó zavarási szinteknek a különbsége. BJU Int. 103, 1392–1395. doi: 10.1111 / j. 1464-410X.2008.08328.x
PubMed absztrakt / CrossRef teljes szöveg / Google Tudós
Zayed, R., Kamel, A. O., Shukr, M. és El-Shamy, A. H. (2012). Közvetlenül összenyomott szilárd diszperziók és fagyasztva szárított szildenafil-citrát nyelvalatti tabletták in vitro és in vivo összehasonlító vizsgálata pulmonalis arteriás hypertonia kezelésére. Acta Pharm. 62, 411–432. doi: 10.2478/v10007-012-0027-9
PubMed Abstract | CrossRef Full Text | Google Scholar