 |
|
a vizes közegben a legtöbb reakció ionokat tartalmaz. A reakció során azonban általában kétféle Ion keletkezik: (1)” néző “ionok és (2)” játékos ” ionok. A nevek az ionok jellegét jelzik a reakció szempontjából. A játékos ionok közvetlenül a reakcióban vannak, míg a néző ionok a nézők szerepét töltik be, és elsődleges funkciójuk az elektromos semlegesség megőrzése az oldatban. Vegyük figyelembe azt a kicsapódási reakciót, amely akkor következik be, amikor a nátrium-klorid és az ezüst-nitrát vizes oldatait összekeverjük. Az AgCl fehér csapadék képződik. Ennek a reakciónak a kémiai egyenletét a következőképpen írjuk:
ez az egyenlet tartalmazza az oldatban lévő összes iont. Azonban néha szükséges, hogy csak azokat az ionokat, amelyek a játékosok, és hagyja ki a nézők. A kémiai egyenletet, amely csak a játékos ionokat tartalmazza, nettó ionos egyenletnek (nie) nevezzük. Ahhoz, hogy a nie (1) írja ki az összes oldható vegyületek ionok és (2) megszünteti ionok közös mind a reagensek és a termékek. A kapott kémiai egyenlet ezután a nie. A fenti egyenlethez: (a 2. lépéshez vigye az egeret a reakció fölé)
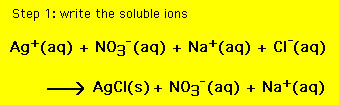
a kapott egyenlet a nettó ionos egyenlet,
míg a fenti reakció különösen egyszerű (azaz az összes sztöchiometrikus együttható egyenlő 1), összetettebb nie hasonló eljárás eredménye. Például, ha a vas(III) – nitrátot ammónium-szulfiddal keverik, sárga vas(III) – szulfid csapadék keletkezik. Ennek a reakciónak a nie: