Fluorescensspektroskopi
Fluorescensspektroskopi brukes rutinemessig til å studere strukturelle endringer i konjugerte systemer, aromatiske molekyler og stive, plane forbindelser på grunn av endringer i temperatur, pH, ionisk styrke, løsningsmiddel og ligander. En enkelt fluorofor kan generere tusenvis av detekterbare fotoner som kan gjentas opphisset og oppdaget, noe som gjør fluorescensspektroskopi en svært sensitiv teknikk.
Fluorescens Er En type strålingsutslipp som oppstår når et molekyl absorberer energi ved en bølgelengde hvor den har et transisjonsdipolmoment. Eksitasjonsenergien til molekylet ved grunntilstanden fremmer fotoner til en opphisset singlet-tilstand, hvor de deretter forfall til det laveste vibrasjonsenerginivået i denne opphissede singlet-tilstanden. Denne energien slapper videre tilbake til grunntilstanden til molekylet, og sender ut fotoner i prosessen, som vist i Figur 1.
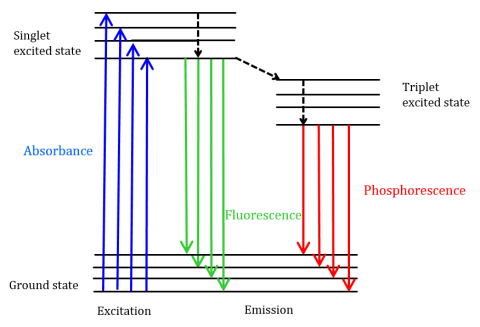
Fluorescerende molekyler kan også gjennomgå det er tre metoder for ikke-radiativ avslapping hvor eksitasjonsenergien ikke omdannes til fotoner: (1) intern konvertering, (2) ekstern konvertering og (3) intersystemkryssing. Intern konvertering oppstår når det er et relativt lite energigap mellom to elektroniske tilstander og elektronene overgang fra en høyere elektronisk tilstand til en av lavere energi. Her overføres energien til vibrasjonsmodusene til den elektroniske tilstanden. Siden vibrasjonsprosesser er termisk drevet, fører økende temperatur til nedgang i fluorescensintensitet. Ved ekstern konvertering går energi tapt gjennom kollisjonsslokking med løsningsmolekyler i fluoroforens miljø. Intersystemkryssing oppstår når vibrasjonsnivåer av singlet og triplett-eksiterte tilstander overlapper i energi og elektroner overgang fra den laveste singlet-eksiterte tilstanden til den første eksiterte triplett-tilstanden. Fotonene som sendes ut når de kommer tilbake til grunntilstanden, kalles fosforescens (Figur 1). Triplett-tilstanden er lavere i energi enn singlet-tilstanden, slik at fosforescenstoppene finnes ved lengre bølgelengder enn fluorescens. Siden disse overgangene også er forbudt, utviser fosforescens en lengre levetid (~10-4-102 sekunder) sammenlignet med fluorescens (~10-9 – 10-6 sekunder). Jo lengre levetid også føre til termisk deaktivering via oksygen quenching, løsemiddel bevegelse, og intermolekylære kollisjon så fosforescens vanligvis ikke kan observeres ved romtemperatur og prøver må derfor avkjøles ved flytende nitrogen temperatur.
Ølens Lov Og Konsentrasjonseffekter
mens absorpsjon skjer på tidsskalaen på mindre enn 10-15 sekunder, er avslapningsprosessen fra den spente til grunntilstanden mye langsommere. Derfor kan fluorescens gi informasjon om fluoroforers interaksjoner med omgivende molekyler og løsningsmidler, i motsetning til absorpsjon.
Fluorescensintensiteten er direkte proporsjonal med eksitasjonslysintensiteten
F=2,303 * K * I0 * ebc
Hvor K er en konstant basert på instrumentgeometri, I0 er intensiteten til eksitasjonslyset, e er fluoroforens molarabsorptivitet, b er banelengden, og c er konsentrasjonen. Siden fluorescensintensiteten ikke er forholdsmessig til hendelseslysintensiteten som med absorpsjonsmålinger, er fluorescensfølsomheten mye større fordi den ikke er begrenset av instrumentets evne til å skille mellom hendelsen og detekterte intensiteter. Følgelig er det nødvendig med mindre konsentrasjoner for målinger.
ligningen ovenfor er bare lineær når prøveabsorbansen er mindre enn 0,05 AU. Hvis en prøve er for konsentrert, kan emisjonslyset reabsorberes av fluoroforen, og demper fluorescenssignalet ved kortere bølgelengder. Eksitasjonslys kan heller ikke fullt ut trenge gjennom hele bredden av en høyt konsentrert prøve, noe som også vil føre til reduserte fluorescensintensiteter.
Instrumentering Av Fluorescens Spektroskopi
Kjennetegn Ved En Fluorescens Spektrum
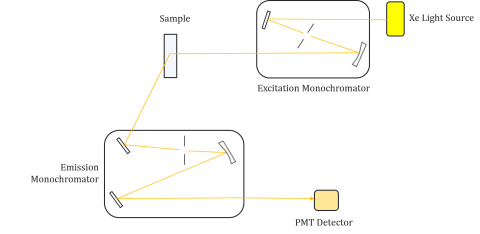
Fluorometre er sammensatt av en eksitasjon og utslipp monokromator, slik at brukerne kan oppnå både eksitasjon og utslipp spektra. En måling laget av et fluorometer er unik for det enkelte instrumentets eksitasjon og utslipp monokromatorer. Fluorescens er direkte relatert til lysstrøm og effektiviteten av måling og er derfor avhengig av instrumentdesign og komponenter som lyskilde, monokromatoroptikk og fotomultiplikatorrør. Hver lyskilde vil ha en annen spektral utgang (både form og kraft) som vil variere og redusere over levetiden til kilden.
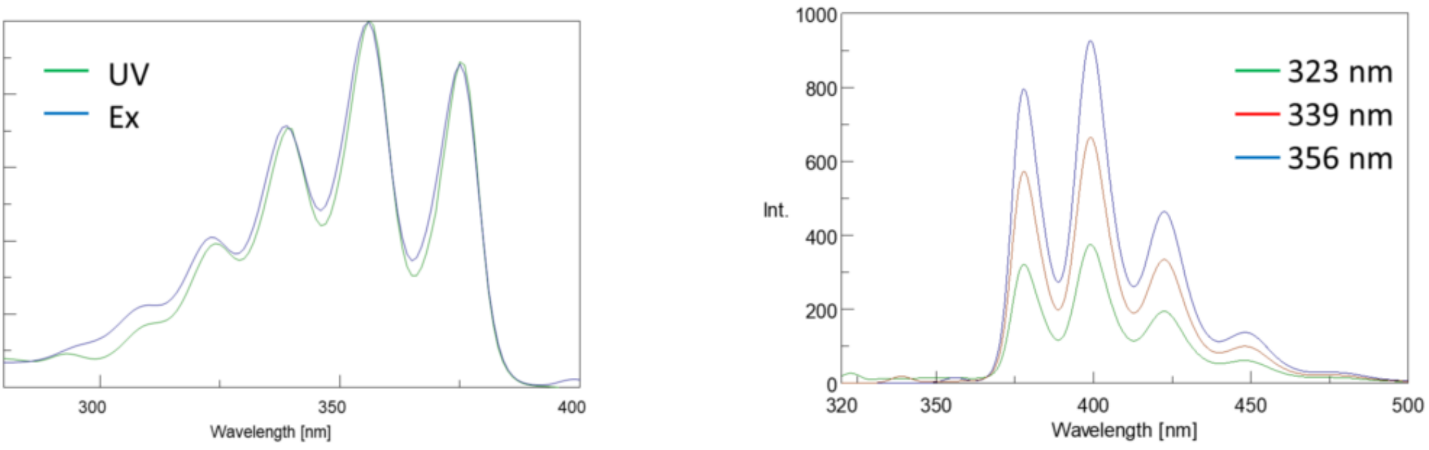
Eksitasjon spektra plotte intensiteten på en fast emisjon bølgelengde mens varierende eksitasjon bølgelengder. Siden de fleste emisjonsspektrene er uavhengige av eksitasjonsbølgelengden, er eksitasjonsspektrene ofte duplikater av fluoroforens absorpsjonsspektrum.
Omvendt plotter et utslippsspektrum intensiteten ved en fast eksitasjonsbølgelengde mens du skanner gjennom varierende utslippsbølgelengder. Disse utslippsskanningene gir informasjon om fluoroforens molekylære struktur og det lokale miljøet som omgir det. Siden fluorescensutslipp alltid oppstår fra den laveste eksiterte tilstanden til grunntilstanden, er formen på utslippsspekteret uavhengig av eksitasjonsbølgelengden. Mer energi er også nødvendig for å opphisse et molekyl fra bakken til opphisset tilstand, noe som resulterer i utslippstopper ved lengre bølgelengder (dvs.mindre energier) enn deres tilsvarende eksitasjonsbølgelengder. Denne forskjellen i energi mellom eksitasjon og utslipp bølgelengder er kjent Som Stokes shift.
i tillegg er absorpsjons-og emisjonsspektra ofte speilbilder av hverandre på grunn av lik fordeling mellom vibrasjonsenerginivåene i eksiterte og grunntilstander (Figur 3). Franck-Condon-prinsippet forklarer at fordi kjernene er relativt store og den elektroniske overgangen involvert i utslipp og absorpsjon skjer på slike raske tidsskalaer, er det ingen tid for kjerner å bevege seg og vibrasjonsenerginivåene og derfor forblir omtrent det samme gjennom den elektroniske overgangen.
Spektral Båndbredde
siden fluorescensintensiteten er proporsjonal med inngangslysintensiteten, vil mengden lys som passerer gjennom monokromatoren i stor grad påvirke intensiteten. Summen av eksitasjon og utslipp båndbredder bør være om spektral båndbredde (SBW) av toppen overvåkes slik at alle toppene er godt løst. Så lenge denne tommelfingerregelen følges, kan båndbreddene åpnes for å øke mengden lysgjennomstrømning for prøver med lav fluorescens. SBW kan også påvirkes Av stokes-skiftet av fluoroforen. Smalere Stokes-skift kan begrense rekkevidden av akseptable SBWs som kan brukes.
Fluorescens Artefakter
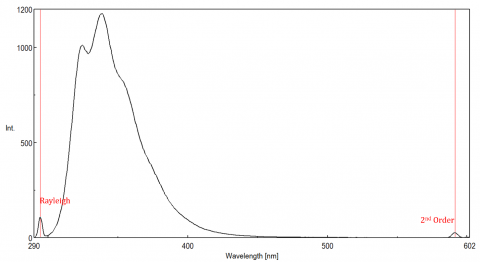
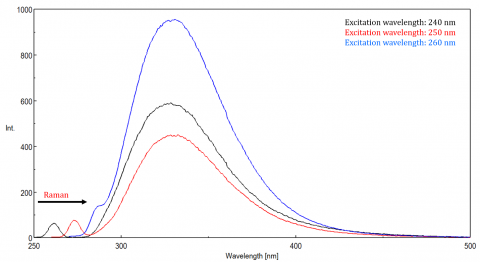
Spredt lys kan gi opphav til gjenstander, forvrenge fluorescensspekteret. De tre vanligste typene scatter sett i fluorescens er Rayleigh, 2nd order og Raman scatter (Figur 3). Rayleigh-spredning er det spredte eksitasjonslyset og topper derfor ved eksitasjonsbølgelengden. 2nd order scatter er høyere rekkefølge scatter observert ved to ganger eksitasjonsbølgelengden. Raman-spredning er uelastisk spredning på grunn av løsningsmidler og topper ved en fast energi fra eksitasjonsbølgelengden. For å skille Raman spredning fra en fluorescens topp, eksitasjon bølgelengde kan varieres i 5 til 10 nm trinn, og hvis toppen i spørsmålet skift med eksitasjon bølgelengde og avtar i intensitet, da at toppen, skyldes Raman scatter. Du kan også sjekke om toppen er i det tomme løsemiddelspekteret. Hvis det er, er det en sjanse for At Det Er En Raman-topp. Hvis fluorescens toppen er for nær eller overlappende med Enten Raman eller Rayleigh scatter, båndbredder og / eller eksitasjon bølgelengde kan justeres for å skifte scatter av fluorescens toppen. Disse effektene er mest fremtredende for svært lave fluoroforekonsentrasjoner og spesielt høyt spredningsløsninger, som proteiner, mikrosfære, nanopartikler, samt faste stoffer.
Dynamisk Område
Den Automatiske Forsterkningskontrollfunksjonen justerer automatisk forsterkningen av et signal fra detektoren basert på fluorescensintensiteten. Dette optimaliserer signalet til støy gjennom hele det skannede området for spektrale eller tidskursmålinger, slik at topper med forskjellige intensiteter justeres automatisk for å forbedre S / N og sikre resultatnøyaktighet.
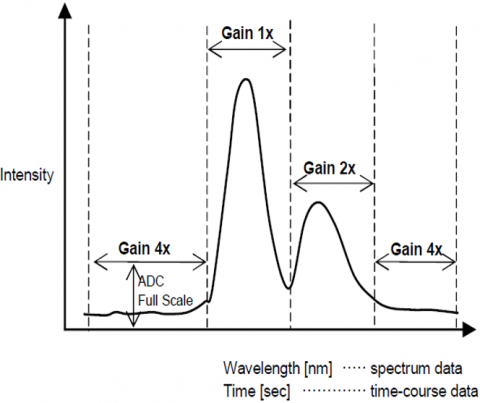
Automatisk Følsomhetskontrollsystem (SCS)
DET Automatiske Følsomhetskontrollsystemet(SCS) utvider det dynamiske området for det oppdagede fluorescenssignalet ved automatisk å justere detektorspenningen i henhold til fluorescensintensiteten. Dette gjør det mulig for faste bølgelengde eller kvantitative analyser målinger av sub-picomolar til mikromolare konsentrasjoner uten manuelt å endre instrumentet.

Figur 5. Kalibreringskurve for fluoresceinløsninger fra 5·10-13 til 1,5 * 10-6 M ved hjelp av auto-SCS-funksjonen.
Anvendelser Av Fluorescensspektroskopi
Anisotropi
Fluorescensanisotropi observeres når en fluorofor avgir lys av forskjellige intensiteter avhengig av polarisasjonsaksene og er beskrevet ved følgende ligning
r=Ivv-GIvh/Ivv+2givh
hvor er utslippsintensiteten parallell med polarisasjonen.eksitasjonsplanet og er utslippsintensiteten vinkelrett på eksitasjonsplanet. G kalles G-faktoren eller instrumentgitterfaktoren og står for polarisasjonsavhengigheten av utslippsmonokromatoren.
alle fluoroforer har overgangsmomenter som forekommer langs bestemte retninger langs molekylaksen. Når de blir utsatt for polarisert lys, vil de tilfeldig orienterte fluoroforene som har sine absorpsjonsovergangsmomenter orientert rundt vinkelen til hendelseslyset, bli begeistret, og denne opphissede statspopulasjonen er delvis orientert. Når et molekyl returnerer fra en opphisset tilstand tilbake til sin grunntilstand, blir elektronladningen omfordelt og endringen i orienteringen av dipolmomentene påvirker eksitasjons-og utslippspolarisasjonene. For eksempel, når fluorescens sendes ut før et molekyl roterer, vil fluorescenslyset bli sterkt polarisert mot retningen av eksitasjonslysets polarisasjon. Hvis lyset sendes ut etter rotasjonen av molekylet i en helt tilfeldig retning, vil fluorescensen ikke lenger polariseres.
ved måling av fluorescensanisotropi vil følgende faktorer påvirke molekylær bevegelse: (1) molekylær størrelse, (2) viskositet av molekylets miljø og (3) styrke og frihetsgrader for et bundet molekyl. Anisotropimålinger bestemmer gjennomsnittlig vinkelforskyvning av en fluorofor som oppstår mellom absorpsjon og utslipp av en foton. Vinkelforskyvningen er avhengig av hastigheten og omfanget av rotasjonsdiffusjonen i løpet av levetiden til den opphissede tilstanden. Når en fluorofor er ubegrenset og får lov til å rotere fritt før den sender ut en foton, er diffusjonshastigheten generelt raskere enn utslippshastigheten, og anisotropien er omtrent lik null. Rotasjonsdiffusjonsendringer av retningen av overgangsmomentet som depolariserer utslipp. Jo mer begrenset fluoroforen, jo større anisotropiverdien vil være, siden reduksjonen i fleksibilitet vil redusere den totale rotasjonshastigheten.
FRET
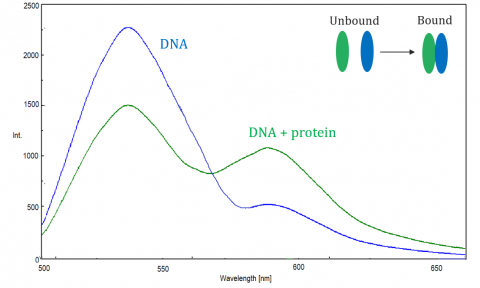
Fluorescensresonans energioverføring (FRET) er en mekanisme som styrer energioverføringen mellom to nærliggende molekyler. En donor, først i sin opphisset tilstand, kan overføre energi til en akseptor molekyl gjennom ikke-radiative elektron resonans.
FRET overvåkes av spektrofluorometeret, som måler fluorescens/slukking av akseptor eller begeistret donor. FRET effektivitet avhenger av følgende faktorer: avstanden mellom donor og akseptor, spektral overlapping mellom donor og akseptor, og justeringen av deres dipolmomenter. Effektiviteten er omvendt proporsjonal med den sjette effekten av avstanden mellom donor og akseptor, noe som gjør teknikken ekstremt følsom for små endringer i avstand. Når overlappingsområdet av donorfluorescensspekteret og akseptorabsorpsjonsspekteret er større, ER FRETEFFEKTIVITETEN høyere. FRETEFFEKTIVITETEN er også maksimalt når de to dipolmomentene er parallelle eller anti-parallelle med hverandre, og ingen energioverføring oppstår når dipolmomentene er vinkelrett på hverandre. Vanligvis når avstanden mellom donor og akseptor er betwen1 og 10 nm, OPPSTÅR FRET.
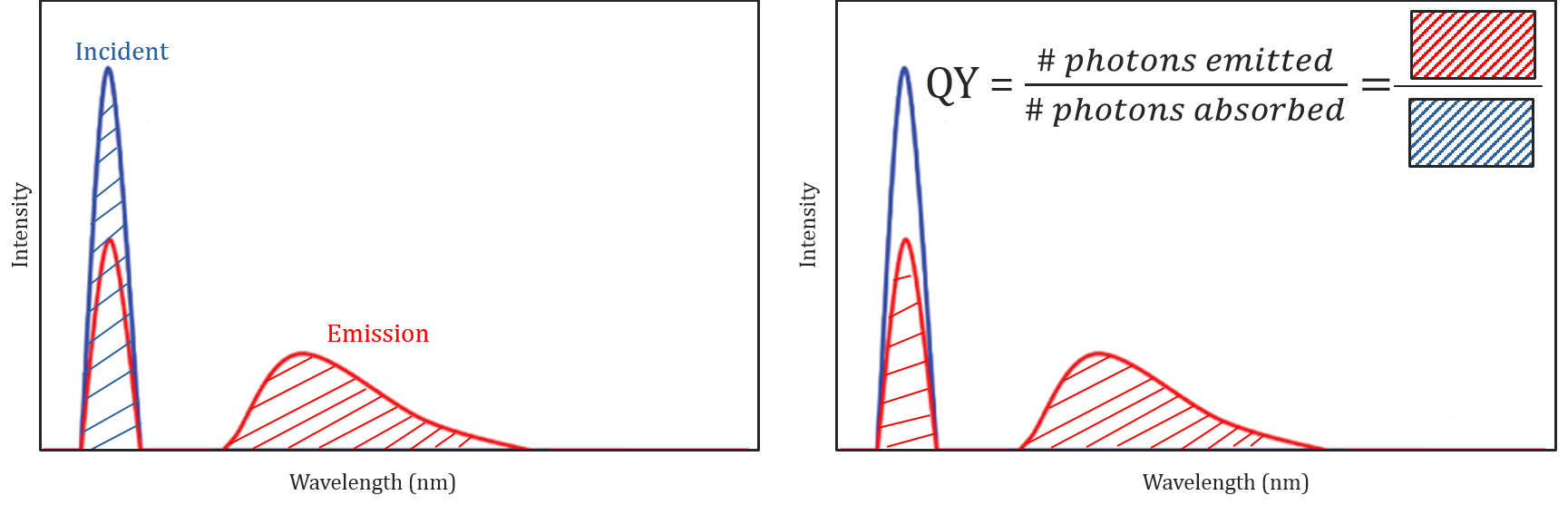
Quantum Utbytte Og Spektral Korreksjon
Ulike molekylære og miljømessige forhold ikke bare effekt om et molekyl vil fluorescere eller ikke, men kan også bestemme intensiteten eller quantum utbytte av den utstrålede fluorescens stråling. Et molekyl effektivitet til fluorescere er beskrevet av sin quantum yield og er definert som forholdet mellom antall fotoner absorbert til antall fotoner slippes ut av prøven.
i noen tilfeller er det nødvendig å bestemme nøyaktig spektralmåling. Dette gjøres ved hjelp av referanser til kjente kalibrerte materialer. De kalibrerte kildene som brukes, kontrolleres for absolutt spektralutgang på et kjent instrument, og et referansespekter leveres for å korrigere det individuelle instrumentet som leveres til kunden. For At Spektralkorreksjon skal fungere effektivt, må Den utføres ved hver instrumentparameter og båndbreddekombinasjoner, slik At Spektralkorreksjonen ved en 5 nm spektral båndbredde ikke kan brukes til måling ved hjelp av en 10 nm SBW. Dette gjelder posisjonen til polarisatorer hvis de blir brukt, samt bruk av høyere ordensfiltre. Det er nødvendig å utføre Spektralkorreksjonen for hver kombinasjon av spektrale båndbredder som skal brukes av kunden, for inkludering eller utelukkelse av filtervalg av høyere rekkefølge, og for posisjonene til polarisatorer hvis de er montert. Prøven eksitasjon og utslipp bølgelengder vil avgjøre hvilken løsning / lyskilde brukes for kalibrering.
Nær-Infrarød
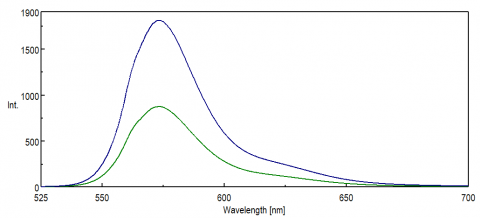
for applikasjoner som undersøker nir-regionen av spektret, er spektralresponsen til PMT-detektoren kritisk for å skaffe data. I den røde enden av den synlige regionen, inn I NIR, reduseres kvanteffektiviteten til PMT betydelig, noe som resulterer i liten eller ingen signalintensitet under prøvemålinger. FRETEKSPERIMENTER og nir-fargestoffer og prober overvåkes ofte ved bølgelengder over 500 nm og har i mange tilfeller små signaler, selv for en så sensitiv teknikk som fluorescens. Figur 8 illustrerer forskjellen i fluorescensintensitet av rhodamin B ved hjelp av en standard PMT sammenlignet med EN PMT som er mer følsom for bølgelengder på den røde enden av spekteret.
Komplementær Teknikk:
Sirkulær Dikroismespektroskopi
Sirkulær dikroismespektroskopi (CD) er en viktig analytisk teknikk som brukes til å analysere kiralitet i molekyler gjennom deres optiske aktivitet. CD kan brukes på en rekke molekylære strukturer, men har funnet favør i det vitenskapelige samfunn for klargjøring av makromolekylære struktur, spesielt proteiner og nukleinsyrer.