Spektroskopia Fluorescencyjna
spektroskopia fluorescencyjna jest rutynowo stosowana do badania zmian strukturalnych w sprzężonych układach, cząsteczkach aromatycznych i sztywnych, płaskich związkach z powodu zmian temperatury, pH, siły jonowej, rozpuszczalnika i ligandów. Pojedynczy fluorofor może generować tysiące wykrywalnych fotonów, które mogą być wielokrotnie wzbudzane i wykrywane, dzięki czemu spektroskopia fluorescencyjna jest bardzo czułą techniką.
Fluorescencja jest rodzajem emisji radiacyjnej, która występuje, gdy cząsteczka pochłania energię na długości fali, gdzie ma przejściowy moment dipolowy. Energia wzbudzenia dostarczana cząsteczce w stanie podstawowym Promuje fotony do wzbudzonego stanu singletowego, gdzie następnie rozpadają się do najniższego poziomu energii wibracyjnej tego wzbudzonego stanu singletowego. Energia ta dodatkowo relaksuje się z powrotem do stanu podstawowego cząsteczki, emitując fotony w procesie, jak pokazano na rysunku 1.
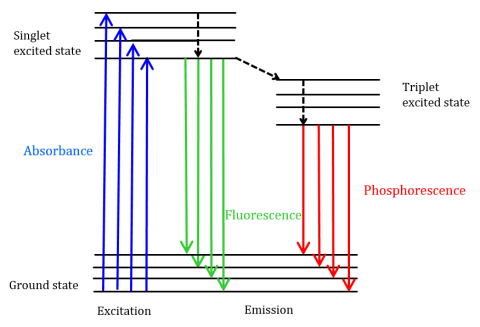
cząsteczki fluorescencyjne mogą również podlegać trzem metodom relaksacji nieradiacyjnej, w których energia wzbudzenia nie jest przekształcana w fotony: (1) Konwersja wewnętrzna, (2) Konwersja zewnętrzna i (3) krzyżowanie międzysystemowe. Konwersja wewnętrzna zachodzi wtedy, gdy pomiędzy dwoma stanami elektronowymi występuje stosunkowo mała przepaść energetyczna, A elektrony przechodzą z wyższego stanu elektronowego do stanu o niższej energii. Tutaj energia jest przekazywana do wibracyjnych trybów stanu elektronicznego. Ponieważ procesy wibracyjne są napędzane termicznie, wzrost temperatury prowadzi do zmniejszenia intensywności fluorescencji. W zewnętrznej konwersji energia jest tracona przez kolizyjne hartowanie z rozpuszczonymi cząsteczkami w środowisku fluoroforu. Intersystem crossing powstaje, gdy poziomy wibracyjne stanów wzbudzonych singleta i trypleta nakładają się na energię i elektrony przechodzą od najniższego stanu wzbudzonego singleta do pierwszego stanu wzbudzonego trypleta. Fotony emitowane po powrocie do stanu podstawowego są znane jako fosforescencja (ryc. 1). Stan tryplet jest niższy w energii niż stan singletowy więc piki fosforescencji znajdują się przy dłuższych długościach fal niż fluorescencji. Ponieważ te przejścia są również zabronione, fosforescencja wykazuje dłuższą żywotność (~10-4 – 102 sekundy) w porównaniu z fluorescencją (~10-9 – 10-6 sekund). Dłuższe okresy życia prowadzą również do dezaktywacji termicznej poprzez hartowanie tlenem, ruch rozpuszczalnika i kolizję międzycząsteczkową, więc fosforescencji zazwyczaj nie można zaobserwować w temperaturze pokojowej, a próbki muszą być zatem chłodzone w temperaturze ciekłego azotu.
prawo Beera i efekty koncentracji
podczas gdy absorpcja zachodzi w czasie krótszym niż 10-15 sekund, proces relaksacji ze stanu wzbudzonego do stanu podstawowego jest znacznie wolniejszy. Dlatego fluorescencja może dostarczać informacji na temat interakcji fluoroforów z otaczającymi cząsteczkami i rozpuszczalnikami, w przeciwieństwie do absorpcji.
intensywność fluorescencji jest wprost proporcjonalna do natężenia światła wzbudzenia
F = 2,303 * K * I0 * ebc
gdzie k jest stałą opartą na geometrii instrumentu, I0 jest intensywnością światła wzbudzenia, e jest molową absorpcją fluoroforu, b jest długością ścieżki, A c jest stężeniem. Ponieważ intensywność fluorescencji nie jest ratyfikowana do natężenia światła padającego, jak przy pomiarach absorpcji, czułość fluorescencji jest znacznie większa, ponieważ nie jest ograniczona przez zdolność instrumentów do rozróżniania incydentu i wykrytych intensywności. W związku z tym do pomiarów wymagane są mniejsze stężenia.
powyższe równanie jest liniowe tylko wtedy, gdy absorbancja próbki jest mniejsza niż 0,05 AU. Jeśli próbka jest zbyt skoncentrowana, światło emisyjne może zostać ponownie wchłonięte przez fluorofor, tłumiąc sygnał fluorescencji przy krótszych długościach fal. Światło wzbudzające może również nie w pełni przeniknąć przez pełną szerokość wysoce skoncentrowanej próbki, co również doprowadzi do zmniejszenia intensywności fluorescencji.
Oprzyrządowanie do spektroskopii fluorescencyjnej
charakterystyka widma fluorescencyjnego
Fluorometry składają się z monochromatora wzbudzenia i emisji, umożliwiającego użytkownikom uzyskanie zarówno widma wzbudzenia, jak i widma emisji. Pomiar wykonywany przez fluorometr jest unikalny dla monochromatorów wzbudzenia i emisji poszczególnych przyrządów. Fluorescencja jest bezpośrednio związana z strumieniem świetlnym i wydajnością pomiaru, a zatem zależy od konstrukcji instrumentu i komponentów, takich jak Źródło światła, Optyka monochromacyjna i lampa fotopowielacza. Każde źródło światła będzie miało inną widmową moc wyjściową (zarówno kształt, jak i moc), która będzie się zmieniać i zmniejszać w czasie życia źródła.
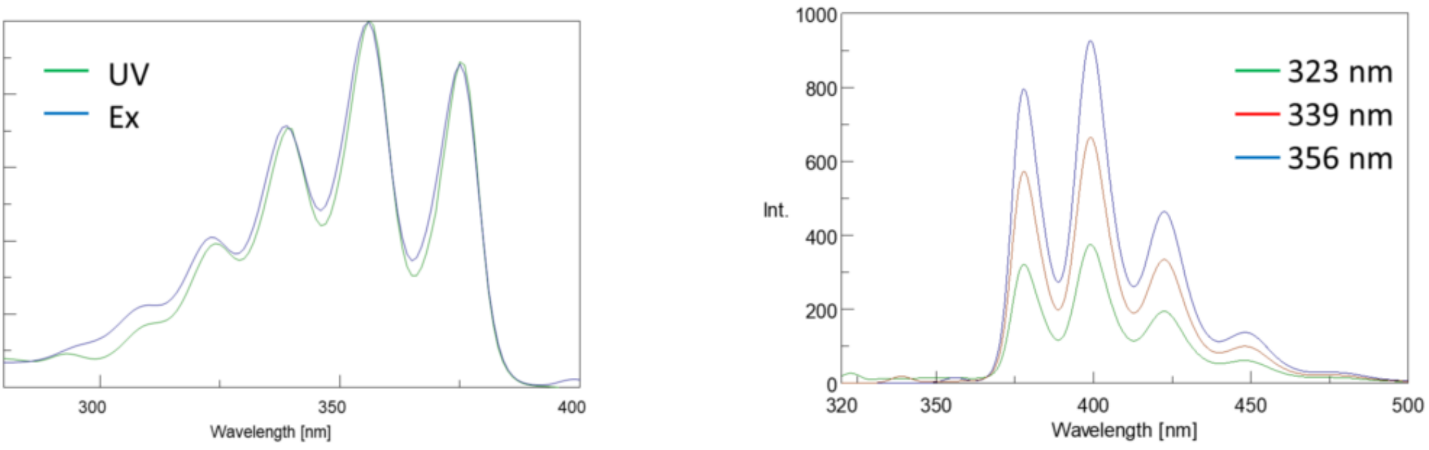
widma wzbudzenia wyznaczają intensywność przy stałej długości fali emisji, zmieniając jednocześnie długości fal wzbudzenia. Ponieważ większość widm emisyjnych jest niezależna od długości fali wzbudzenia, widma wzbudzenia są często duplikatami widma absorpcji fluoroforu.
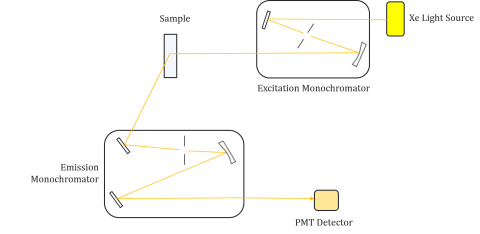
odwrotnie, widmo emisyjne wykreśla intensywność przy stałej długości fali wzbudzenia podczas skanowania przez różne długości fal emisji. Te skany emisji dostarczają informacji na temat struktury molekularnej fluoroforu i otaczającego go środowiska lokalnego. Ponieważ emisja fluorescencji zawsze występuje od najniższego stanu wzbudzonego do stanu podstawowego, kształt widma emisji jest niezależny od długości fali wzbudzenia. Więcej energii jest również wymagane do wzbudzenia cząsteczki z ziemi do stanu wzbudzonego, co powoduje piki emisyjne przy dłuższych długościach fal (tj. mniejszych energiach) niż odpowiadające im długości fal wzbudzenia. Ta różnica energii między falami wzbudzenia i emisji jest znana jako przesunięcie Stokesa.
ponadto widma absorpcji i emisji są często lustrzanymi odbiciami siebie nawzajem ze względu na równy rozkład poziomów energii drgań stanów wzbudzonych i ziemskich (ryc. 3). Zasada Francka-Condona wyjaśnia, że ponieważ jądra są stosunkowo duże, a elektroniczne Przejście zaangażowane w emisję i absorpcję zachodzi w tak szybkich skalach czasowych, nie ma czasu na poruszanie się jąder i poziomy energii drgań, a zatem pozostają mniej więcej takie same w całym elektronicznym przejściu.
widmowa Szerokość pasma
ponieważ intensywność fluorescencji jest proporcjonalna do natężenia światła wejściowego, ilość światła przepuszczanego przez monochromator znacznie wpłynie na intensywność. Suma Szerokości pasma wzbudzenia i emisji powinna wynosić około pasma widmowego (SBW) monitorowanego piku, aby wszystkie piki były dobrze rozdzielone. Tak długo, jak ta zasada jest przestrzegana, przepustowość pasma może być otwarta w celu zwiększenia przepustowości światła dla próbek o niskiej fluorescencji. SBW może być również wpływ przesunięcie Stokes fluorophore. Węższe przesunięcia Stokes może ograniczyć zakres dopuszczalnych SBW, które mogą być używane.
artefakty fluorescencji
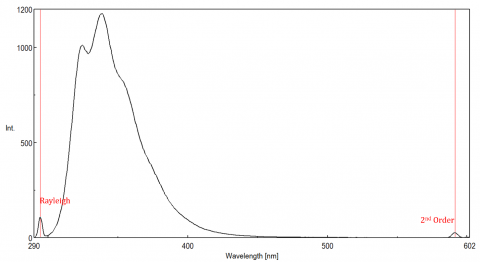
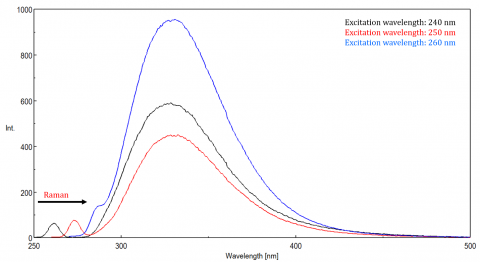
światło rozproszone może powodować artefakty, zniekształcając widmo fluorescencji. Trzy najczęstsze rodzaje rozproszenia widoczne w fluorescencji są Rayleigh, drugiego rzędu i Raman rozproszenia (Rysunek 3). Rozpraszanie Rayleigha jest rozproszonym światłem wzbudzenia, a zatem szczytami przy długości fali wzbudzenia. Rozpraszanie drugiego rzędu to rozpraszanie wyższego rzędu obserwowane przy dwukrotnej długości fali wzbudzenia. Rozpraszanie Ramana jest rozpraszaniem nieelastycznym z powodu rozpuszczalników i pików o ustalonej energii z długości fali wzbudzenia. Aby odróżnić rozpraszanie Ramana od piku fluorescencji, długość fali wzbudzenia może być zmieniana w krokach od 5 do 10 nm, a jeśli pik, o którym mowa, przesuwa się wraz z długością fali wzbudzenia i zmniejsza intensywność, to ten pik jest spowodowany rozpraszaniem Ramana. Można również sprawdzić, czy pik znajduje się w pustym spektrum rozpuszczalnika. Jeśli tak, to jest szansa, że jest to Raman peak. Jeśli szczyt fluorescencji jest zbyt blisko lub nakładających się z albo Raman lub Rayleigh rozproszenia, pasma i / lub wzbudzenia długość fali może być regulowana, aby przesunąć rozpraszanie od szczytu fluorescencji. Efekty te są najbardziej widoczne dla bardzo niskich stężeń fluoroforu, a zwłaszcza wysoce rozpraszających roztworów, takich jak białka, mikrosfery, nanocząstki, jak również ciał stałych.
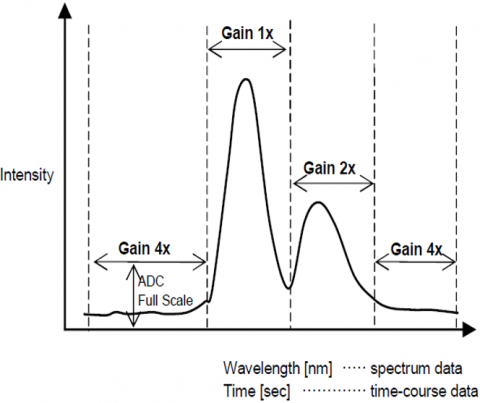
Zakres Dynamiki
funkcja automatycznej regulacji wzmocnienia automatycznie dostosowuje wzmocnienie sygnału z detektora na podstawie intensywności fluorescencji. Optymalizuje to sygnał do szumu w całym skanowanym zakresie dla pomiarów spektralnych lub czasowych, dzięki czemu piki o różnych intensywnościach są automatycznie dostosowywane w celu poprawy S/N i zapewnienia dokładności wyników.
automatyczny system kontroli czułości (SCS)
automatyczny system kontroli czułości(SCS) rozszerza zakres dynamiczny wykrytego sygnału fluorescencji, automatycznie dostosowując napięcie detektora zgodnie z intensywnością fluorescencji. Pozwala to na stałe długości fali lub ilościowe analizy pomiarów sub-pikomolar do mikromolar stężenia bez ręcznej zmiany instrumentu.

Rysunek 5. Krzywa kalibracji roztworów fluoresceiny od 5·10-13 do 1,5·10-6 M przy użyciu funkcji auto-SCS.
zastosowania spektroskopii fluorescencyjnej
anizotropia
anizotropia fluorescencji jest obserwowana, gdy fluorofor emituje światło o różnej intensywności w zależności od osi polaryzacji i jest opisana następującym równaniem
r=Ivv-GIvh/Ivv+2givh
gdzie jest równoległa intensywność emisji do płaszczyzny wzbudzenia i jest natężeniem emisji prostopadłym do płaszczyzny wzbudzenia. G jest nazywany współczynnikiem G lub współczynnikiem kraty instrumentu i odpowiada za zależność polaryzacji monochromatora emisji.
wszystkie fluorofory mają momenty przejściowe, które występują wzdłuż określonych kierunków wzdłuż osi molekularnej. Po wystawieniu na działanie światła spolaryzowanego, losowo zorientowane fluorofory, które mają swoje momenty przejścia absorpcji zorientowane wokół kąta padającego światła, będą wzbudzone, a ta populacja stanu wzbudzonego jest częściowo zorientowana. Gdy cząsteczka powraca ze stanu wzbudzonego z powrotem do stanu podstawowego, ładunek elektronu jest redystrybuowany, a zmiana orientacji momentów dipolowych wpływa na polaryzację wzbudzenia i emisji. Na przykład, gdy fluorescencja jest emitowana przed obróceniem cząsteczki, światło fluorescencyjne będzie silnie spolaryzowane w kierunku polaryzacji światła wzbudzenia. Jeśli światło jest emitowane po obrocie cząsteczki w całkowicie losowym kierunku, fluorescencja nie będzie już spolaryzowana.
podczas pomiaru anizotropii fluorescencji następujące czynniki wpływają na ruch cząsteczkowy: (1) wielkość molekularna, (2) lepkość środowiska cząsteczki oraz (3) siła i stopnie swobody związanej cząsteczki. Pomiary anizotropii określają średnie przesunięcie kątowe fluoroforu, które występuje między absorpcją a emisją fotonu. Przesunięcie kątowe zależy od szybkości i zakresu dyfuzji obrotowej w czasie trwania stanu wzbudzonego. Kiedy fluorofor jest nieograniczony i może swobodnie obracać się przed ponowną emisją fotonu, szybkość dyfuzji jest na ogół szybsza niż szybkość emisji, a anizotropia jest w przybliżeniu równa zero. Dyfuzja rotacyjna zmienia kierunek momentu przejścia, który depolaryzuje emisję. Im bardziej ograniczony fluorofor, tym większa będzie wartość anizotropii, ponieważ spadek elastyczności zmniejszy ogólną szybkość rotacji.
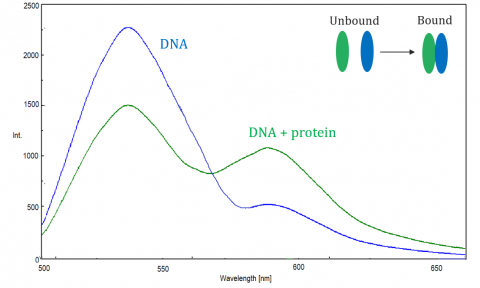
FRET
fluorescencyjny rezonansowy transfer energii (FRET) jest mechanizmem regulującym transfer energii między dwiema sąsiednimi cząsteczkami. Dawca, początkowo w stanie wzbudzonym, może przenosić energię do cząsteczki akceptora poprzez nieradiacyjny rezonans elektronowy.
FRET jest monitorowany przez spektrofluorometr, który mierzy fluorescencję/hartowanie akceptora lub wzbudzonego dawcy. Wydajność progu zależy od następujących czynników: odległość między dawcą i akceptorem, nakładanie się spektralne między dawcą i akceptorem oraz wyrównanie ich momentów dipolowych. Sprawność jest odwrotnie proporcjonalna do szóstej potęgi odległości między dawcą a akceptorem, co czyni technikę niezwykle wrażliwą na niewielkie zmiany odległości. Gdy obszar nakładania się spektrum fluorescencji dawcy i spektrum absorpcji akceptora jest większy, wydajność progu jest wyższa. Wydajność progu jest również na maksimum, gdy dwa momenty dipolowe są równoległe lub anty-równoległe do siebie, i nie ma transferu energii występuje, gdy momenty dipolowe są prostopadłe do siebie. Zazwyczaj, gdy odległość między dawcą i akceptorem jest betwen1 i 10 nm, FRET występuje.
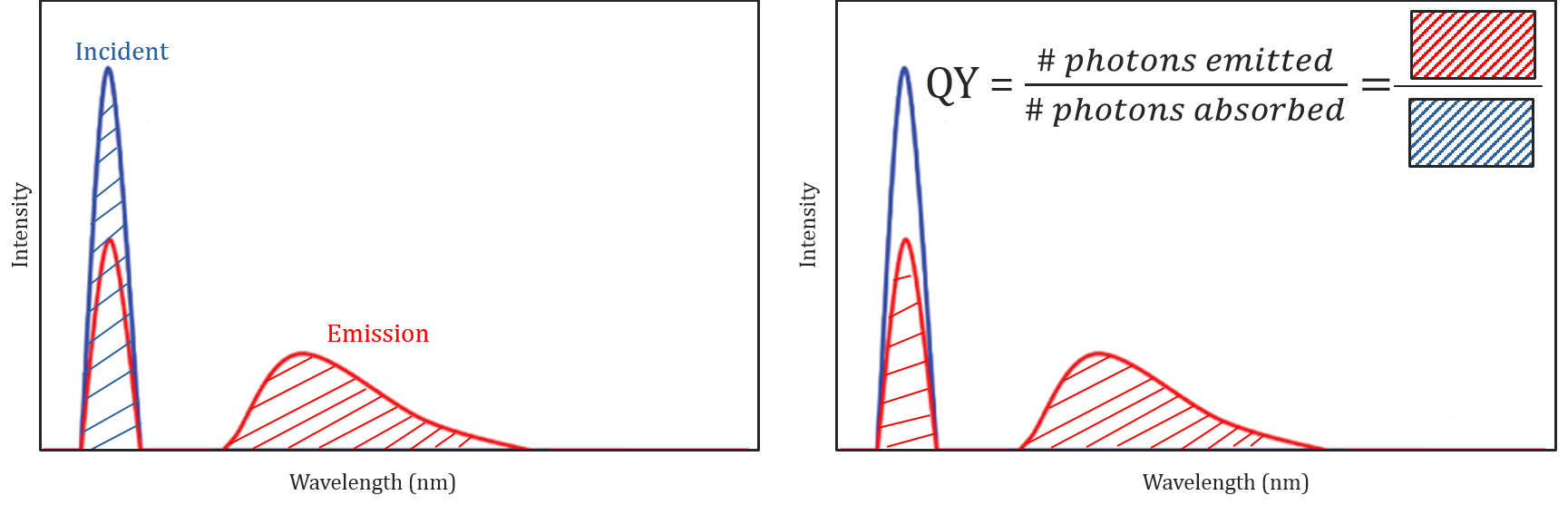
wydajność kwantowa i korekta spektralna
różne warunki molekularne i środowiskowe nie tylko wpływają na to, czy cząsteczka będzie fluoryzować, czy nie, ale mogą również określić intensywność lub wydajność kwantową emitowanego promieniowania fluorescencyjnego. Wydajność cząsteczki do fluorescencji jest opisana przez jej wydajność kwantową i jest zdefiniowana jako stosunek liczby fotonów pochłoniętych do liczby fotonów emitowanych przez próbkę.
w niektórych przypadkach konieczne jest określenie dokładnego pomiaru spektralnego. Odbywa się to za pomocą odniesień do znanych skalibrowanych materiałów. Skalibrowane źródła, które są używane, są sprawdzane pod kątem absolutnego wyjścia widmowego na znanym instrumencie, a widmo referencyjne jest dostarczane w celu skorygowania indywidualnego instrumentu dostarczonego klientowi. Aby Korekcja spektralna działała skutecznie, musi być wykonywana dla każdego parametru przyrządu i kombinacji Szerokości pasma, tak aby Korekcja spektralna przy szerokości pasma widmowego 5 nm nie mogła być zastosowana do pomiaru przy użyciu SBW 10 nm. Dotyczy to położenia polaryzatorów, jeśli są one używane, a także stosowania filtrów wyższego rzędu. Konieczne jest przeprowadzenie korekcji widmowej dla każdej kombinacji widmowych Szerokości pasma, które mają być używane przez Klienta, w celu włączenia lub wyłączenia wyboru filtra wyższego rzędu oraz dla pozycji polaryzatorów, jeśli są zamontowane. Fale wzbudzenia próbki i emisji określą, jakie rozwiązanie / źródło światła jest używane do kalibracji.
bliskiej podczerwieni
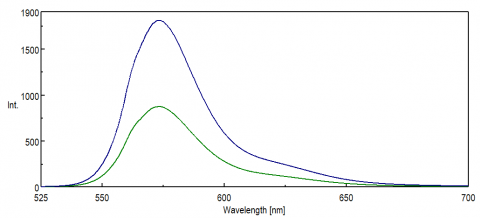
w przypadku aplikacji sondujących region NIR widma, odpowiedź spektralna detektora PMT ma kluczowe znaczenie dla uzyskania danych. Na czerwonym końcu widocznego obszaru, do NIR, wydajność kwantowa PMT znacznie się zmniejsza, co powoduje niewielkie lub żadne natężenie sygnału podczas pomiarów próbki. Eksperymenty FRET i barwniki NIR i sondy są często monitorowane przy długościach fal powyżej 500 nm iw wielu przypadkach mają małe sygnały, nawet dla tak wrażliwej techniki jak fluorescencja. 8 ilustruje różnicę w intensywności fluorescencji rodaminy B przy użyciu standardowego PMT w porównaniu z PMT, który jest bardziej wrażliwy na długości fal na czerwonym końcu widma.
Technika Uzupełniająca:
Spektroskopia Dichroizmu kołowego
Spektroskopia Dichroizmu kołowego (CD) jest niezbędną techniką analityczną stosowaną do analizy chiralności cząsteczek poprzez ich aktywność optyczną. CD może być stosowany do szerokiej gamy struktur molekularnych, ale znalazł przychylność w środowisku naukowym dla wyjaśnienia struktury makromolekularnej, zwłaszcza białek i kwasów nukleinowych.