tilsætningen af en kulhydratdel til et proteinmolekyle kaldes protein glycosylering. Det er en almindelig posttranslationel modifikation for proteinmolekyler involveret i cellemembrandannelse. Under denne proces sætter bindingen af monosaccharidenheder til aminosyrekæderne scenen for en række reaktioner, der fører til dannelsen af glycoproteiner (n og o-bundne oligosaccharider, der findes til en proteinenhed). I alle 16 kendte tegn formodes at formidle denne reaktion. Et typisk glycoprotein har mindst 41 bindinger, der involverer 8 aminosyrer og 13 forskellige monosaccharidenheder og inkluderer glycophosphatidylinositol (GPI) og phosphoglycosyl-bindinger. Protein glycosylering hjælper med korrekt foldning af proteiner, stabilitet og i celle til celle vedhæftning, der ofte kræves af celler i immunsystemet. De vigtigste steder for proteinglykosylering i kroppen er er, Golgi krop, kerne og cellevæsken.
Protein glycosylering kan kategoriseres i to hovedtyper:
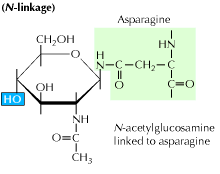 a) N-bundet glycosylering: det begynder med tilsætning af en 14-sukker forløber til en asparagin aminosyre. Det indeholder glucose, mannose og N-acetylglucosamin molekyler. Denne enhed overføres derefter til ER lumen. En af de mest almindelige årsager til oligosaccharidkæden er aspargin, der forekommer i tripeptidsekvensen, Asn-Ser eller Asn-HS-Thr. Det kan være en hvilken som helst anden aminosyre end prolin. Den oligosaccharidbundne proteinsekvens foldes nu korrekt og translokeres nu til Golgi-kroppen, hvor mannoseresten fjernes.
a) N-bundet glycosylering: det begynder med tilsætning af en 14-sukker forløber til en asparagin aminosyre. Det indeholder glucose, mannose og N-acetylglucosamin molekyler. Denne enhed overføres derefter til ER lumen. En af de mest almindelige årsager til oligosaccharidkæden er aspargin, der forekommer i tripeptidsekvensen, Asn-Ser eller Asn-HS-Thr. Det kan være en hvilken som helst anden aminosyre end prolin. Den oligosaccharidbundne proteinsekvens foldes nu korrekt og translokeres nu til Golgi-kroppen, hvor mannoseresten fjernes.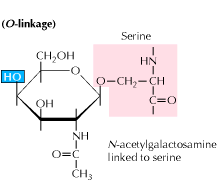
b) O-bundet glycosylering: glycosylering begynder med en medieret tilsætning af N-acetyl-galactosamin efterfulgt af andre kulhydrater til serin-eller threoninrester. Undersøgelser afslører, at O-bundet glycosylering forekommer på et senere tidspunkt i proteinforarbejdning.