Espectroscopia de Fluorescência
espectroscopia de Fluorescência é rotineiramente utilizada para o estudo de mudanças estruturais nos sistemas conjugados, as moléculas aromáticas, e rígida, plana, compostos devido a alterações de temperatura, pH, força iônica, solvente, e ligantes. Um único fluoróforo pode gerar milhares de fotões detectáveis que podem ser repetidamente excitados e detectados, fazendo espectroscopia de fluorescência é uma técnica altamente sensível.Fluorescência é um tipo de emissão radiativa que ocorre quando uma molécula absorve energia em um comprimento de onda onde tem um momento dipolar de transição. A energia de excitação fornecida à molécula no estado do solo promove fótons para um estado de singlet excitado, onde eles então decaem para o nível de energia vibracional mais baixo desse estado de singlet excitado. Esta energia relaxa ainda mais de volta ao estado do solo da molécula, emitindo fótons no processo, como mostrado na Figura 1.
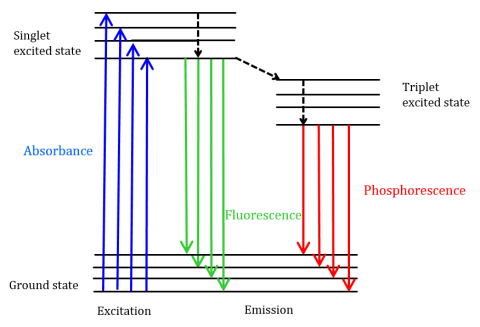
moléculas Fluorescentes também podem se submeter existem três métodos de nonradiative de relaxamento, onde a energia de excitação não é convertida em fótons: (1) conversão interna, (2) conversão externo, e (3) intersystem travessia. A conversão interna ocorre quando há uma diferença de energia relativamente pequena entre dois estados eletrônicos e os elétrons transitam de um estado eletrônico mais elevado para um estado de menor energia. Aqui a energia é transferida para os modos vibracionais do estado eletrônico. Uma vez que os processos vibracionais são conduzidos termicamente, o aumento da temperatura leva à diminuição da intensidade de fluorescência. Na conversão externa, a energia é perdida através da extinção colisional com moléculas de soluto no ambiente do fluoróforo. O cruzamento entre sistemas surge quando os níveis vibracionais dos Estados Unidos e tripleto se sobrepõem em energia e os elétrons transitam do estado mais baixo para o primeiro estado tripleto excitado. Os fótons emitidos à medida que regressam ao estado do solo são conhecidos como fosforescência (Figura 1). O estado tripleto é menor em energia do que o estado singlet assim picos de fosforescência são encontrados em comprimentos de onda mais longos do que a fluorescência. Uma vez que estas transições também são proibidas, a fosforescência exibe uma vida útil mais longa (~10-4 – 102 segundos) em comparação com a fluorescência (~10-9 – 10-6 segundos). As vidas mais longas também levam à desativação térmica por meio de extinção do oxigênio, movimento do solvente e colisão intermolecular, de modo que a fosforescência tipicamente não pode ser observada à temperatura ambiente e as amostras devem, portanto, ser refrigeradas à temperatura do nitrogênio líquido.
lei e efeitos de concentração de Beer
enquanto a absorção ocorre na escala de tempo de menos de 10-15 segundos, o processo de relaxamento do estado excitado para o solo é muito mais lento. Portanto, a fluorescência pode fornecer informações sobre as interações de fluoróforos com moléculas e solventes circundantes, ao contrário da absorção.
intensidade de Fluorescência é diretamente proporcional à intensidade de luz de excitação
F=2.303 * K * I0 * ebc
onde K é uma constante com base no instrumento de geometria, I0 é a intensidade da luz de excitação, e é o fluoróforo da absortividade molar, b é o pathlength, e c é a concentração. Uma vez que a intensidade de fluorescência não é ratificada à intensidade de luz incidente como com as medições de absorção, a sensibilidade de fluorescência é muito maior porque não é limitada pela capacidade dos instrumentos para diferenciar entre as intensidades incidentes e detectadas. Consequentemente, são necessárias concentrações mais pequenas para as medições.
a equação acima é apenas linear quando a absorvância da amostra é inferior a 0,05 UA. Se uma amostra estiver muito concentrada, a luz de emissão pode ser reabsorvida pelo fluoróforo, atenuando o sinal de fluorescência em comprimentos de onda mais curtos. A luz de excitação também pode não penetrar totalmente na largura total de uma amostra altamente concentrada, o que também levará a uma diminuição das intensidades de fluorescência.
instrumentação da espectroscopia de fluorescência
características de um espectro de fluorescência
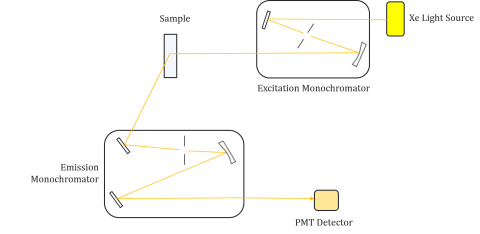
Fluorómetros são compostos por um monocromador de excitação e emissão, permitindo aos utilizadores obter espectros de excitação e emissão. Uma medição feita por um fluorómetro é única para os monocromadores de excitação e emissão de cada instrumento. A fluorescência está directamente relacionada com o fluxo luminoso e a eficiência da medição, pelo que depende da concepção do instrumento e dos componentes, tais como a fonte luminosa, a óptica monocromática e o tubo fotomultiplicador. Cada fonte de luz terá uma saída espectral diferente (forma e potência) que irá variar e diminuir ao longo da vida da fonte.
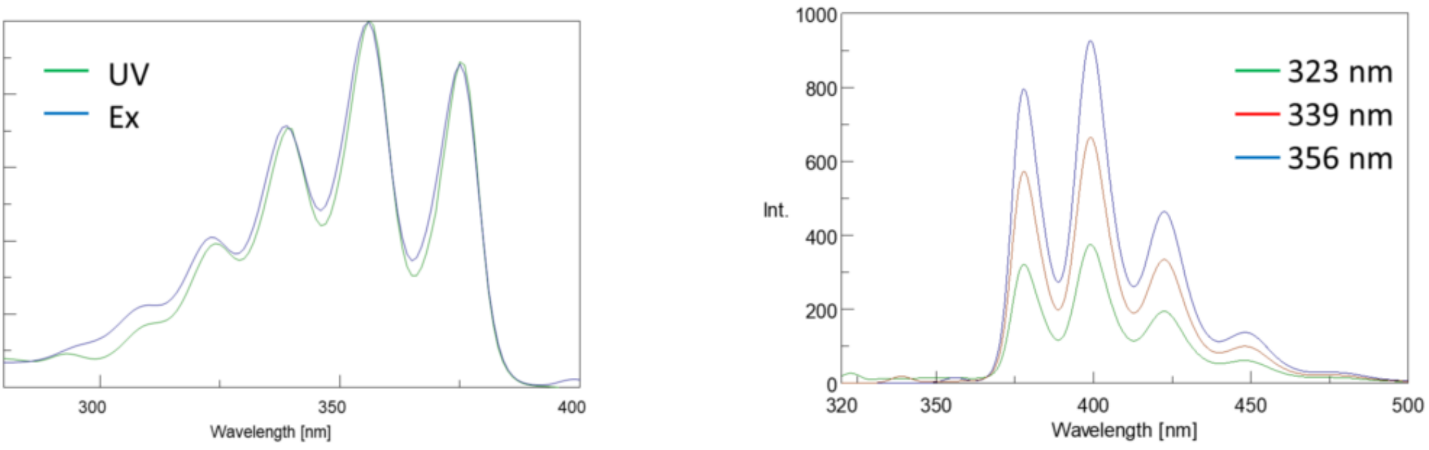
espectros de excitação traçam a intensidade num comprimento de onda de emissão fixo, variando os comprimentos de onda de excitação. Como a maioria dos espectros de emissão são independentes do comprimento de onda de excitação, os espectros de excitação são frequentemente duplicados do espectro de Absorção Do fluoróforo.
inversamente, um espectro de emissão traça a intensidade em um comprimento de onda de excitação fixo enquanto digitaliza através de diferentes comprimentos de onda de emissão. Estas análises de emissões fornecem informações sobre a estrutura molecular do fluoróforo e o ambiente local que o rodeia. Uma vez que a emissão de fluorescência sempre ocorre do estado mais baixo excitado ao estado do solo, a forma do espectro de emissão é independente do comprimento de onda de excitação. Mais energia também é necessária para excitar uma molécula do solo para o estado excitado, resultando em picos de emissão em comprimentos de onda mais longos (ou seja, energias menores) do que seus comprimentos de onda de excitação correspondentes. Esta diferença de energia entre os comprimentos de onda de excitação e emissão é conhecida como o deslocamento de Stokes.
além disso, os espectros de absorção e emissão são frequentemente imagens espelhadas umas das outras devido à distribuição igual entre os níveis de energia vibracional dos estados excitados e do solo (Figura 3). O princípio Franck-Condon explica que como os núcleos são relativamente grandes e a transição eletrônica envolvida na emissão e absorção ocorre em escalas de tempo tão rápidas, não há tempo para os núcleos se moverem e os níveis de energia vibracional e, portanto, permanecem aproximadamente os mesmos durante a transição eletrônica.
largura de banda espectral
uma vez que a intensidade de fluorescência é proporcional à intensidade da luz de entrada, a quantidade de luz que passa através do monocromador irá afectar grandemente a intensidade. A soma das larguras de banda de excitação e emissão deve ser sobre a largura de banda espectral (SBW) do pico que está sendo monitorado para que todos os picos sejam bem resolvidos. Enquanto esta regra de ouro for seguida, as larguras de banda podem ser abertas para aumentar a quantidade de fluxo de luz para amostras com baixa fluorescência. O SBW também pode ser impactado pela mudança de Stokes do fluoróforo. Mudanças de Stokes mais estreitas podem limitar a gama de SBWs aceitáveis que podem ser utilizados.
artefatos de fluorescência
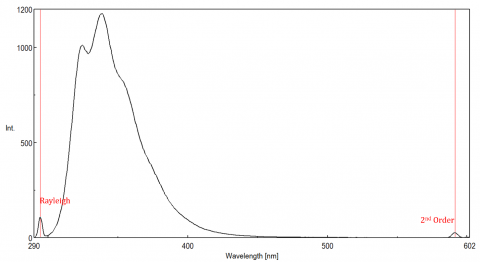
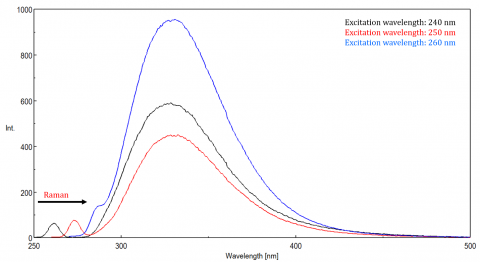
a luz dispersa pode dar origem a artefatos, distorcendo o espectro de fluorescência. Os três tipos mais comuns de dispersão vistos em fluorescência são Rayleigh, 2ª ordem, e Raman scatter (Figura 3). A dispersão de Rayleigh é a luz de excitação dispersa e, portanto, picos no comprimento de onda de excitação. Dispersão de 2ª ordem é dispersão de maior ordem observada no dobro do comprimento de onda de excitação. Espalhamento de Raman é dispersão inelástica devido a solventes e Picos em uma energia fixa do comprimento de onda de excitação. Para diferenciar o espalhamento de Raman de um pico de fluorescência, o comprimento de onda de excitação pode ser variado em incrementos de 5 a 10 nm e se o pico em questão muda com o comprimento de onda de excitação e diminui de intensidade, então esse pico, é devido à dispersão de Raman. Você também pode verificar se o pico está no espectro de solvente branco. Se for, há uma hipótese de ser um pico Raman. Se o pico de fluorescência estiver muito próximo ou se sobrepor com a dispersão de Raman ou Rayleigh, as larguras de banda e/ou o comprimento de onda de excitação podem ser ajustados para desviar a dispersão do Pico de fluorescência. Estes efeitos são mais proeminentes para concentrações muito baixas de fluoróforos e especialmente soluções de alta dispersão, como proteínas, microesfera, nanopartículas, bem como sólidos.
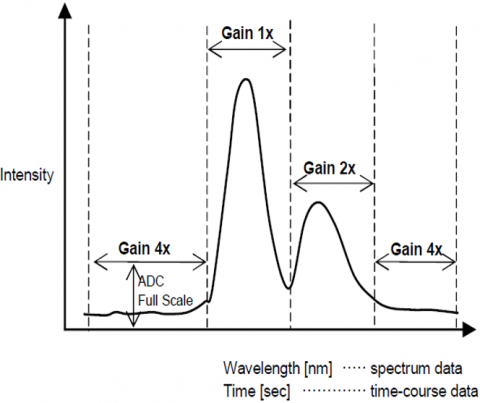
gama dinâmica
a função de controlo automático ajusta automaticamente o ganho de um sinal do detector com base na intensidade de fluorescência. Isso otimiza o sinal ao ruído em toda a gama de scanned para medições espectrais ou de curso de tempo, de modo que picos com diferentes intensidades são automaticamente ajustados para melhorar o S/N e garantir a precisão do resultado.
sistema de controlo automático de sensibilidade (SCS)
o sistema de controlo automático de sensibilidade(SCS) expande a gama dinâmica do sinal de fluorescência detectado ajustando automaticamente a tensão do detector de acordo com a intensidade de fluorescência. Isto permite medições de comprimento de onda fixo ou análises quantitativas de concentrações sub-picomolares a micromolares sem alterar manualmente o instrumento.Curva de calibração das soluções de fluoresceína de 5·10-13 a 1, 5·10-6 M utilizando a função auto-SCS.
Figura 5. Curva de calibração das soluções de fluoresceína de 5·10-13 a 1, 5·10-6 M utilizando a função auto-SCS.
Aplicações da Espectroscopia de Fluorescência
Anisotropia
anisotropia de Fluorescência é observado quando um fluoróforo emite luz de diferentes intensidades, dependendo os eixos de polarização e é descrito pela seguinte equação
r=Ivv-GIvh/Ivv+2GIvh
onde é a intensidade de emissão em paralelo para a excitação do avião e é a intensidade de emissão perpendicular à excitação de avião. G é chamado de fator G ou fator de grade de instrumento e é responsável pela dependência da polarização do monocromador de emissão.
todos os fluoróforos têm momentos de transição que ocorrem ao longo de direcções específicas ao longo do eixo molecular. Quando expostos à luz polarizada, os fluoróforos de orientação aleatória que têm os seus momentos de transição de absorção orientados em torno do ângulo da luz incidente serão excitados e esta população de Estado excitada será parcialmente orientada. Como uma molécula retorna de um estado excitado de volta ao seu estado de solo, a carga de elétrons é redistribuída e a mudança na orientação dos momentos dipolares efetua as polarizações de excitação e emissão. Por exemplo, quando a fluorescência é emitida antes de uma molécula rodar, a luz de fluorescência será fortemente polarizada em direção à direção da polarização da luz de excitação. Se a luz é emitida após a rotação da molécula em uma direção completamente aleatória, a fluorescência não será mais polarizada.
ao medir a anisotropia de fluorescência, os seguintes factores irão afectar o movimento molecular: (1) tamanho molecular, (2) viscosidade do ambiente da molécula e (3) resistência e graus de liberdade de uma molécula ligada. As medições de anisotropia determinam o deslocamento angular médio de um fluoróforo que ocorre entre a absorção e a emissão de um fóton. O deslocamento angular é dependente da taxa e extensão da difusão rotacional durante a vida do estado excitado. Quando um fluoróforo é irrestrito e permitido rodar livremente antes de re-emitir um fóton, a taxa de difusão é geralmente mais rápida do que a taxa de emissão e a anisotropia é aproximadamente igual a zero. A difusão rotacional muda a direção do momento de transição que despolariza a emissão. Quanto mais restrito for o fluoróforo, maior será o valor da anisotropia, uma vez que a diminuição da flexibilidade diminuirá a taxa global de rotação.
FRET
a transferência de energia de ressonância de fluorescência (FRET) é um mecanismo que rege a transferência de energia entre duas moléculas vizinhas. Um doador, inicialmente em seu estado excitado, pode transferir energia para uma molécula aceitadora através de ressonância eletrônica não radiativa.
FRET é monitorizado pelo espectrofluorómetro, que mede a fluorescência/atenuação do aceitador ou dador excitado. A eficiência de FRET depende dos seguintes fatores: a distância entre o DOADOR e o aceitador, a sobreposição espectral entre o DOADOR e o aceitador, e o alinhamento de seus momentos dipolo. A eficiência é inversamente proporcional à sexta potência da distância entre o DOADOR e o aceitador, tornando a técnica extremamente sensível a pequenas mudanças na distância. Quando a área de sobreposição do espectro de fluorescência do dador e do espectro de Absorção Do aceitador é maior, a eficiência do FRET é maior. A eficiência da traste também está no máximo quando os dois momentos dipolos são paralelos ou anti-paralelos um ao outro, e nenhuma transferência de energia ocorre quando os momentos dipolos são perpendiculares um ao outro. Tipicamente, quando a distância entre o DOADOR e aceitador é betwen 1 e 10 nm, FRET ocorre.
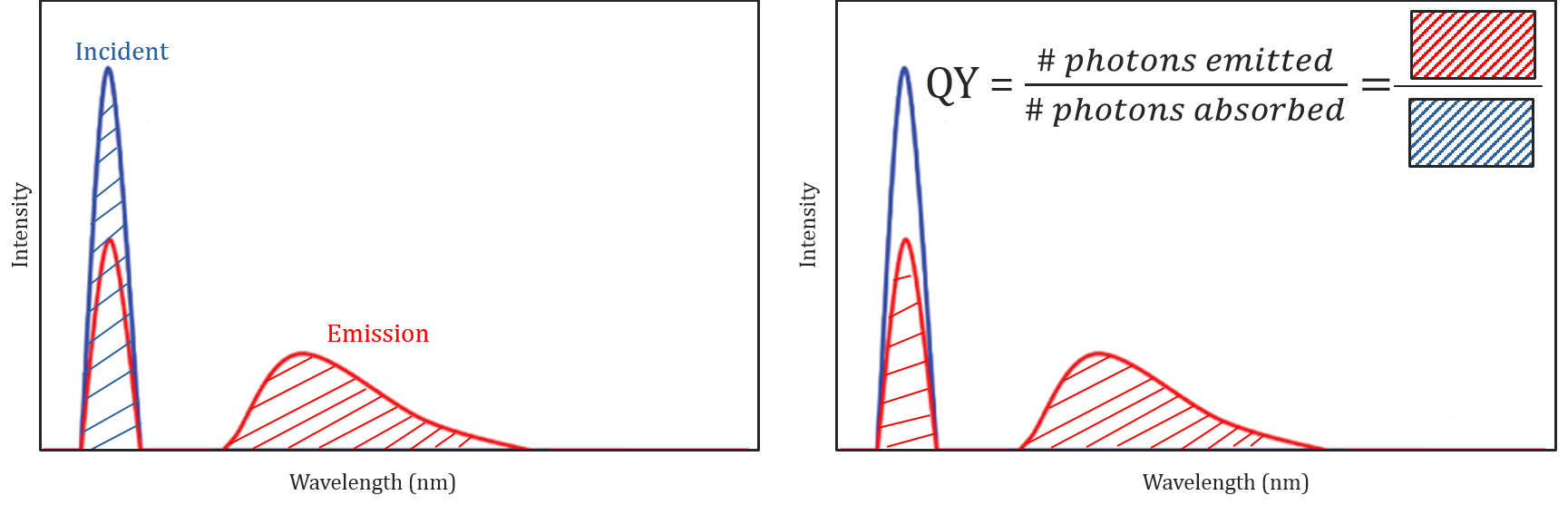
Rendimento Quântico e Correção Espectral
molecular Diferente e condições ambientais, não somente o efeito se uma molécula vai brilham ou não, mas também pode determinar a intensidade ou o rendimento quântico da fluorescência emitida radiação. A eficiência de uma molécula em relação à fluorescência é descrita pelo seu rendimento quântico e é definida como a razão entre o número de fótons absorvidos e o número de fótons emitidos pela amostra.
em alguns casos é necessário determinar a medição espectral precisa. Isto é feito usando referências a materiais calibrados conhecidos. As fontes calibradas que são usadas são verificadas para a saída espectral absoluta em um instrumento conhecido e um espectro de referência é fornecido para corrigir o instrumento individual fornecido ao cliente. Para que a correção espectral funcione efetivamente, ela tem que ser realizada em cada parâmetro de instrumento e combinações de largura de banda, de modo que a correção espectral a uma largura de banda espectral de 5 nm não pode ser aplicada à medição usando um SBW de 10 nm. Isto se aplica à posição dos polarizadores se eles estão sendo usados, bem como o uso de filtros de ordem superior. É necessário realizar a correção espectral para cada combinação de larguras espectrais a serem usadas pelo cliente, para a inclusão ou exclusão da seleção de filtros de ordem superior, e para as posições dos polarizadores se instalados. Os comprimentos de onda da excitação da amostra e das emissões determinarão a solução/fonte de luz utilizada para a calibração.
Near-Infrared
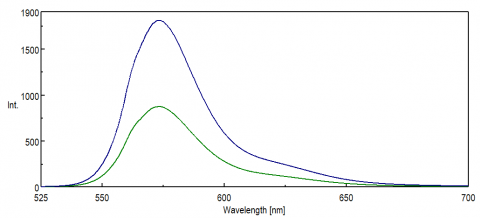
For applications probing the NIR region of the spectrum, the spectral response of the PMT detector is critical for obtaining data. Na extremidade vermelha da região visível, no NIR, a eficiência quântica da TPM diminui significativamente, resultando em pouca ou nenhuma intensidade de sinal durante as medições da amostra. Experimentos com FRET e corantes NIR e sondas são frequentemente monitorados em comprimentos de onda acima de 500 nm e em muitos casos têm pequenos sinais, mesmo para uma técnica tão sensível como a fluorescência. A figura 8 ilustra a diferença na intensidade de fluorescência da rodamina B utilizando uma TPM padrão comparada com uma TPM que é mais sensível a comprimentos de onda na extremidade vermelha do espectro.
Técnica Complementar:
espectroscopia de Dicroismo Circular
espectroscopia de dicroismo Circular (CD) é uma técnica analítica essencial usada para analisar a quiralidade em moléculas através de sua atividade óptica. CD pode ser aplicado a uma grande variedade de estruturas moleculares, mas tem encontrado favor na comunidade científica para a elucidação da estrutura macromolecular, especialmente proteínas e ácidos nucleicos.