Spectroscopia de fluorescență
spectroscopia de fluorescență este utilizată în mod obișnuit pentru studierea modificărilor structurale ale sistemelor conjugate, moleculelor aromatice și compușilor rigizi, plane datorită modificărilor temperaturii, pH-ului, rezistenței ionice, solventului și liganzilor. Un singur fluorofor poate genera mii de fotoni detectabili care pot fi excitați și detectați în mod repetat, ceea ce face ca spectroscopia de fluorescență să fie o tehnică extrem de sensibilă.
fluorescența este un tip de emisie radiativă care apare atunci când o moleculă absoarbe energia la o lungime de undă unde are un moment dipol de tranziție. Energia de excitație furnizată moleculei la starea de bază promovează fotonii într-o stare de singlet excitat, unde apoi se descompun la cel mai scăzut nivel de energie vibrațională al acestei stări de singlet excitat. Această energie se relaxează în continuare înapoi la starea de bază a moleculei, emițând fotoni în proces, așa cum se arată în Figura 1.
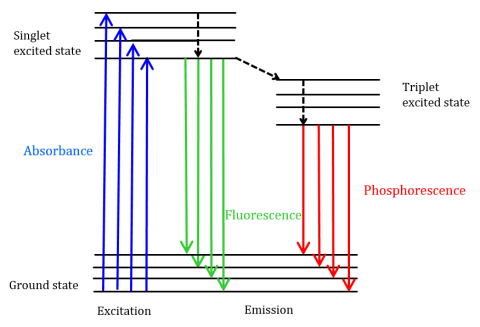
moleculele fluorescente pot suferi, de asemenea, există trei metode de relaxare nonradiativă în care energia de excitație nu este transformată în fotoni: (1) conversie internă, (2) conversie externă și (3) intersistem trecere. Conversia internă are loc atunci când există un decalaj energetic relativ mic între două stări electronice și tranziția electronilor de la o stare electronică mai mare la una de energie mai mică. Aici energia este transferată în modurile vibraționale ale stării electronice. Deoarece procesele vibraționale sunt conduse termic, creșterea temperaturii duce la scăderea intensității fluorescenței. În conversia externă, energia se pierde prin stingerea colizională cu molecule dizolvate în mediul fluoroforului. Trecerea intersistemului apare atunci când nivelurile vibraționale ale stărilor excitate de singlet și triplet se suprapun în energie, iar electronii trec de la cea mai mică stare excitată de singlet la prima stare tripletă excitată. Fotonii emiși pe măsură ce se întorc înapoi la starea de bază este cunoscută sub numele de fosforescență (Figura 1). Starea tripletă este mai mică în energie decât starea singlet, astfel încât vârfurile de fosforescență se găsesc la lungimi de undă mai mari decât fluorescența. Deoarece aceste tranziții sunt, de asemenea, interzise, fosforescența prezintă o durată de viață mai lungă (~10-4 – 102 secunde) comparativ cu fluorescența (~10-9 – 10-6 secunde). Durata de viață mai lungă Duce, de asemenea, la dezactivarea termică prin stingerea oxigenului, mișcarea solventului și coliziunea intermoleculară, astfel încât fosforescența nu poate fi observată de obicei la temperatura camerei și, prin urmare, probele trebuie răcite la temperatura azotului lichid.
Legea berii și efectele de concentrare
în timp ce absorbția are loc pe o perioadă de timp mai mică de 10-15 secunde, procesul de relaxare de la starea excitată la starea de bază este mult mai lent. Prin urmare, fluorescența poate furniza informații despre interacțiunile fluoroforilor cu moleculele și solvenții din jur, spre deosebire de absorbție.
intensitatea fluorescenței este direct proporțională cu intensitatea luminii de excitație
F=2.303 * K * I0 * ebc
unde K este o constantă bazată pe geometria instrumentului, I0 este intensitatea luminii de excitație, e este absorbția molară a fluoroforului, b este lungimea căii și c este concentrația. Deoarece intensitatea fluorescenței nu este raportată la intensitatea luminii incidente ca în cazul măsurătorilor de absorbție, sensibilitatea fluorescenței este mult mai mare, deoarece nu este limitată de capacitatea instrumentelor de a diferenția între intensitățile incidente și cele detectate. În consecință, pentru măsurători sunt necesare concentrații mai mici.
ecuația de mai sus este liniară numai atunci când absorbanța eșantionului este mai mică de 0,05 UA. Dacă o probă este prea concentrată, lumina de emisie poate fi reabsorbită de fluorofor, atenuând semnalul de fluorescență la lungimi de undă mai scurte. Lumina de excitație poate, de asemenea, să nu pătrundă complet pe întreaga lățime a unei probe foarte concentrate, ceea ce va duce, de asemenea, la scăderea intensităților de fluorescență.
instrumentarea spectroscopiei de fluorescență
caracteristicile unui spectru de fluorescență
Fluorometrele sunt compuse dintr-un monocromator de excitație și emisie, permițând utilizatorilor să obțină atât spectre de excitație, cât și de emisie. O măsurare efectuată de un fluorometru este unică pentru monocromatoarele de excitație și emisie ale instrumentului individual. Fluorescența este direct legată de fluxul luminos și de eficiența măsurării și, prin urmare, depinde de designul instrumentului și de componente precum sursa de lumină, optica monocromatorului și tubul fotomultiplicator. Fiecare sursă de lumină va avea o ieșire spectrală diferită (atât forma, cât și puterea), care va varia și va scădea pe durata de viață a sursei.
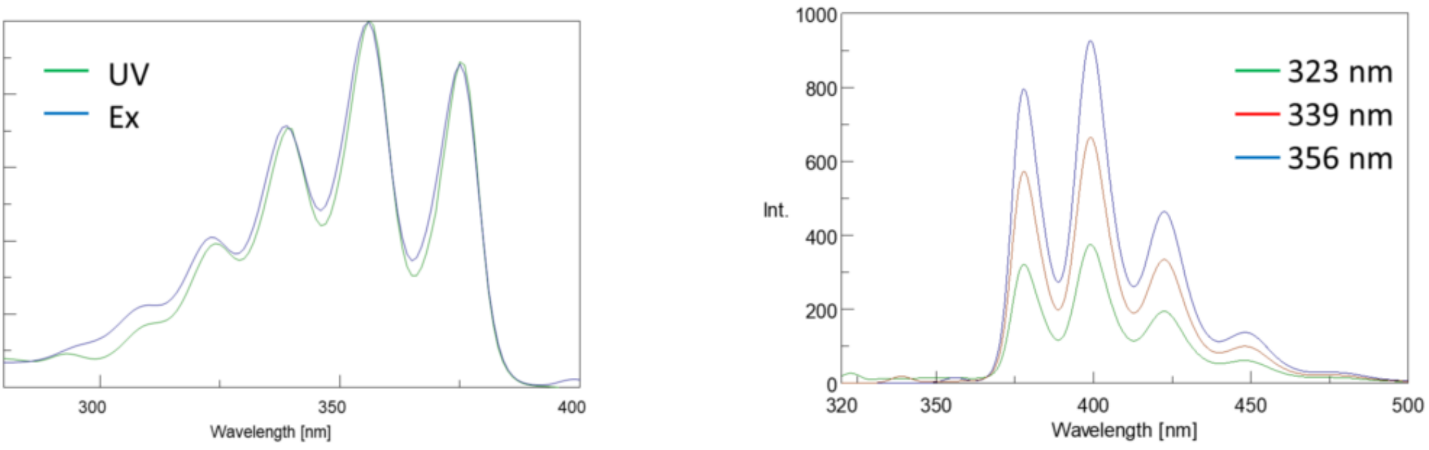
spectrele de excitație trasează intensitatea la o lungime de undă de emisie fixă în timp ce variază lungimile de undă de excitație. Deoarece majoritatea spectrelor de emisie sunt independente de lungimea de undă de excitație, spectrele de excitație sunt frecvent duplicate ale spectrului de absorbție al fluoroforului.
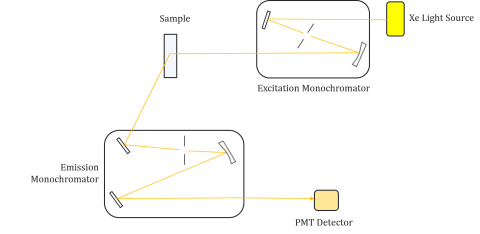
invers, un spectru de emisie trasează intensitatea la o lungime de undă de excitație fixă în timp ce scanează prin diferite lungimi de undă de emisie. Aceste scanări de emisie oferă informații despre structura moleculară a fluoroforului și mediul local care îl înconjoară. Deoarece emisia de fluorescență apare întotdeauna de la cea mai mică stare excitată la starea de bază, forma spectrului de emisie este independentă de lungimea de undă de excitație. De asemenea, este necesară mai multă energie pentru a excita o moleculă de la sol la starea excitată, rezultând vârfuri de emisie la lungimi de undă mai lungi (adică energii mai mici) decât lungimile de undă de excitație corespunzătoare. Această diferență de energie între lungimile de undă de excitație și emisie este cunoscută sub numele de schimbarea Stokes.
în plus, spectrele de absorbție și emisie sunt frecvent imagini în oglindă unele cu altele datorită distribuției egale între nivelurile de energie vibrațională ale stărilor excitate și cele de la sol (Figura 3). Principiul Franck-Condon explică faptul că, deoarece nucleele sunt relativ mari și tranziția electronică implicată în emisie și absorbție are loc pe intervale de timp atât de rapide, nu există timp pentru ca nucleele să se miște și nivelurile de energie vibrațională și, prin urmare, rămân aproximativ aceleași pe tot parcursul tranziției electronice.
lățime de bandă spectrală
deoarece intensitatea fluorescenței este proporțională cu intensitatea luminii de intrare, cantitatea de lumină trecută prin monocromator va afecta foarte mult intensitatea. Suma lățimilor de bandă de excitație și emisie ar trebui să fie aproximativ lățimea de bandă spectrală (SBW) a vârfului monitorizat, astfel încât toate vârfurile să fie bine rezolvate. Atâta timp cât se respectă această regulă generală, lățimile de bandă pot fi deschise pentru a crește cantitatea de transfer de lumină pentru probele cu fluorescență scăzută. SBW poate fi, de asemenea, afectat de schimbarea Stokes a fluoroforului. Schimbările Stokes mai înguste pot limita gama de SBWs acceptabile care pot fi utilizate.
artefacte fluorescente
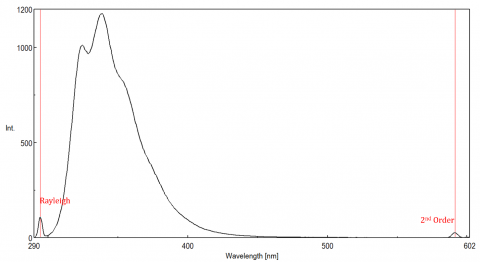
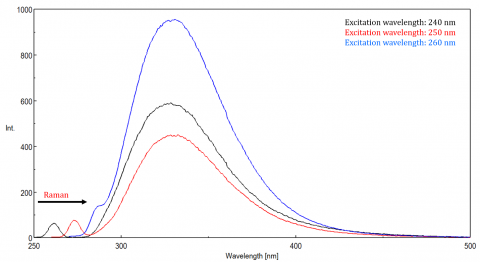
lumina împrăștiată poate da naștere unor artefacte, distorsionând spectrul fluorescenței. Cele mai frecvente trei tipuri de dispersie observate în fluorescență sunt Rayleigh, ordinul 2, și Raman scatter (Figura 3). Împrăștierea Rayleigh este lumina de excitație împrăștiată și, prin urmare, vârfuri la lungimea de undă de excitație. Scatter de ordinul 2 este scatter de ordin superior observat la dublul lungimii de undă a excitației. Împrăștierea Raman este împrăștiere inelastică datorită solvenților și vârfurilor la o energie fixă de la lungimea de undă de excitație. Pentru a diferenția împrăștierea Raman de un vârf de fluorescență, lungimea de undă de excitație poate fi variată în trepte de 5 până la 10 nm și dacă vârful în cauză se schimbă cu lungimea de undă de excitație și scade în intensitate, atunci acel vârf se datorează împrăștierii Raman. De asemenea, puteți verifica dacă vârful se află în spectrul de solvent gol. Dacă este, există o șansă să fie un vârf Raman. Dacă vârful fluorescenței este prea aproape sau se suprapune fie cu împrăștierea Raman, fie cu Rayleigh, lățimile de bandă și/sau lungimea de undă de excitație pot fi ajustate pentru a deplasa împrăștierea de pe vârful fluorescenței. Aceste efecte sunt cele mai proeminente pentru concentrații foarte scăzute de fluorofori și, în special, soluții foarte dispersate, cum ar fi proteine, microsferă, nanoparticule, precum și solide.
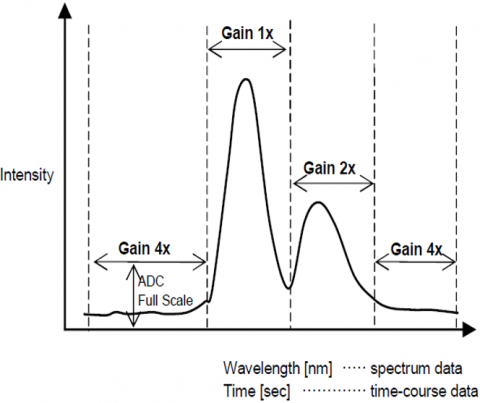
interval dinamic
funcția de control automat al câștigului reglează automat câștigul unui semnal de la detector pe baza intensității fluorescenței. Acest lucru optimizează semnalul la zgomot pe întreaga gamă scanată pentru măsurători spectrale sau de timp, astfel încât vârfurile cu intensități diferite să fie ajustate automat pentru a îmbunătăți S/N și pentru a asigura precizia rezultatului.
sistem automat de control al sensibilității (SCS)
sistemul automat de control al sensibilității(SCS) extinde intervalul dinamic al semnalului de fluorescență detectat prin reglarea automată a tensiunii detectorului în funcție de intensitatea fluorescenței. Acest lucru permite lungimi de undă fixe sau analize cantitative măsurători ale concentrațiilor sub-picomolare la micromolare fără a schimba manual instrumentul.

Figura 5. Curba de calibrare a soluțiilor de fluoresceină de la 5 * 10-13 la 1,5 * 10-6 m utilizând funcția auto-SCS.
aplicații ale spectroscopiei de fluorescență
anizotropie
anizotropie de fluorescență se observă atunci când un fluorofor emite lumină de intensități diferite în funcție de axele de polarizare și este descris de următoarea ecuație
r=Ivv-GIvh/Ivv+2givh
unde este intensitatea emisiei paralelă cu planul de excitație și este intensitatea emisiei perpendiculară pe planul de excitație. G se numește factorul G sau factorul de grătare a instrumentului și explică dependența de polarizare a monocromatorului de emisie.
toți fluoroforii au momente de tranziție care apar de-a lungul direcțiilor specifice de-a lungul axei moleculare. Când sunt expuși la lumina polarizată, fluoroforii orientați aleatoriu care au momentele lor de tranziție de absorbție orientate în jurul unghiului luminii incidente vor fi excitați și această populație de stare excitată este parțial orientată. Pe măsură ce o moleculă se întoarce de la o stare excitată înapoi la starea sa de bază, sarcina electronică este redistribuită și schimbarea orientării momentelor dipol afectează polarizările de excitație și emisie. De exemplu, atunci când fluorescența este emisă înainte ca o moleculă să se rotească, lumina fluorescentă va fi puternic polarizată spre direcția polarizării luminii de excitație. Dacă lumina este emisă după rotația moleculei într-o direcție complet aleatorie, fluorescența nu va mai fi polarizată.
la măsurarea anizotropiei fluorescenței, următorii factori vor afecta mișcarea moleculară: (1) Dimensiunea moleculară, (2) vâscozitatea mediului moleculei și (3) rezistența și gradele de libertate ale unei molecule legate. Măsurătorile anizotropiei determină deplasarea unghiulară medie a unui fluorofor care are loc între absorbția și emisia unui foton. Deplasarea unghiulară depinde de viteza și amploarea difuziei de rotație pe durata de viață a stării excitate. Când un fluorofor este nerestricționat și este lăsat să se rotească liber înainte de a emite din nou un foton, rata de difuzie este în general mai rapidă decât rata emisiei și anizotropia este aproximativ egală cu zero. Difuzia rotativă modifică direcția momentului de tranziție care depolarizează emisia. Cu cât fluoroforul este mai restricționat, cu atât valoarea anizotropiei va fi mai mare, deoarece scăderea flexibilității va scădea rata globală de rotație.
FRET
transferul de energie prin rezonanță fluorescentă (FRET) este un mecanism care guvernează transferul de energie între două molecule vecine. Un donator, inițial în starea sa excitată, poate transfera energie către o moleculă acceptoare prin rezonanță electronică non-radiativă.
FRET este monitorizat de spectrofluorometru, care măsoară fluorescența/stingerea acceptorului sau a donatorului excitat. Eficiența FRET depinde de următorii factori: distanța dintre donator și acceptor, suprapunerea spectrală dintre donator și acceptor și alinierea momentelor lor dipol. Eficiența este invers proporțională cu a șasea putere a distanței dintre donator și acceptor, făcând tehnica extrem de sensibilă la mici modificări ale distanței. Când zona de suprapunere a spectrului de fluorescență donator și spectrul de absorbție acceptor este mai mare, eficiența FRET este mai mare. Eficiența toci este, de asemenea, la un maxim atunci când cele două momente dipol sunt paralele sau anti-paralele între ele, și nici un transfer de energie are loc atunci când momentele dipol sunt perpendiculare unul pe altul. De obicei, atunci când distanța dintre donator și acceptor este betwen1 și 10 nm, se produce FRET.
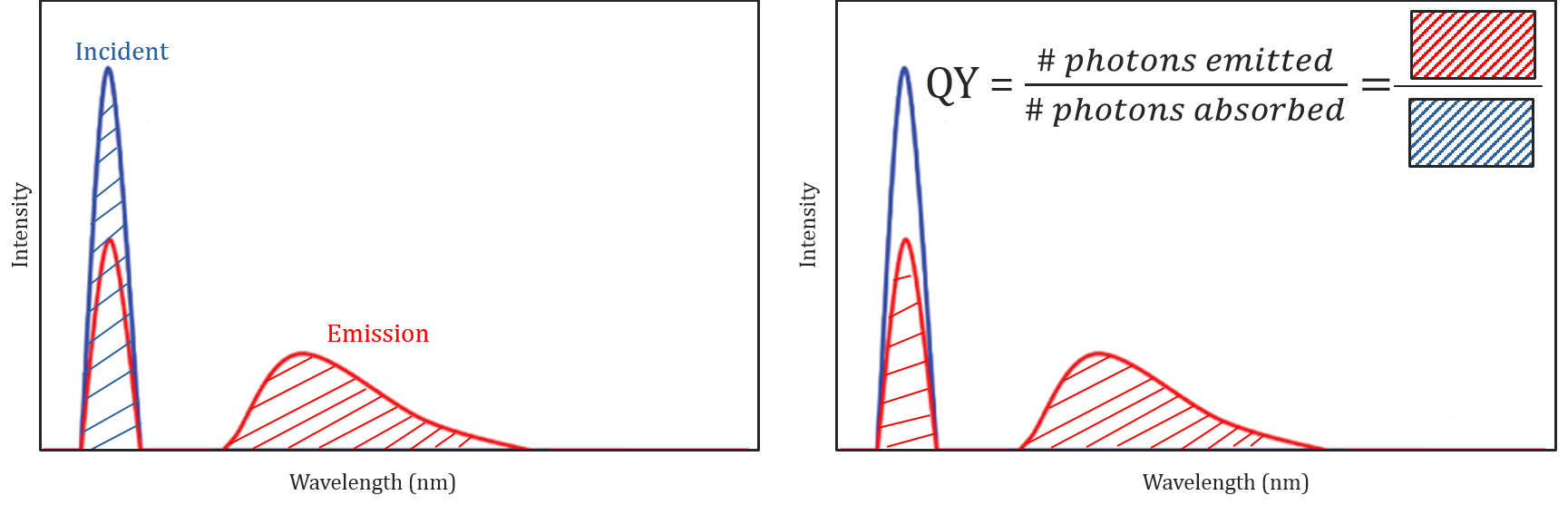
randament cuantic și corecție spectrală
diferite condiții moleculare și de mediu nu numai că afectează dacă o moleculă va fluoresce sau nu, dar poate determina și intensitatea sau randamentul cuantic al radiației fluorescente emise. Eficiența unei molecule la fluorescență este descrisă de randamentul său cuantic și este definită ca raportul dintre numărul de fotoni absorbiți și numărul de fotoni emiși de eșantion.
în unele cazuri este necesară determinarea măsurătorilor spectrale exacte. Acest lucru se face folosind referințe la materiale calibrate cunoscute. Sursele calibrate care sunt utilizate sunt verificate pentru ieșirea spectrală absolută pe un instrument cunoscut și un spectru de referință este furnizat pentru a corecta instrumentul individual furnizat clientului. Pentru ca corecția spectrală să funcționeze eficient, trebuie efectuată la fiecare parametru al instrumentului și combinații de lățime de bandă, astfel încât corecția spectrală la o lățime de bandă spectrală de 5 nm nu poate fi aplicată măsurării folosind un SBW de 10 nm. Acest lucru se aplică poziției polarizatoarelor dacă sunt utilizate, precum și utilizării filtrelor de ordin superior. Este necesar să se efectueze corecția spectrală pentru fiecare combinație de lățimi de bandă spectrale care urmează să fie utilizată de client, pentru includerea sau excluderea selecției filtrului de ordin superior și pentru pozițiile polarizatoarelor, dacă sunt montate. Excitația eșantionului și lungimile de undă de emisie vor determina ce soluție/sursă de lumină este utilizată pentru calibrare.
infraroșu apropiat
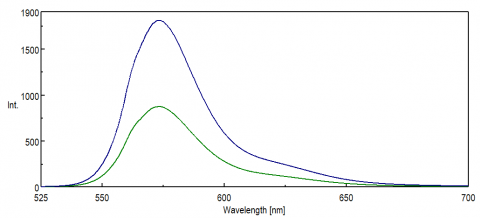
pentru aplicații care detectează Regiunea NIR a spectrului, răspunsul spectral al detectorului PMT este esențial pentru obținerea datelor. În capătul roșu al regiunii vizibile, în NIR, eficiența cuantică a PMT scade semnificativ, rezultând o intensitate mică sau deloc a semnalului în timpul măsurătorilor eșantionului. Experimentele FRET și coloranții și sondele NIR sunt frecvent monitorizate la lungimi de undă peste 500 nm și, în multe cazuri, au semnale mici, chiar și pentru o tehnică atât de sensibilă precum fluorescența. Figura 8 ilustrează diferența de intensitate a fluorescenței rodaminei B utilizând un PMT standard comparativ cu un PMT care este mai sensibil la lungimile de undă de la capătul roșu al spectrului.
Tehnica Complementară:
spectroscopia Dicroismului Circular
spectroscopia Dicroismului Circular (CD) este o tehnică analitică esențială utilizată pentru a analiza chiralitatea moleculelor prin activitatea lor optică. CD poate fi aplicat la o mare varietate de structuri moleculare, dar a găsit favoarea în comunitatea științifică pentru elucidarea structurii macromoleculare, în special a proteinelor și acizilor nucleici.