fluorescensspektroskopi
fluorescensspektroskopi används rutinmässigt för att studera strukturella förändringar i konjugerade system, aromatiska molekyler och styva, plana föreningar på grund av förändringar i temperatur, pH, jonstyrka, lösningsmedel och ligander. En enda fluorofor kan generera tusentals detekterbara fotoner som upprepade gånger kan upphetsas och detekteras, vilket gör fluorescensspektroskopi en mycket känslig teknik.
fluorescens är en typ av strålningsemission som uppstår när en molekyl absorberar energi vid en våglängd där den har ett övergångsdipolmoment. Excitationsenergin som tillhandahålls molekylen vid marktillståndet främjar fotoner till ett upphetsat singletttillstånd, där de sedan sönderfaller till den lägsta vibrationella energinivån i detta upphetsade singletttillstånd. Denna energi slappnar ytterligare tillbaka till molekylens marktillstånd och avger fotoner i processen, som visas i Figur 1.
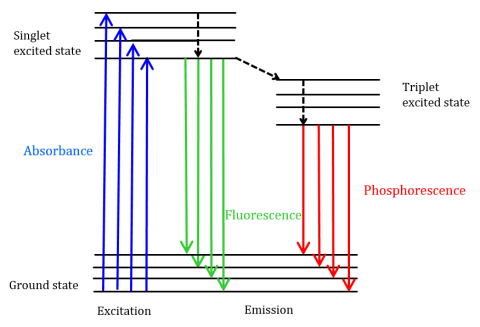
fluorescerande molekyler kan också genomgå det finns tre metoder för icke-strålningsavslappning där exciteringsenergin inte omvandlas till fotoner: (1) intern omvandling, (2) extern omvandling och (3) intersystemkorsning. Intern omvandling sker när det finns ett relativt litet energigap mellan två elektroniska tillstånd och elektronerna övergår från ett högre elektroniskt tillstånd till ett med lägre energi. Här överförs energin till det elektroniska tillståndets vibrationella lägen. Eftersom vibrationsprocesser är termiskt drivna leder ökande temperatur till minskningar av fluorescensintensiteten. Vid extern omvandling förloras energi genom kollisionssläckning med lösta molekyler i fluoroforens miljö. Intersystemkorsning uppstår när vibrationsnivåer av singlet och triplett exciterade tillstånd överlappar varandra i energi och elektroner övergång från det lägsta singlet exciterade tillståndet till det första exciterade tripletttillståndet. Fotonerna som emitteras när de återvänder tillbaka till marktillståndet kallas fosforescens (Figur 1). Tripletttillståndet är lägre i energi än singlet-tillståndet, så fosforescenstoppar finns vid längre våglängder än fluorescens. Eftersom dessa övergångar också är förbjudna uppvisar fosforescens en längre livslängd (~10-4 – 102 sekunder) jämfört med fluorescens (~10-9-10-6 sekunder). De längre livstiderna leder också till termisk deaktivering via syrehärdning, lösningsmedelsrörelse och intermolekylär kollision, så fosforescens kan vanligtvis inte observeras vid rumstemperatur och prover måste därför kylas vid flytande kvävetemperatur.
öl lag och Koncentrationseffekter
medan absorption sker på tidsskalan på mindre än 10-15 sekunder, är avslappningsprocessen från det upphetsade till marktillståndet mycket långsammare. Därför kan fluorescens ge information om en fluorophores interaktioner med omgivande molekyler och lösningsmedel, till skillnad från absorption.
Fluorescensintensiteten är direkt proportionell mot exciteringsljusintensiteten
F = 2.303 * K * I0 * ebc
där K är en konstant baserad på instrumentgeometri, I0 är intensiteten hos exciteringsljuset, e är fluoroforens molära absorptionsförmåga, b är banlängden och c är koncentrationen. Eftersom fluorescensintensiteten inte är proportionell mot den infallande ljusintensiteten som med absorptionsmätningar är fluorescenskänsligheten mycket större eftersom den inte begränsas av instrumentets förmåga att skilja mellan incidenten och detekterade intensiteter. Följaktligen krävs mindre koncentrationer för mätningar.
ovanstående ekvation är endast linjär när provabsorptionen är mindre än 0,05 AU. Om ett prov är för koncentrerat kan emissionsljuset återabsorberas av fluoroforen, vilket dämpar fluorescenssignalen vid kortare våglängder. Excitationsljus kan inte heller helt penetrera hela bredden av ett högkoncentrerat prov, vilket också leder till minskade fluorescensintensiteter.
instrumentering av fluorescensspektroskopi
egenskaper hos ett Fluorescensspektrum
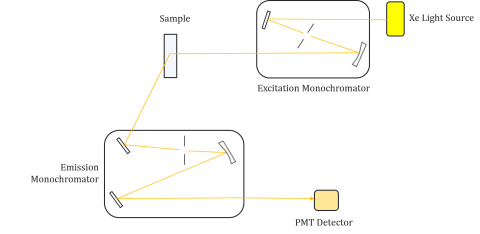
Fluorometrar består av en excitation och emissionsmonokromator, så att användarna kan erhålla både excitation och emissionsspektra. En mätning gjord av en fluorometer är unik för det enskilda instrumentets exciterings-och emissionsmonokromatorer. Fluorescens är direkt relaterad till ljusflöde och mätningseffektiviteten och beror därför på instrumentdesignen och komponenterna såsom ljuskällan, monokromatoroptiken och fotomultiplikatorröret. Varje ljuskälla kommer att ha en annan spektral utgång (både form och effekt) som kommer att variera och minska under källans livstid.
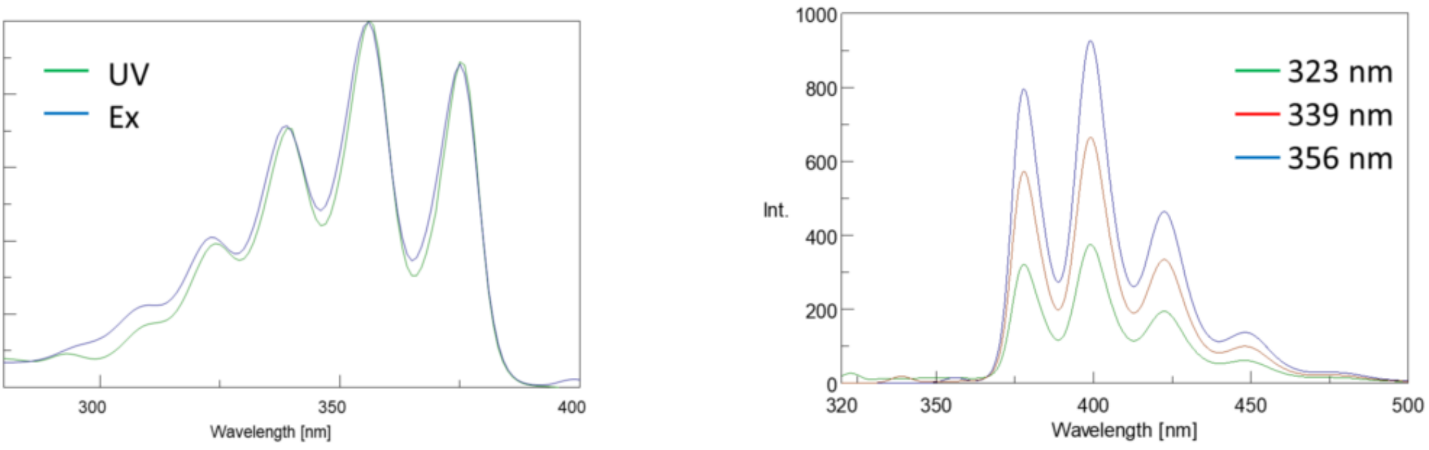
Excitationsspektra plottar intensiteten vid en fast emissionsvåglängd medan man varierar exciteringsvåglängderna. Eftersom de flesta emissionsspektra är oberoende av exciteringsvåglängden är excitationsspektra ofta dubbletter av fluoroforens absorptionsspektrum.
omvänt plottar ett emissionsspektrum intensiteten vid en fast exciteringsvåglängd medan man skannar genom varierande emissionsvåglängder. Dessa utsläppskanningar ger information om fluoroforens molekylstruktur och den lokala miljön som omger den. Eftersom fluorescensutsläppet alltid sker från det lägsta upphetsade tillståndet till marktillståndet är emissionsspektrumets form oberoende av exciteringsvåglängden. Mer energi krävs också för att excitera en molekyl från marken till det upphetsade tillståndet, vilket resulterar i utsläppstoppar vid längre våglängder (dvs mindre energier) än deras motsvarande exciteringsvåglängder. Denna skillnad i energi mellan excitation och emissionsvåglängder är känd som Stokes shift.
dessutom är absorptions-och emissionsspektra ofta spegelbilder av varandra på grund av den lika fördelningen mellan vibrationsenerginivåerna i de upphetsade och jordade tillstånden (Figur 3). Franck-Condon-principen förklarar att eftersom kärnorna är relativt stora och den elektroniska övergången som är involverad i utsläpp och absorption sker på så snabba tidsskalor, finns det ingen tid för kärnor att röra sig och vibrationsenerginivåerna och därför förblir ungefär desamma under hela den elektroniska övergången.
spektral bandbredd
eftersom fluorescensintensiteten är proportionell mot ingångsljusintensiteten, kommer mängden ljus som passerar genom monokromatorn att påverka intensiteten kraftigt. Summan av exciterings-och emissionsbandbredden bör handla om spektralbandbredden (SBW) för toppen som övervakas så att alla toppar är väl upplösta. Så länge denna tumregel följs kan bandbredderna öppnas för att öka mängden ljusflöde för prover med låg fluorescens. SBW kan också påverkas av Stokes-förskjutningen av fluoroforen. Smalare Stokes skift kan begränsa utbudet av acceptabla SBWs som kan användas.
Fluorescensartefakter
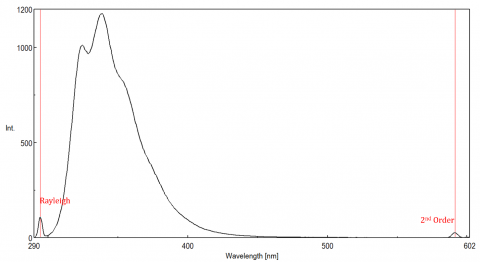
spritt ljus kan ge upphov till artefakter som snedvrider fluorescensspektrumet. De tre vanligaste typerna av scatter som ses i fluorescens är Rayleigh, 2nd order och Raman scatter (Figur 3). Rayleigh-spridning är det spridda exciteringsljuset och toppar därför vid exciteringsvåglängden. 2: a ordningens scatter är högre ordningens scatter observerad vid två gånger exciteringsvåglängden. Raman-spridning är oelastisk spridning på grund av lösningsmedel och toppar vid en fast energi från exciteringsvåglängden. För att differentiera Raman-spridning från en fluorescenstopp kan exciteringsvåglängden varieras i steg om 5 till 10 nm och om toppen i fråga skiftar med exciteringsvåglängden och minskar i intensitet, beror den toppen på Raman scatter. Du kan också kontrollera om toppen är i det tomma lösningsmedelsspektret. Om det är, det finns en chans att det är en Raman topp. Om fluorescenstoppen är för nära eller överlappar med antingen Raman-eller Rayleigh-spridningen kan bandbredderna och/eller exciteringsvåglängden justeras för att flytta spridningen från fluorescenstoppen. Dessa effekter är mest framträdande för mycket låga fluorophorekoncentrationer och särskilt mycket spridande lösningar, som proteiner, mikrosfär, nanopartiklar, såväl som fasta ämnen.
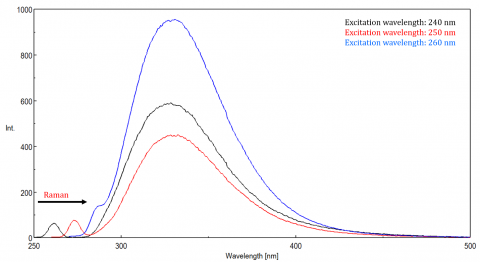
dynamiskt omfång
den automatiska Förstärkningskontrollfunktionen justerar automatiskt förstärkningen av en signal från detektorn baserat på fluorescensintensiteten. Detta optimerar signalen till brus genom hela det skannade området för spektral-eller tidskursmätningar så att toppar med olika intensiteter justeras automatiskt för att förbättra S/N och säkerställa resultatnoggrannheten.
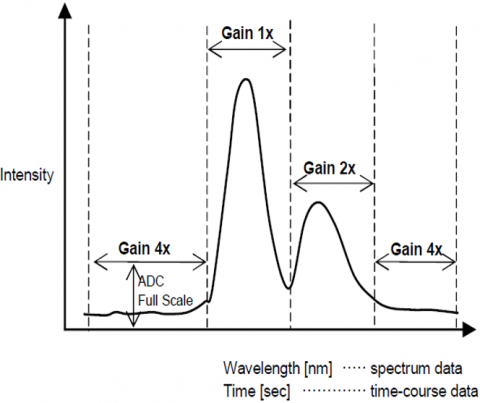
automatiskt Känslighetskontrollsystem(SCS)
det automatiska Känslighetskontrollsystemet (SCS) expanderar det dynamiska området för den detekterade fluorescenssignalen genom att automatiskt justera detektorspänningen enligt fluorescensintensiteten. Detta möjliggör fast våglängd eller kvantitativa analyser mätningar av sub-picomolar till mikromolära koncentrationer utan att manuellt ändra instrumentet.

Figur 5. Kalibreringskurva för fluoresceinlösningar från 5 * 10-13 till 1,5 * 10-6 M med hjälp av auto-SCS-funktionen.
tillämpningar av fluorescensspektroskopi
anisotropi
Fluorescensanisotropi observeras när en fluorofor avger ljus med olika intensiteter beroende på polarisationsaxlarna och beskrivs med följande ekvation
r=Ivv-GIvh/Ivv+2givh
var är emissionsintensiteten parallell med polarisationsaxlarna excitationsplan och är emissionsintensiteten vinkelrätt mot excitationsplanet. G kallas G-faktor eller instrumentgitterfaktor och står för polarisationsberoende av emissionsmonokromatorn.
alla fluoroforer har övergångsmoment som uppträder längs specifika riktningar längs molekylaxeln. När de utsätts för polariserat ljus kommer de slumpmässigt orienterade fluoroforerna som har sina absorptionsövergångsmoment orienterade runt vinkeln på det infallande ljuset att vara upphetsade och denna upphetsade tillståndspopulation är delvis orienterad. När en molekyl återvänder från ett upphetsat tillstånd tillbaka till dess marktillstånd omfördelas elektronladdningen och förändringen i orienteringen av dipolmomenten påverkar exciterings-och emissionspolarisationerna. Till exempel, när fluorescens emitteras innan en molekyl roterar, kommer fluorescensljuset att polariseras starkt mot riktningen för exciteringsljusets polarisering. Om ljuset emitteras efter molekylens rotation i en helt slumpmässig riktning, kommer fluorescensen inte längre att polariseras.
vid mätning av fluorescensanisotropi kommer följande faktorer att påverka den molekylära rörelsen: (1) molekylstorlek, (2) viskositet i molekylens miljö och (3) styrka och frihetsgrader för en bunden molekyl. Anisotropimätningar bestämmer den genomsnittliga vinkelförskjutningen av en fluorofor som uppstår mellan absorptionen och emissionen av en foton. Vinkelförskjutningen är beroende av hastigheten och omfattningen av rotationsdiffusionen under det upphetsade tillståndets livstid. När en fluorofor är obegränsad och får fritt rotera innan den avger en foton, är diffusionshastigheten i allmänhet snabbare än emissionshastigheten och anisotropin är ungefär lika med noll. Rotationsdiffusion ändrar riktningen för övergångsmomentet som depolariserar utsläppet. Ju mer begränsad fluorofor, desto större blir anisotropivärdet eftersom minskningen i flexibilitet minskar den totala rotationshastigheten.
FRET
fluorescens resonans energiöverföring (FRET) är en mekanism som styr energiöverföringen mellan två angränsande molekyler. En givare, initialt i sitt upphetsade tillstånd, kan överföra energi till en acceptormolekyl genom icke-radiativ elektronresonans.
FRET övervakas av spektrofluorometern, som mäter fluorescens/släckning av acceptor eller upphetsad givare. FRET effektivitet beror på följande faktorer: avståndet mellan givaren och acceptorn, den spektrala överlappningen mellan givaren och acceptorn och inriktningen av deras dipolmoment. Effektiviteten är omvänt proportionell mot den sjätte effekten av avståndet mellan givaren och acceptorn, vilket gör tekniken extremt känslig för små förändringar i avstånd. När överlappningsområdet för donatorfluorescensspektrumet och acceptorabsorptionsspektret är större är FRET-effektiviteten högre. FRET-effektiviteten är också maximalt när de två dipolmomenten är parallella eller antiparallella med varandra, och ingen energiöverföring sker när dipolmomenten är vinkelräta mot varandra. Vanligtvis när avståndet mellan givaren och acceptorn är mellan1 och 10 nm, uppstår FRET.
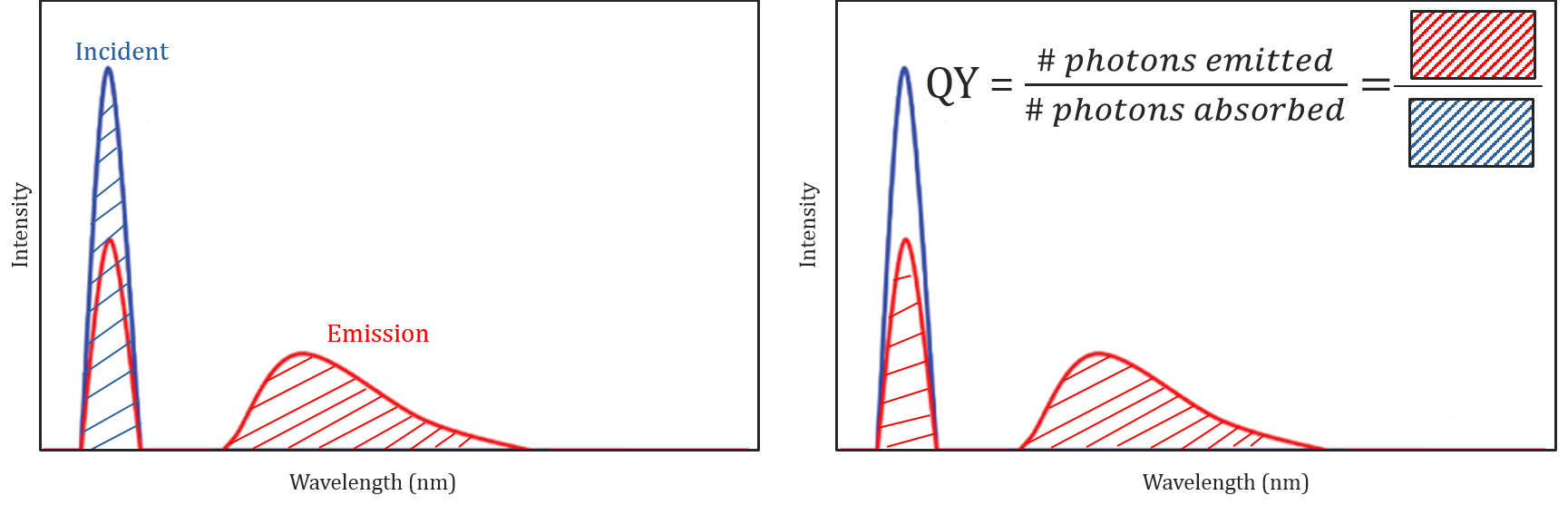
Kvantutbyte och Spektralkorrigering
olika molekylära och miljöförhållanden påverkar inte bara om en molekyl kommer att fluorescera eller inte, men kan också bestämma intensiteten eller kvantutbytet för den emitterade fluorescensstrålningen. En molekyls effektivitet att fluorescera beskrivs av dess kvantutbyte och definieras som förhållandet mellan antalet fotoner som absorberas till antalet fotoner som emitteras av provet.
i vissa fall är det nödvändigt att bestämma exakt spektralmätning. Detta görs med hjälp av referenser till kända kalibrerade material. De kalibrerade källorna som används kontrolleras för absolut spektralutgång på ett känt instrument och ett referensspektrum levereras för att korrigera det enskilda instrumentet som levereras till kunden. För att Spektralkorrigering ska fungera effektivt måste den utföras vid varje instrumentparameter och bandbreddskombinationer så att Spektralkorrigeringen vid en 5 nm spektral bandbredd inte kan tillämpas på mätning med en 10 nm SBW. Detta gäller polarisatorernas position om de används, liksom användningen av filter med högre ordning. Det är nödvändigt att utföra Spektralkorrigeringen för varje kombination av spektralbandbredder som ska användas av kunden, för inkludering eller uteslutning av filtervalet med högre ordning och för polarisatorernas positioner om de är monterade. Provets excitation och emissionsvåglängder bestämmer vilken lösning / ljuskälla som används för kalibrering.
nära infraröd
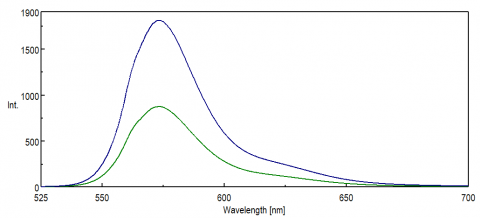
för applikationer som undersöker NIR-regionen i spektrumet är PMT-detektorns spektralrespons kritisk för att erhålla data. I den röda änden av det synliga området, in i NIR, minskar kvanteffektiviteten hos PMT signifikant, vilket resulterar i liten eller ingen signalintensitet under provmätningar. FRET experiment och Nir färgämnen och sonder övervakas ofta vid våglängder över 500 nm och i många fall har små signaler, även för en sådan känslig teknik som fluorescens. Figur 8 illustrerar skillnaden i fluorescensintensitet av rhodamin B med användning av en standard PMT jämfört med en PMT som är mer känslig för våglängder på den röda änden av spektrumet.
Kompletterande Teknik:
cirkulär Dikroismspektroskopi
cirkulär dikroismspektroskopi (CD) är en väsentlig analytisk teknik som används för att analysera kiralitet i molekyler genom deras optiska aktivitet. CD kan appliceras på en mängd olika molekylära strukturer men har funnit fördel i det vetenskapliga samfundet för att belysa makromolekylär struktur, särskilt proteiner och nukleinsyror.