Espectroscopia de fluorescencia
La espectroscopia de fluorescencia se usa rutinariamente para estudiar cambios estructurales en sistemas conjugados, moléculas aromáticas y compuestos rígidos planos debido a alteraciones en la temperatura, el pH, la fuerza iónica, el disolvente y los ligandos. Un solo fluoróforo puede generar miles de fotones detectables que se pueden excitar y detectar repetidamente, lo que hace que la espectroscopia de fluorescencia sea una técnica altamente sensible.
La fluorescencia es un tipo de emisión radiativa que ocurre cuando una molécula absorbe energía en una longitud de onda donde tiene un momento dipolar de transición. La energía de excitación proporcionada a la molécula en el estado fundamental promueve los fotones a un estado singlete excitado, donde luego se descomponen al nivel de energía vibratoria más bajo de este estado singlete excitado. Esta energía se relaja aún más al estado fundamental de la molécula, emitiendo fotones en el proceso, como se muestra en la Figura 1.
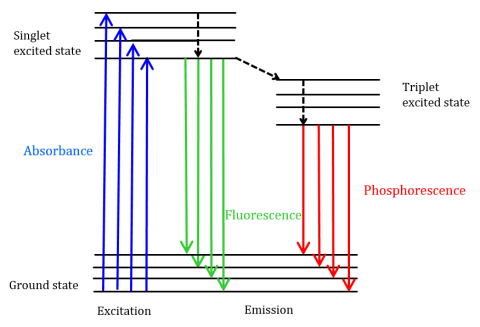
Las moléculas fluorescentes también pueden someterse a tres métodos de relajación no radiativa donde la energía de excitación no se convierte en fotones: (1) conversión interna, (2) conversión externa y (3) cruce de sistemas. La conversión interna ocurre cuando hay una brecha de energía relativamente pequeña entre dos estados electrónicos y los electrones pasan de un estado electrónico más alto a uno de menor energía. Aquí la energía se transfiere a los modos vibratorios del estado electrónico. Dado que los procesos vibratorios son impulsados térmicamente, el aumento de la temperatura conduce a disminuciones en la intensidad de la fluorescencia. En la conversión externa, la energía se pierde a través del enfriamiento por colisión con moléculas de soluto en el entorno del fluoróforo. El cruce entre sistemas surge cuando los niveles vibracionales de los estados excitados singlete y triplete se superponen en la transición de energía y electrones del estado excitado singlete más bajo al primer estado triplete excitado. Los fotones emitidos a medida que regresan al estado fundamental se conocen como fosforescencia (Figura 1). El estado triplete es más bajo en energía que el estado singlete, por lo que los picos de fosforescencia se encuentran en longitudes de onda más largas que la fluorescencia. Dado que estas transiciones también están prohibidas, la fosforescencia exhibe una vida útil más larga (~10-4 – 102 segundos) en comparación con la fluorescencia (~10-9 – 10-6 segundos). Los tiempos de vida más largos también conducen a la desactivación térmica a través de la extinción de oxígeno, el movimiento de disolventes y la colisión intermolecular, por lo que la fosforescencia generalmente no se puede observar a temperatura ambiente y, por lo tanto, las muestras deben enfriarse a temperatura de nitrógeno líquido.
La Ley de la cerveza y los Efectos de concentración
Mientras que la absorción se produce en una escala de tiempo de menos de 10-15 segundos, el proceso de relajación desde el estado excitado hasta el estado fundamental es mucho más lento. Por lo tanto, la fluorescencia puede proporcionar información sobre las interacciones de los fluoróforos con las moléculas y disolventes circundantes, a diferencia de la absorción.
La intensidad de fluorescencia es directamente proporcional a la intensidad de la luz de excitación
F=2.303 * K * I0 * ebc
donde K es una constante basada en la geometría del instrumento, I0 es la intensidad de la luz de excitación, e es la absorbencia molar del fluoróforo, b es la longitud de la trayectoria y c es la concentración. Dado que la intensidad de fluorescencia no se relaciona con la intensidad de la luz incidente como en las mediciones de absorción, la sensibilidad de fluorescencia es mucho mayor porque no está limitada por la capacidad de los instrumentos para diferenciar entre la intensidad incidente y la detectada. En consecuencia, se requieren concentraciones más pequeñas para las mediciones.
La ecuación anterior solo es lineal cuando la absorbancia de la muestra es inferior a 0,05 UA. Si una muestra está demasiado concentrada, la luz de emisión puede ser reabsorbida por el fluoróforo, atenuando la señal de fluorescencia en longitudes de onda más cortas. La luz de excitación también puede no penetrar completamente el ancho completo de una muestra altamente concentrada, lo que también conducirá a una disminución de las intensidades de fluorescencia.
Instrumentación de Espectroscopia de fluorescencia
Las características de un espectro de fluorescencia
Los fluorómetros se componen de un monocromador de excitación y emisión, lo que permite a los usuarios obtener espectros de excitación y emisión. Una medición realizada por un fluorómetro es única para los monocromadores de excitación y emisión de cada instrumento. La fluorescencia está directamente relacionada con el flujo luminoso y la eficiencia de la medición y, por lo tanto, depende del diseño del instrumento y de los componentes, como la fuente de luz, la óptica monocromática y el tubo fotomultiplicador. Cada fuente de luz tendrá una salida espectral diferente (tanto de forma como de potencia) que variará y disminuirá a lo largo de la vida útil de la fuente.
Los espectros de excitación trazan la intensidad en una longitud de onda de emisión fija mientras varían las longitudes de onda de excitación. Dado que la mayoría de los espectros de emisión son independientes de la longitud de onda de excitación, los espectros de excitación son frecuentemente duplicados del espectro de absorción del fluoróforo.
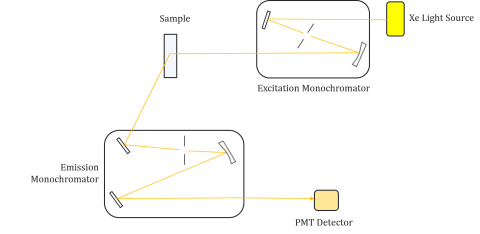
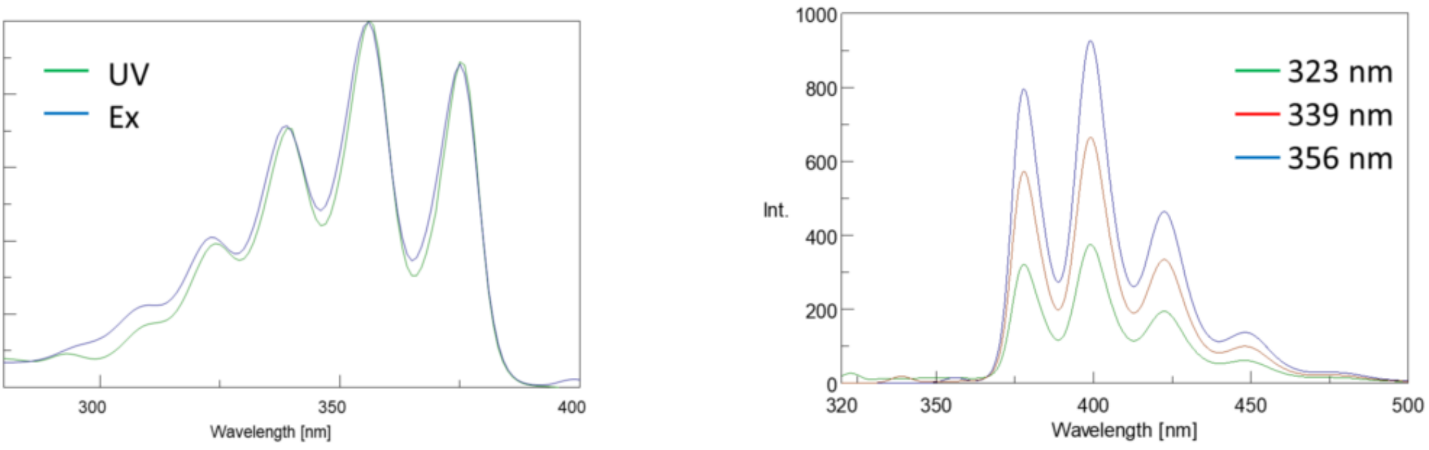
Por el contrario, un espectro de emisión traza la intensidad a una longitud de onda de excitación fija mientras escanea a través de longitudes de onda de emisión variables. Estos escaneos de emisiones proporcionan información sobre la estructura molecular del fluoróforo y el entorno local que lo rodea. Dado que la emisión de fluorescencia siempre se produce desde el estado excitado más bajo hasta el estado fundamental, la forma del espectro de emisión es independiente de la longitud de onda de excitación. También se requiere más energía para excitar una molécula desde el suelo hasta el estado excitado, lo que resulta en picos de emisión a longitudes de onda más largas (es decir, energías más pequeñas) que sus longitudes de onda de excitación correspondientes. Esta diferencia de energía entre las longitudes de onda de excitación y emisión se conoce como desplazamiento de Stokes.
Además, los espectros de absorción y emisión con frecuencia son imágenes especulares entre sí debido a la distribución equitativa entre los niveles de energía vibratoria de los estados excitado y tierra (Figura 3). El principio de Franck-Condon explica que debido a que los núcleos son relativamente grandes y la transición electrónica involucrada en la emisión y absorción ocurre en escalas de tiempo tan rápidas, no hay tiempo para que los núcleos se muevan y los niveles de energía vibratoria y, por lo tanto, permanecen aproximadamente iguales a lo largo de la transición electrónica.
Ancho de banda espectral
Dado que la intensidad de fluorescencia es proporcional a la intensidad de la luz de entrada, la cantidad de luz que pasa a través del monocromador afectará en gran medida la intensidad. La suma de los anchos de banda de excitación y emisión debe ser aproximadamente el ancho de banda espectral (SBW) del pico que se está monitoreando para que todos los picos estén bien resueltos. Siempre que se siga esta regla general, los anchos de banda se pueden abrir para aumentar la cantidad de flujo de luz para muestras con baja fluorescencia. El SBW también puede verse afectado por el desplazamiento de Stokes del fluoróforo. Los cambios de Stokes más estrechos pueden limitar el rango de SBWS aceptables que se pueden usar.
Artefactos de fluorescencia
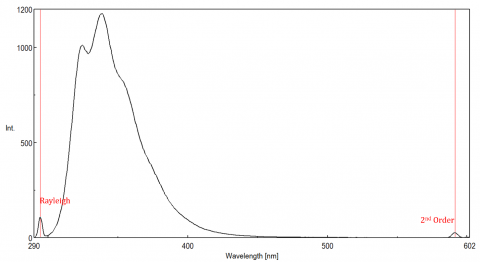
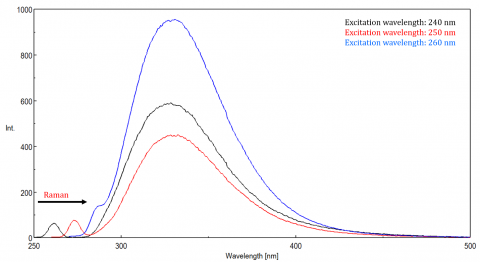
La luz dispersa puede dar lugar a artefactos, distorsionando el espectro de fluorescencia. Los tres tipos de dispersión más comunes que se ven en la fluorescencia son la dispersión de Rayleigh, de 2do orden y Raman (Figura 3). La dispersión de Rayleigh es la luz de excitación dispersa y, por lo tanto, alcanza su punto máximo en la longitud de onda de excitación. la dispersión de 2do orden es la dispersión de orden superior observada al doble de la longitud de onda de excitación. La dispersión Raman es una dispersión inelástica debido a disolventes y picos a una energía fija de la longitud de onda de excitación. Para diferenciar la dispersión Raman de un pico de fluorescencia, la longitud de onda de excitación se puede variar en incrementos de 5 a 10 nm y si el pico en cuestión cambia con la longitud de onda de excitación y disminuye en intensidad, ese pico se debe a la dispersión Raman. También puede comprobar si el pico está en el espectro de disolventes en blanco. Si lo es, existe la posibilidad de que sea un pico Raman. Si el pico de fluorescencia está demasiado cerca o se superpone con la dispersión Raman o Rayleigh, los anchos de banda y/o la longitud de onda de excitación se pueden ajustar para desplazar la dispersión del pico de fluorescencia. Estos efectos son más prominentes para concentraciones muy bajas de fluoróforos y, especialmente, para soluciones altamente dispersas, como proteínas, microesferas, nanopartículas y sólidos.
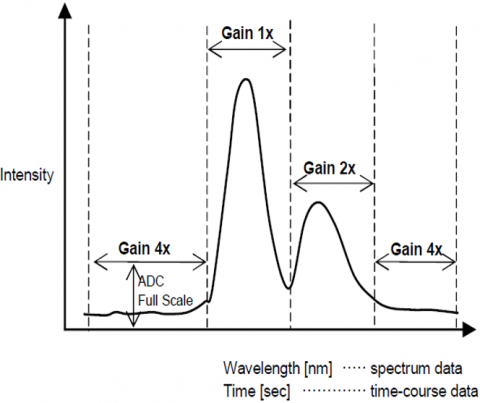
Rango dinámico
La función de Control Automático de ganancia ajusta automáticamente la ganancia de una señal del detector en función de la intensidad de fluorescencia. Esto optimiza la señal a ruido en todo el rango escaneado para mediciones espectrales o de curso de tiempo, de modo que los picos con diferentes intensidades se ajustan automáticamente para mejorar el S/N y asegurar la precisión de los resultados.
Sistema de Control Automático de Sensibilidad (SCS)
El Sistema de Control Automático de Sensibilidad(SCS) amplía el rango dinámico de la señal de fluorescencia detectada ajustando automáticamente el voltaje del detector de acuerdo con la intensidad de fluorescencia. Esto permite mediciones de longitud de onda fija o análisis cuantitativos de concentraciones sub-picomolares a micromolares sin cambiar manualmente el instrumento.

Figura 5. Curva de calibración de soluciones de fluoresceína de 5·10-13 a 1,5·10-6 M utilizando la función auto-SCS.
Aplicaciones de espectroscopia de fluorescencia
Anisotropía
La anisotropía de fluorescencia se observa cuando un fluoróforo emite luz de diferentes intensidades dependiendo de los ejes de polarización y se describe mediante la siguiente ecuación
r=Ivv-GIvh/Ivv+2GIvh
donde la intensidad de emisión es paralela a el plano de excitación y es la intensidad de emisión perpendicular al plano de excitación. G se llama factor G o factor de rejilla del instrumento y explica la dependencia de polarización del monocromador de emisión.
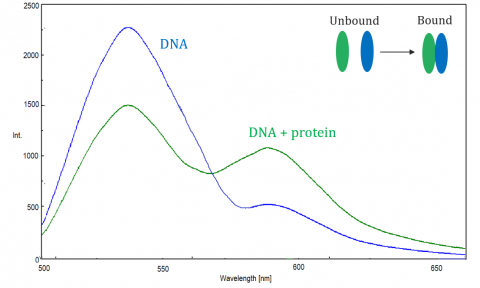
Todos los fluoróforos tienen momentos de transición que ocurren a lo largo de direcciones específicas a lo largo del eje molecular. Cuando se expone a luz polarizada, los fluoróforos orientados aleatoriamente que tienen sus momentos de transición de absorción orientados alrededor del ángulo de la luz incidente se excitarán y esta población de estado excitado se orientará parcialmente. A medida que una molécula regresa de un estado excitado a su estado fundamental, la carga de electrones se redistribuye y el cambio en la orientación de los momentos dipolares afecta las polarizaciones de excitación y emisión. Por ejemplo, cuando se emite fluorescencia antes de que una molécula gire, la luz de fluorescencia se polarizará fuertemente hacia la dirección de la polarización de la luz de excitación. Si la luz se emite después de la rotación de la molécula en una dirección completamente aleatoria, la fluorescencia ya no se polarizará.
Al medir la anisotropía de fluorescencia, los siguientes factores afectarán el movimiento molecular: (1) tamaño molecular, (2) viscosidad del entorno de la molécula, y (3) fuerza y grados de libertad de una molécula unida. Las mediciones de anisotropía determinan el desplazamiento angular promedio de un fluoróforo que ocurre entre la absorción y la emisión de un fotón. El desplazamiento angular depende de la velocidad y la extensión de la difusión rotacional durante la vida útil del estado excitado. Cuando un fluoróforo no está restringido y se le permite rotar libremente antes de volver a emitir un fotón, la velocidad de difusión es generalmente más rápida que la velocidad de emisión y la anisotropía es aproximadamente igual a cero. La difusión rotacional cambia la dirección del momento de transición que despolariza la emisión. Cuanto más restringido sea el fluoróforo, mayor será el valor de anisotropía, ya que la disminución de la flexibilidad disminuirá la tasa general de rotación.
TRASTE
La transferencia de energía de resonancia de fluorescencia (TRASTE) es un mecanismo que rige la transferencia de energía entre dos moléculas vecinas. Un donante, inicialmente en su estado excitado, puede transferir energía a una molécula aceptora a través de resonancia electrónica no radiativa.
EL TRASTE es monitoreado por el espectrofluorómetro, que mide la fluorescencia/enfriamiento del receptor o del donante excitado. La eficiencia del TRASTE depende de los siguientes factores: la distancia entre el donante y el aceptador, la superposición espectral entre el donante y el aceptador y la alineación de sus momentos dipolares. La eficiencia es inversamente proporcional a la sexta potencia de la distancia entre el donante y el receptor, lo que hace que la técnica sea extremadamente sensible a pequeños cambios en la distancia. Cuando el área de superposición del espectro de fluorescencia del donante y el espectro de absorción del aceptador es mayor, la eficiencia del TRASTE es mayor. La eficiencia del TRASTE también está en un máximo cuando los dos momentos dipolares son paralelos o anti-paralelos entre sí, y no se produce transferencia de energía cuando los momentos dipolares son perpendiculares entre sí. Típicamente, cuando la distancia entre el donante y el receptor está entre 1 y 10 nm, se produce el TRASTE.
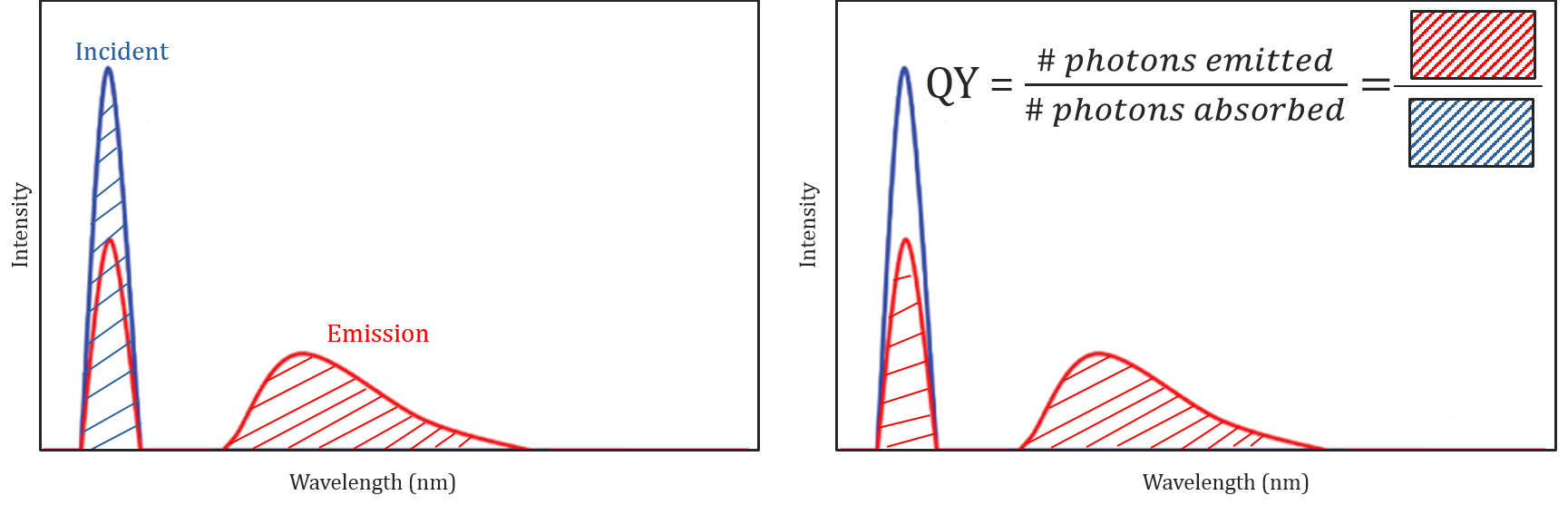
Rendimiento cuántico y Corrección Espectral
Diferentes condiciones moleculares y ambientales no solo afectan si una molécula emitirá fluorescencia o no, sino que también pueden determinar la intensidad o el rendimiento cuántico de la radiación de fluorescencia emitida. La eficiencia de una molécula a la fluorescencia se describe por su rendimiento cuántico y se define como la relación entre el número de fotones absorbidos y el número de fotones emitidos por la muestra.
En algunos casos es necesario determinar una medición espectral precisa. Esto se hace utilizando referencias a materiales calibrados conocidos. Las fuentes calibradas que se utilizan se comprueban para determinar la salida espectral absoluta en un instrumento conocido y se suministra un espectro de referencia para corregir el instrumento individual suministrado al cliente. Para que la Corrección Espectral funcione de manera efectiva, debe realizarse en cada combinación de parámetros y ancho de banda del instrumento, de modo que la Corrección Espectral a un ancho de banda espectral de 5 nm no se pueda aplicar a la medición con un SBW de 10 nm. Esto se aplica a la posición de los polarizadores si se están utilizando, así como al uso de filtros de orden superior. Es necesario realizar la Corrección Espectral para cada combinación de anchos de banda espectrales a utilizar por el cliente, para la inclusión o exclusión de la selección de filtros de orden superior y para las posiciones de los polarizadores, si están instalados. Las longitudes de onda de excitación y emisión de la muestra determinarán qué solución/fuente de luz se utiliza para la calibración.
Infrarrojo cercano
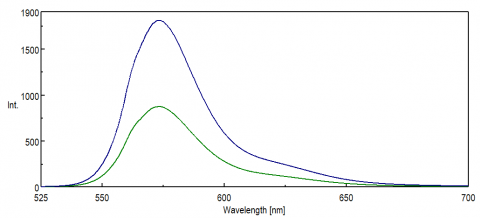
Para aplicaciones que sondean la región NIR del espectro, la respuesta espectral del detector PMT es crítica para obtener datos. En el extremo rojo de la región visible, en el NIR, la eficiencia cuántica del PMT disminuye significativamente, lo que resulta en poca o ninguna intensidad de señal durante las mediciones de la muestra. Los experimentos de TRASTE y los colorantes y sondas NIR se monitorizan con frecuencia en longitudes de onda superiores a 500 nm y en muchos casos tienen señales pequeñas, incluso para una técnica tan sensible como la fluorescencia. La Figura 8 ilustra la diferencia en la intensidad de fluorescencia de la rodamina B usando una PMT estándar en comparación con una PMT que es más sensible a las longitudes de onda en el extremo rojo del espectro.
Técnica Complementaria:
Espectroscopia de dicroísmo circular
La espectroscopia de dicroísmo circular (CD) es una técnica analítica esencial utilizada para analizar la quiralidad en moléculas a través de su actividad óptica. La EC se puede aplicar a una amplia variedad de estructuras moleculares, pero ha encontrado el favor en la comunidad científica para la elucidación de la estructura macromolecular, especialmente las proteínas y los ácidos nucleicos.